扩展功能
文章信息
- 杨莉, 王雪雯, 周明, 张帆
- YANG Li, WANG Xuewen, ZHOU Ming, ZHANG Fan
- As2O3联合γ分泌酶抑制剂MW167对人肝癌HepG2/ADM细胞耐药性的影响
- Effect of arsenic trioxide combined with γ-secretase inhibitor MW167 on drug resistance of human hepatocellular carcinoma HepG2/ADM cells
- 吉林大学学报(医学版), 2018, 44(01): 1-7
- Journal of Jilin University (Medicine Edition), 2018, 44(01): 1-7
- 10.13481/j.1671-587x.20180101
-
文章历史
- 收稿日期: 2017-05-22
2. 石河子大学医学院病理生理学教研室, 新疆 石河子 832002
2. Department of Pathophysiology, School of Medical Sciences, Shihezhi University, Shihezhi 832002, China
肝细胞癌(hepatocellular carcinoma,HCC)是最常见的恶性肿瘤之一。尽管HCC的最佳治疗方法是根治性手术治疗,但大多数患者在明确诊断时因多种并发症已失去手术指征,大多数不可切除的HCC患者和已经完成手术治疗的患者均需行全身化疗。虽然不断有新的化疗方案涌现,但肿瘤多药耐药(multidrug resistance, MDR)的存在既限制了化疗效果,也是导致肝癌复发转移的重要原因[1],因此阐明MDR机制对于防治肝癌及其复发转移至关重要。研究[2]发现:三氧化二砷(As2O3)可抑制多药耐药人肝细胞癌R-HepG2细胞的增殖,且该细胞对As2O3的敏感性与亲本细胞的敏感性相似;也有研究[3]显示:As2O3能够抑制乳腺癌SKBR-3细胞Notch-1的表达及抑制细胞增殖和迁移。Notch-1基因作为Notch信号通路中一个关键的受体基因在该通路中发挥着重要的作用[4]。γ分泌酶抑制剂作用于Notch信号通路的第三部酶切反应,从而抑制Notch信号通路的活化;Hes-1为活化的Notch通路的靶基因,主要参与调节细胞的凋亡、增殖和分化。Hu等[5]研究发现:As2O3能够呈剂量和时间依赖性地抑制骨髓瘤细胞Notch-1受体其下游基因Hes-1的表达。细胞凋亡是基因调控的细胞程序性死亡,Bcl-2为抗凋亡基因,Bax为促凋亡基因,Bcl-2和Bax比例失衡在肿瘤发生和肿瘤耐药过程中可能发挥重要作用,采用As2O3处理Saos-2阿霉素(ADM)耐药细胞后Bcl-2和Bcl-xL表达水平下调,Bax表达水平上调[6]。本研究拟探讨As2O3和MW167(γ分泌酶抑制剂)对HepG2/ADM细胞耐药性的影响及其作用机制,为阐明As2O3和Notch-1信号通路逆转肝癌HepG2/ADM细胞耐药的相关机制提供理论依据。
1 材料与方法 1.1 细胞系、主要试剂和仪器人肝癌HepG2/ADM细胞株购自中国广州吉赛生物科技有限公司,在含有10%胎牛血清、1%青霉素和链霉素(美国HyClone公司)及0.1 mg·L-1ADM(深圳万乐药业股份有限公司)的高糖DMEM(美国Gibco公司)培养基中培养,实验前1周去除含ADM的培养基,改为普通培养,置于37℃、5% CO2、饱和湿度的培养箱(美国Thermo公司)中孵育,取对数生长期细胞用于实验。As2O3(北京双鹭药业股份有限公司),γ分泌酶抑制剂Ⅱ MW167(德国Merck公司),二甲基亚砜(DMSO)和5-二苯基四氮唑溴盐(MTT)(美国Sigma公司),兔抗人单克隆抗体Notch-1(#4380s)、Hes-1(#11988s)、MDR-1(#13342s)、Bcl-2(#2870s)和Bax(#5023s)(美国CST公司),RT-PCR逆转录试剂盒和ECL化学发光试剂(美国Thermo公司),内参β-actin和辣根过氧化物酶(HRP)标记的二抗(北京中杉金桥公司),常规生物化学试剂(新疆宝信生物公司)。一次性细胞培养器材购自美国Corning公司,PCR仪(日本TaKaRa公司),倒置荧光相差显微镜IX71(日本OLYMPUS公司),全自动酶标仪(美国Thermo公司),流式细胞仪(美国BD公司),凝胶成像仪(GEL-DOC 2000,美国Bio-Rad公司)。
1.2 MTT法检测肿瘤细胞增殖抑制率取对数生长期HepG2/ADM细胞,以1×104个/孔的密度接种于96孔板,培养24 h后,使细胞暴露在不同浓度的As2O3和MW167中,As2O3终浓度分别为0.25、0.50、1.00、2.00、4.00和8.00 mg·L-1,MW167终浓度分别为10、20和40 μmol·L-1,同时设对照孔和调零孔,每个浓度设5个复孔。加药后分别培养24、48和72 h,每孔加入MTT(5 g·L-1)10 μL,37℃避光孵育4 h,弃上清液后,每孔加入150 μL DMSO,酶标仪中速震荡10 min,测定490 nm处的吸光度(A)值。计算细胞增殖抑制率。细胞抑制率=[1-(Ax-A)/(A0-A)]×100%(Ax为加药孔A值,A0为空白孔A值,A为调零孔A值)。实验重复3次,选取细胞增殖抑制率 < 15%的药物浓度为该药的无细胞毒性浓度。
1.3 实验分组将HepG2/ADM细胞分为空白组、As2O3组、MW167组和As2O3与MW167联合组。细胞以1×106个/皿接种于60 mm培养皿中,培养24 h后,根据MTT实验结果选择无细胞毒剂量药物(抑制率Z < 15%),即0.25 mg·L-1 As2O3和10 μmol·L-1 MW167单独和联合处理各组细胞48 h后,进行相关指标检测。
1.4 Annexin Ⅴ/PI双染法检测细胞凋亡取加药干预48 h后的各组细胞,按AnnexinⅤ-FITC凋亡检测试剂盒说明书操作。1 h内用流式细胞仪检测细胞凋亡率,采用自带FACSDiva Version 6.1.3软件进行数据分析。
1.5 RT-PCR法检测细胞中Notch-1、Hes-1、MDR-1、Bcl-2和Bax mRNA表达水平PCR引物由上海生工生物工程有限公司合成并鉴定,引物上下游序列和产物大小见表 1。采用Trizol法提取各组细胞总RNA,纳微量分光光度计测定总RNA浓度及纯度,按照RT-PCR逆转录试剂盒说明书进行逆转录。以cDNA为模板,GADPH为内参,用RT-PCR试剂盒对mRNA进行多聚酶链式反应。cDNA扩增完成后取其产物10 μL行琼脂糖凝胶电泳,电泳结束后,凝胶成像仪成像并拍照,Image Lab软件检测条带并进行A值分析。目的基因mRNA的相对表达量=目的基因A值/GADPH基因A值。
| Gene | Primer sequence (5′-3′) | Size(bp) |
| Notch-1 | F:GACATCACGGATCATATGGA R:CTCGCATTGACCATTCAAAC |
666 |
| Hes-1 | F:TCAACACGACACCGGATAAA R:CCGCGAGCTATCTTTCTTCA |
152 |
| MDR-1 | F:CTGGTTTGATGTGCACGATGTTGG R:TGCCAAGACCTCTTCAGCTACTG |
296 |
| Bcl-2 | F:GAGTGATGGATTGCAT R:CAGAATATCAGCCACCTCTT |
246 |
| Bax | F:ATGCGTCCACCAAGAAGC R:CATTGAAGTTGCCATCAGC |
150 |
| GADPH | F:ACCACAGTCCATGCCATCAC R:TCCACCACCTGTTGCTGTA |
496 |
采用RIPA法提取总蛋白,根据BCA蛋白浓度测定试剂盒测定并调整蛋白浓度一致,加入5×SDS上样缓冲液,100℃变性8 min;取20 μg蛋白上样进行SDS-PAGE (8%~10%分离胶、5%浓缩胶);将蛋白电转移至PVDF膜上;5%脱脂奶粉封闭1 h,弃封闭液,加入相应抗体(1:1 000),4℃孵育过夜;次日,TBST洗膜后加入二抗(1:20 000~1:50 000)室温孵育1 h,TBST洗膜后加入ECL化学发光试剂,进入暗室压片,显影,定影。用凝胶成像仪分析系统Image Lab软件对检测条带进行灰度值扫描,Gel-Pro Analyzer 4软件进行分析。目的蛋白的相对表达量=目的蛋白条带灰度值/β-actin条带灰度值。
1.7 统计学分析采用SPSS 17.0统计软件进行统计学分析。各组细胞增殖抑制率、凋亡率,Notch-1、Hes-1、MDR-1(P-gp)、Bcl-2和Bax mRNA及蛋白表达水平均以x±s表示,在符合正态分布前提下进行t检验或单因素方差分析。以P < 0.05表示差异有统计学意义。
2 结果 2.1 不同浓度As2O3和MW167作用后HepG2/ADM细胞增殖抑制率不同浓度As2O3和MW167均可不同程度抑制HepG2/ADM细胞的增殖;在同一浓度时,As2O3和MW167对HepG2/ADM细胞增殖抑制率随作用时间的延长而升高(P < 0.05或P < 0.01);在同一时间点,As2O3和MW167对HepG2/ADM细胞增殖抑制率随药物浓度的增加而升高(P < 0.05或P < 0.01)。见图 1。0.25 mg·L-1 As2O3和10 μmol·L-1 MW167作用HepG2/ADM细胞48 h后增殖抑制率为(14.4±2.54)%和(13.6±1.08)%;在抑制率 < 15%前提下,As2O3和MW167作用24 h对细胞的增殖抑制作用较弱;在72 h时,其抑制率>15%。故本实验后期选定药物干预细胞时间为48 h,确定As2O3干预细胞浓度为0.25 mg·L-1,MW167干预细胞浓度为10 μmol·L-1。
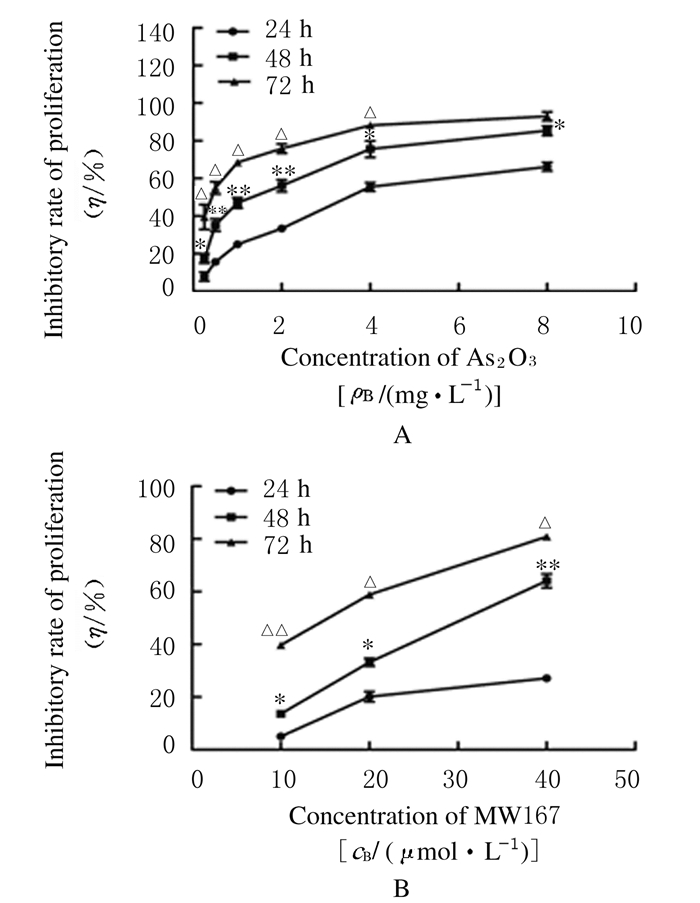
|
| n=3; * P < 0.05, * * P < 0.01 compared with 24 h; △ P < 0.05, △△ P < 0.01 compared with 48 h. 图 1 不同剂量As2O3(A)和MW167(B)作用HepG2/ADM细胞不同时间后细胞增殖抑制率曲线 Figure 1 Inhibitory curves of Proliferation of HepG2/ADM cells treated with different doses of As2O3(A) and MW167(B) for different time |
|
|
As2O3组和MW167组细胞凋亡率分别为(36.2±0.65)%和(42.6±0.70)%,均高于空白组[(4.43±0.21)%](P < 0.05),联合组细胞凋亡率为(52.1±0.32)%,明显高于空白组、As2O3组和MW167组(P < 0.01)。见图 2。
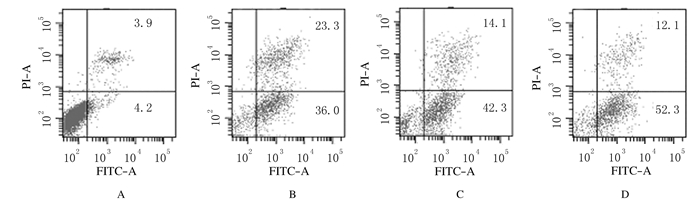
|
| A:Blank group; B:As2O3 group; C:MW167 group; D:Combination group. 图 2 FCM检测药物干预48 h后各组HepG2/ADM细胞凋亡率 Figure 2 Apoptotic rates of HepG2/ADM cells in various groups 48 h after intervention detected by FCM |
|
|
药物干预HepG2/ADM细胞48 h后,与空白组比较,As2O3组和MW167组细胞中Notch-1、Hes-1、MDR-1和Bcl-2 mRNA表达水平均降低(P < 0.05),Bax mRNA表达水平升高(P < 0.05);与空白组比较,联合组细胞中Notch-1、Hes-1、MDR-1和Bcl-2 mRNA表达水平明显降低(P < 0.01),Bax mRNA表达水平明显升高(P < 0.01)。见图 3和表 2。
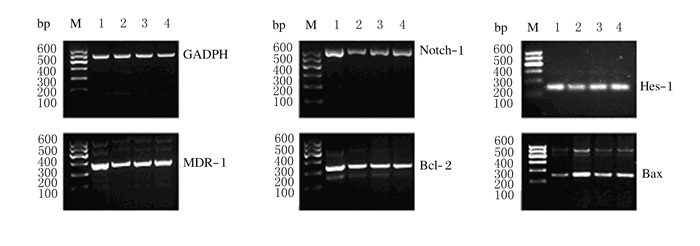
|
| M:DNA marker; Lane 1:Blank group; Lane 2:Combination group; Lane 3:MW167 group; Lane 4:As2O3 group. 图 3 RT-PCR法检测各组HepG2/ADM细胞中Notch-1、Hes-1、MDR-1、Bcl-2和Bax mRNA表达电泳图 Figure 3 Electrophoregram of expressions of Notch-1, Hes-1, MDR-1, Bcl-2 and Bax mRNA in HepG2/ADM cells in various groups detected by RT-PCR method |
|
|
| (n=3, x±s) | |||||
| Group | Notch-1mRNA | Hes-1mRNA | MDR-1mRNA | Bcl-2mRNA | BaxmRNA |
| Blank | 1.491±0.009 | 1.325±0.005 | 1.506±0.025 | 1.497±0.053 | 0.537±0.023 |
| As2O3 | 1.192±0.015* | 0.913±0.018* | 1.064±0.005* | 1.197±0.042* | 0.731±0.028* |
| MW167 | 1.049±0.019* | 1.106±0.026* | 0.965±0.019* | 1.065±0.049* | 0.690±0.016* |
| Combination | 0.999±0.014** | 0.853±0.017** | 0.851±0.028** | 1.008±0.054** | 0.830±0.041** |
| * P < 0.05, * * P < 0.01 compared with blank group. | |||||
药物干预HepG2/ADM细胞48 h后,与空白组比较,As2O3组和MW167组细胞中Notch-1、Hes-1、P-gp和Bcl-2蛋白表达水平降低(P < 0.05),Bax蛋白表达水平升高(P < 0.05);与空白组比较,联合组细胞中Notch-1、Hes-1、P-gp和Bcl-2蛋白表达水平明显降低(P < 0.01),Bax蛋白表达水平明显升高(P < 0.01)。见图 4和表 3。

|
| Lane 1:Blank group; Lane 2:Combination group; Lane 3:MW167 group; Lane 4:As2O3 group. 图 4 Western blotting法检测各组HepG2/ADM细胞中Notch-1、Hes-1、P-gp、Bcl-2和Bax蛋白表达电泳图 Figure 4 Electrophoregram of expressions of Notch-1, Hes-1, P-gp, Bcl-2 and Bax protein in HepG2/ADM cells in various groups detected by Western blotting method |
|
|
| (n=3, x±s) | |||||
| Group | Notch-1 protein | Hes-1 protein | P-gp protein | Bcl-2 protein | Bax protein |
| Blank | 1.524±0.013 | 0.833±0.012 | 1.302±0.003 | 0.935±0.004 | 0.212±0.011 |
| As2O3 | 1.268±0.010* | 0.625±0.011* | 0.921±0.006* | 0.697±0.012* | 0.428±0.006* |
| MW167 | 1.254±0.006* | 0.608±0.090* | 0.903±0.002* | 0.651±0.011* | 0.374±0.009* |
| Combination | 1.035±0.007** | 0.471±0.010** | 0.701±0.004** | 0.590±0.009** | 0.506±0.010** |
| * P < 0.05, * * P < 0.01 compared with blank group. | |||||
肿瘤细胞MDR机制很多,其中以细胞内药物蓄积减少、细胞内解毒酶活性增高、细胞凋亡减少及TopoⅡ水平下降引起的细胞耐药最常见,以P-gp作为药物外流泵而引起药物外流是耐药性产生的主要原因[7]。目前,探索肿瘤的耐药机制、寻求低毒高效的化疗药物及实施联合用药已成为国内外研究热点。
As2O3是中国最古老的毒物之一,作为药物应用已有2 400多年的历史[8]。20世纪70年代,我国学者首次提出As2O3具有诱导细胞凋亡和分化的作用,可有效治疗急性早幼粒细胞白血病(APL)。大量研究[9-12]显示:As2O3对实体肿瘤,如非小细胞肺癌、膀胱癌、宫颈癌和多发性骨髓瘤等,也有诱导凋亡或抑制增殖的作用。近年来对As2O3抗肿瘤机制的研究[13-15]显示:As2O3可以提高化疗耐药细胞对药物的敏感性,但是具体机制并无统一定论,可能是降低耐药蛋白的表达或诱导凋亡抑制肿瘤细胞生长。本实验结果显示:As2O3能有效抑制HepG2/ADM细胞的增殖,并且其抑制作用呈剂量-时间依赖性;同时凋亡实验显示:As2O3能提高HepG2/ADM细胞的凋亡率;As2O3可降低HepG2/ADM细胞中耐药基因MDR-1及其蛋白P-gp的表达,且降低抗凋亡蛋白Bcl-2的表达,升高促凋亡蛋白Bax的表达。已有研究及本实验结果表明:As2O3可通过抑制细胞增殖、诱导细胞凋亡和下调P-gp的表达,有效地逆转HepG2/ADM细胞的耐药性。
Notch信号的活化是通过相邻细胞的Notch配体与受体相互作用,Notch受体经过3次酶切,经γ分泌酶复合体酶切释放Notch受体胞内区(NICD),NICD依附特异性DNA结合蛋白定位于细胞核,与转录因子复合物CSL结合,随后导致Notch典型的靶基因的活化:myc、P21和Hes家族成员[16-17]。许多肿瘤的发生与该信号通路的异常激活有关。近年来,关于Notch信号通路与肿瘤耐药的关系成为研究的热点。Rizzo等[18]证实:通过小干扰RNA(small interfering RNA,siRNA)或γ分泌酶抑制剂下调Notch-1活性可潜在地增强乳腺癌细胞对他莫昔芬的敏感性。Meng等[19]发现:抑制Notch-1活性能增加结肠癌细胞系HCT116和SW620对奥沙利铂、5-氟尿嘧啶以及伊立替康的化疗敏感性,促进肿瘤细胞凋亡。本研究选用Notch通路抑制剂MW167作用于HepG2/ADM细胞,结果显示:MW167能明显抑制HepG2/ADM细胞的增殖,并且其抑制作用呈时间-剂量依赖性;凋亡实验进一步表明MW167可提高HepG2/ADM细胞的凋亡率,且MW167可降低HepG2/ADM细胞中Notch-1、Hes-1和MDR-1(P-gp)mRNA及蛋白的表达。研究[20]显示:As2O3能抑制急性淋巴细胞白血病Mol-4细胞的增殖,下调Notch-1基因和蛋白的表达,降低Bcl/Bax蛋白比例,并促进凋亡蛋白caspase-3的活化。本研究结果显示:As2O3降低了HepG2/ADM细胞中Notch-1和Hes-1、MDR-1 mRNA及蛋白的表达水平,As2O3联合MW167干预HepG2/ADM细胞后下调细胞中Notch-1、Hes-1和MDR-1(P-gp)mRNA及蛋白的表达水平更明显。本研究结果证明:Notch-1信号通路的异常激活参与了HepG2/ADM细胞耐药性的产生,抑制Notch-1通路能有效抑制HepG2/ADM细胞的耐药性;As2O3逆转耐药可能与Notch-1信号通路存在共同通路。
Bcl-2蛋白家族是调节凋亡的原癌基因,包括抗凋亡成员Bcl-2、Bcl-xL、Bcl-w、Bfl-1和Mcl-1等以及促凋亡成员Bax、Bak、Bok、Bad、Bid和Bik等[21]。Bcl-2家族抗凋亡蛋白和促凋亡蛋白比例失衡在肿瘤发生和肿瘤耐药过程中可能发挥重要作用。Lin等[22]发现:将促凋亡基因Bax转染高表达Bcl-2和Bcl-xL的卵巢癌耐药细胞,可使细胞凋亡增加。在As2O3对大鼠HCC作用的研究[23]中发现:Bcl-2或Bax的表达水平随As2O3的剂量变化而变化,Bcl-2/Bax的下调伴随凋亡的上调。本研究结果显示:As2O3和MW167均能降低HepG2/ADM细胞中Bcl-2 mRNA和蛋白的表达水平,增加Bax mRNA和蛋白的表达水平;As2O3联合MW167干预HepG2/ADM细胞后显示:联合组细胞凋亡率明显高于单药组, 且联合组细胞中Bcl-2 mRNA和蛋白表达水平降低更明显,Bax mRNA和蛋白表达水平升高更明显。本实验结果表明:As2O3和MW167可通过调节Bcl-2蛋白家族引起HepG2/ADM细胞的凋亡。
综上所述,As2O3能有效逆转HepG2/ADM细胞的耐药性,且此过程与Notch-1通路有密切关联。但本研究是基于体外细胞水平的研究,缺乏全面代表性;另外,Notch-1通路只是Notch通路的一部分,对其他通路与肝细胞癌耐药的影响缺乏研究。As2O3通过Notch-1信号通路逆转HepG2/ADM细胞的耐药性还需要进行大量临床实验研究,以期为肝癌的治疗提供更加全面的实验依据和新的治疗靶点。
| [1] | Qian JQ, Sun P, Pan ZY, et al. Annonaceous acetogenins reverses drug resistance of human hepatocellular carcinoma BEL-7402/5-FU and HepG2/ADM cell lines[J]. Int J Clin Exp Pathol, 2015, 8(9): 11934–11944. |
| [2] | Chan JY, Siu KP, Fung KP, et al. Effect of arsenic trioxide on multidrug resistant hepatocellular carcinoma cells[J]. Cancer Lett, 2006, 236(2): 250–258. DOI:10.1016/j.canlet.2005.05.017 |
| [3] | 李友建, 夏俊, 赵锐, 等. 三氧化二砷对人乳腺癌SKBR-3细胞增殖及Notch1表达的影响[J]. 中国中西医结合杂志, 2012, 32(6): 793–796. |
| [4] | Huang X, Ma J, Xu J, et al. Simvastatin induces growth inhibition and apoptosis in HepG2 and Huh7 hepatocellular carcinoma cells via upregulation of Notch 1 expression[J]. Mol Med Rep, 2015, 11(3): 2334–2340. DOI:10.3892/mmr.2014.2976 |
| [5] | Hu J, Huang X, Hong X, et al. Arsenic trioxide inhibits the proliferation of myeloma cell line through notch signaling pathway[J]. Cancer Cell Int, 2013, 13(1): 25. DOI:10.1186/1475-2867-13-25 |
| [6] | Zhao H, Guo W, Peng C, et al. Arsenic trioxide inhibits the growth of Adriamycin resistant osteosarcoma cells through inducing apoptosis[J]. Mol Biol Rep, 2010, 37(5): 2509–2515. DOI:10.1007/s11033-009-9765-2 |
| [7] | Chakravarty G, Mathur A, Mallade P, et al. Nelfinavir targets multiple drug resistance mechanisms to increase the efficacy of doxorubicin in MCF-7/Dox breast cancer cells[J]. Biochimie, 2016, 124: 53–64. DOI:10.1016/j.biochi.2016.01.014 |
| [8] | Waxman S, Anderson KC. History of the development of arsenic derivatives in cancer therapy[J]. Oncologist, 2001, 6(Suppl 2): 3–10. |
| [9] | Li H, Zhu X, Zhang Y, et al. Arsenic trioxide exerts synergistic effects with cisplatin on non-small cell lung cancer cells via apoptosis induction[J]. J Exp Clin Cancer Res, 2009, 28: 110. DOI:10.1186/1756-9966-28-110 |
| [10] | Wang Y, An R, Dong X, et al. Protein kinase C is involved in arsenic trioxide-induced apoptosis and inhibition of proliferation in human bladder cancer cells[J]. Urol Int, 2009, 82(2): 214–221. DOI:10.1159/000200803 |
| [11] | Yu J, Qian H, Li Y, et al. Therapeutic effect of arsenic trioxide (As2O3) on cervical cancer in vitro and in vivo through apoptosis induction[J]. Cancer Biol Ther, 2007, 6(4): 580–586. DOI:10.4161/cbt.6.4.3887 |
| [12] | He X, Yang K, Chen P, et al. Arsenic trioxide-based therapy in relapsed/refractory multiple myeloma patients:a meta-analysis and systematic review[J]. Oncol Targets Ther, 2014, 7(default): 1593–1599. |
| [13] | Chen J, Cheng J, Yi J, et al. Differential expression and response to arsenic stress of MRPs and ASAN1 determine sensitivity of classical multidrug-resistant leukemia cells to arsenic trioxide[J]. Leuk Res, 2016, 50: 116–122. DOI:10.1016/j.leukres.2016.10.003 |
| [14] | Zhao D, Jiang Y, Dong X, et al. Arsenic trioxide reduces drug resistance to adriamycin in leukemic K562/A02 cells via multiple mechanisms[J]. Biomed Pharmacother, 2011, 65(5): 354–358. DOI:10.1016/j.biopha.2011.04.016 |
| [15] | Zhao H, Guo W, Peng C, et al. Arsenic trioxide inhibits the growth of adriamycin resistant osteosarcoma cells through inducing apoptosis[J]. Mol Biol Rep, 2010, 37(5): 2509–2515. DOI:10.1007/s11033-009-9765-2 |
| [16] | Komoto C, Nakamura T, Yamamori M, et al. Reversal effects of Ca2+ antagonists on multidrug resistance via down-regulation of MDR1 mRNA[J]. Kobe J Med Sci, 2008, 53(6): 355–363. |
| [17] | Liu J, Shen JX, Wen XF, et al. Targeting Notch degradation system provides promise for breast cancer therapeutics[J]. Crit Rev Oncol Hematol, 2016, 104: 21–29. DOI:10.1016/j.critrevonc.2016.05.010 |
| [18] | Rizzo P, Miao H, D'Souza G, et al. Cross-talk between notch and the estrogen receptor in breast cancer suggests novel therapeutic approaches[J]. Cancer Res, 2008, 68(13): 5226–5235. DOI:10.1158/0008-5472.CAN-07-5744 |
| [19] | Meng RD, Shelton CC, Li YM, et al. gamma-Secretase inhibitors abrogate oxaliplatin-induced activation of the Notch-1 signaling pathway in colon cancer cells resulting in enhanced chemosensitivity[J]. Cancer Res, 2009, 69(2): 573–582. DOI:10.1158/0008-5472.CAN-08-2088 |
| [20] | 刘海艳, 沈莉菁, 陈芳源, 等. 三氧化二砷对Molt-4细胞株Notch信号通路作用机制的研究[J]. 内科理论与实践, 2015, 10(1): 35–40. |
| [21] | Hsu SY, Hsueh AJ. Tissue-specific Bcl-2 protein partners in apoptosis:An ovarian paradigm[J]. Physiol Rev, 2000, 80(2): 593–614. DOI:10.1152/physrev.2000.80.2.593 |
| [22] | Lin J, Page C, Jin X, et al. Suppression activity of pro-apoptotic gene products in cancer cells, a potential application for cancer gene therapy[J]. Anticancer Res, 2001, 21(2A): 831–839. |
| [23] | Zhang T, Wang SS, Hong L, et al. Arsenic trioxide induces apoptosis of rat hepatocellularcarcinoma cells in vivo[J]. J Exp Clin Cancer Res, 2003, 22(1): 61–68. |
 2018, Vol. 44
2018, Vol. 44


