扩展功能
文章信息
- 唐颖, 黄元平, 荆文花, 关英慧
- TANG Ying, HUANG Yuanping, JING Wenhua, GUAN Yinghui
- 头孢哌酮钠舒巴坦钠对反复下呼吸道感染患者中性粒细胞胞外网状陷阱形成的影响
- Effect of sulbactam sodium/cefoperazone sodium on neutrophil extracellular traps of patients with recurrent lower respiratory tract infection
- 吉林大学学报(医学版), 2017, 43(03): 607-610
- Journal of Jilin University (Medicine Edition), 2017, 43(03): 607-610
- 10.13481/j.1671-587x.20170327
-
文章历史
- 收稿日期: 2016-08-26
反复下呼吸道感染是临床最为常见的呼吸系统疾病,但具体发病机制目前尚未完全清楚。中性粒细胞胞外网状陷阱(neutrophil extracellular traps,NETs)是2004年Brinkmann等[1]发现的中性粒细胞杀菌的第2种机制。中性粒细胞通过在胞外形成由核酸物质和颗粒蛋白组成的网状结构,捕杀病原体,发挥抗细菌免疫应答反应,已成为近年来研究的热点[2]。头孢哌酮钠舒巴坦钠为头孢哌酮与舒巴坦的复方制剂[3],是治疗下呼吸道感染的常用、广谱和高效抗生素,主要通过在细菌繁殖期抑制敏感细菌细胞壁粘肽的生物合成而达到杀菌作用,但对NETs的作用目前尚未见报道。本研究通过评价头孢哌酮钠舒巴坦钠对反复下呼吸道感染患者外周血NETs的影响,阐明头孢哌酮钠舒巴坦钠在反复下呼吸道感染患者中的杀菌作用及其可能机制。
1 资料与方法 1.1 一般资料根据患者意愿,收集2015年3—12月在本院呼吸内科住院治疗的36例反复下呼吸道感染患者的临床资料作为病例组,其中男性20例,女性16例,年龄45~70岁,平均年龄(53±12) 岁。所有患者均于入选前行肺CT检查提示肺内感染,近1年内住院次数≥2次,近1个月内未应用过全身糖皮质激素及免疫抑制剂;排除并发支气管扩张、慢性阻塞性肺疾病、支气管哮喘和肺结核等肺部疾病患者;无其他慢性心脏疾病、甲亢结缔组织病等疾病;所有患者了解并同意参加本方案。选取同期年龄、性别等与患者相匹配的健康体检者30名作为健康对照组。本研究获本院伦理委员会同意(2014-078),所有研究对象均签署知情同意书。
1.2 研究方法所有健康对照组研究对象均于入组后第2天抽取乙二胺四乙酸(EDTA)抗凝全血10 mL;病例组反复下呼吸道感染患者需抽取全血20 mL,其中10 mL用于常规NETs检测(药物处理前),另外10 mL用于检测头孢哌酮舒巴坦钠对NETs的作用(药物处理后)。
1.3 NETs形成的检测[4]① 利用中性粒细胞分离液(AXIS-SHIELD)分离中性粒细胞,将分离的中性粒细胞用1640培养基稀释(浓度4× 105 mL-1),药物处理组则在细胞培养液加入头孢哌酮舒巴坦钠(选用3个浓度进行摸索:1、10和100mg·L-1,选用3个培养时间进行摸索:1、2和3 h;最终选用浓度:100 mg·L-1;培养时间:2 h)。② 将细胞悬起,转移至预包被了多聚赖氨酸的载玻片上,晾干后,PBS洗涤1次,采用4%多聚甲醛固定细胞(用于免疫荧光检测);另一部分细胞采用2.5%戊二醛固定(用于扫描电镜检测)。③ 免疫荧光染色:从4℃冰箱取出玻片,室温平衡30 min;PBS洗涤3次;在封闭液中分别加入Histone 2B(1:1 000),Neutrophil Elastase(1:250),室温孵育2 h;PBS洗涤3次;加入含有DAPI的荧光抗淬灭剂(mounting medium),盖上盖玻片,封片。2名研究员使用荧光显微镜独立观察NETs结构。④ 扫描电镜检测:采用PBS清洗3次,每次10 min;分别用30%、50%、70%、80%和90%乙醇梯度脱水各15 min,再用100%乙醇脱水3次,每次15 min;用叔丁醇置换3次,每次30 min;用真空冷冻干燥机(LGJ-10C,北京四环公司)干燥样品过夜;用双面胶带将样品粘到样品台上;用真空离子溅射仪(JEE-420,JEOL公司)给样品镀10 nm金膜;场发射扫描电镜(S-4800,日本日立公司)拍摄照片。
1.4 免疫荧光染色半定量检测NETs的形态表现和计数为便于对NETs形成进行半定量,本研究参照Obermayer等[5]的方法对中性粒细胞进行定义:① NETs形成细胞。出现细胞外纤维结构,PI染色、NE染色阳性;② NETs形成前体细胞。细胞结构尚完整,但出现细胞核形态表现改变;③ 未激活中性粒细胞。细胞结构完整,其内可见分叶核。NETs形成情况标准:如果样本任一视野内出现NETs形成细胞则认定为Ⅰ级,仅出现NETs前体细胞为Ⅱ级,细胞均为未激活中性粒细胞则为Ⅲ级。
1.5 电镜下检测NETs的形成电镜下中性粒细胞染色质呈网状释放至胞外,即大量NETs形成;中性粒细胞外无明显网状结构,则表示无NETs形成。
1.6 统计学分析采用SPSS16.0统计软件进行统计学分析。健康对照组和病例组研究对象血中不同级别NETs形成细胞数量比较采用χ2检验。以α = 0.05为检验水准。
2 结果 2.1 一般资料2组研究对象之间的年龄和性别比较差异无统计学意义(P>0.05),病例组患者白细胞(WBC)数、D-二聚体、C反应蛋白(CRP)及降钙素原(PCT)水平明显高于健康对照组(P<0.05),而血小板(PLT)数低于健康对照组(P<0.05)。见表 1。
| Group | n | Age (year) |
Gender (M/F) |
WBC (×109 L-1) |
PLT (×109 L-1) |
D-Dimer [ρB/(μg·L-1)] |
PCT [ρB/(μg·L-1)] |
CRP [ρB/(mg·L-1)] |
| Healthy Control | 30 | 56 | 18/12 | 7.02 | 212 | 110 | 0.06 | 3.18 |
| Case | 36 | 58 | 22/14 | 10.63* | 168* | 432* | 1.28* | 38.60* |
| * P < 0.05 vs healthy control group. | ||||||||
NETs形成细胞:中性粒细胞细胞膜破裂,释放出弥散的细胞核,形成典型的网状结构;NETs形成前体细胞:细胞核形态改变,失去分叶状结构,呈现出小而致密的圆形核结构或细胞核弥散变大,核染色稀疏;未激活中性粒细胞:中性粒细胞均匀分布,细胞核呈典型分叶状,荧光染色剂不能透过细胞膜。见图 1(封三)。
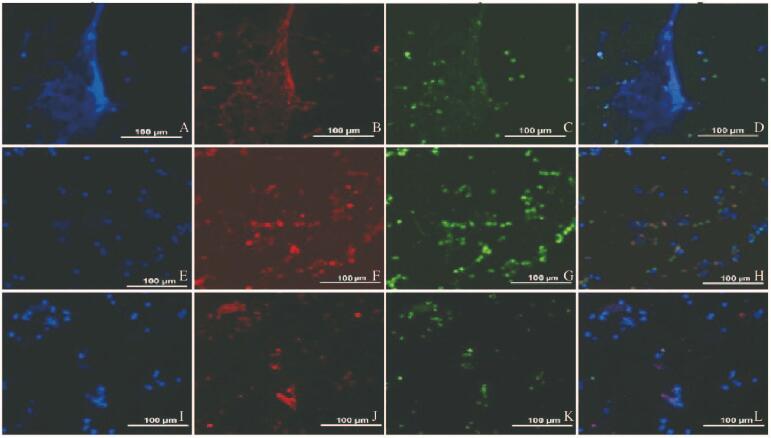
|
| A—D: Grade Ⅰ; E—H: Grade Ⅱ; I—L: Grade Ⅲ; A, E, I: Dapi; B, F, J: Anti-Histone H2B; C, G, K: Anti-Neutrophil Elastase; D, H, L: Merge. 图 1 不同级别NETs的形态表现 Figure 1 Morphology of NETs with different grades |
|
|
病例组患者Ⅰ和Ⅱ级NETs形成细胞数量明显多于健康对照组(P<0.05),而Ⅲ级NETs形成细胞数量则少于健康对照组(P<0.05)。见表 2。
| Group | n | Ⅰ | Ⅱ | Ⅲ |
| Healthy control | 30 | 0 | 1 | 29 |
| Case | 36 | 22* | 14* | 0* |
| *P < 0.05 vs healthy control group. | ||||
头孢哌酮钠舒巴坦钠处理前病例组患者Ⅰ和Ⅱ级NETs形成细胞数量明显多于处理后(P<0.05),而Ⅲ级NETs形成细胞数量明显少于处理后(P<0.05),见表 3。药物处理前免疫荧光染色和电镜结果显示:中性粒细胞细胞膜破裂,形成网状结构释放至胞外,药物处理后中性粒细胞外无明显网状结构。典型的免疫荧光染色和电镜结果见图 2(封三)。
| (n=6) | |||
| Group | Ⅰ | Ⅱ | Ⅲ |
| Before treatment | 22 | 14 | 0 |
| After treatment | 0* | 4* | 32* |
| * P < 0.05 vs before treatment. | |||

|
| A, B: Immunofluorescence; C, D: SEM; A, C: Before treatment; B, D: After treatment. 图 2 头孢哌酮钠舒巴坦钠处理前后NETs的表达情况 Figure 2 Expressions of NETs before and after treated with sulbactam sodium/cefoperazone vSodium |
|
|
中性粒细胞是人体抵御外来微生物入侵的第一道防线,是固有性免疫系统中重要的效应细胞,是炎症发生时第一批从血液循环到达炎症部位的免疫细胞,在连接先天免疫与获得性免疫中具有非常重要的作用。经典的中性粒细胞杀伤机制主要为呼吸爆发(释放氧自由基)和脱颗粒(释放各种蛋白酶),而新近研究[1]表明:NETs是其另外一种杀菌并阻止病原微生物在机体内扩散的方式。中性粒细胞被细菌激活后,在细胞外以自身DNA为骨架形成网状结构,展开形成可以捕获细菌的NETs[6-9]。反复下呼吸道感染是呼吸内科患者常见的住院原因之一,中性粒细胞是气道中重要的细胞类型,其经典杀伤功能在该类患者感染的发生发展过程中具有十分重要的作用[10-11],但NETs在其中的具体作用目前尚不明确。
NETs能够在炎症部位大量产生,捕杀引起下呼吸道感染的多种常见病原体,包括革兰阳性菌(如金黄色葡萄球菌、肺炎链球菌)、革兰阴性菌和真菌(如白色念珠菌)等[12-14]。本文作者发现:反复下呼吸道感染患者外周血NETs形成细胞的数量较健康对照组明显增多,提示该类患者可以利用中性粒细胞形成的NETs捕杀病原体,参与细菌感染的固有免疫应答反应。另外,NETs的独特形态结构使其具有更高效的杀菌率[6-7],网状纤维结构除可以诱捕微生物外,还可以协同增加抗生素的作用浓度和作用准确性;中性粒细胞颗粒及染色质组蛋白内高浓度的抗生素增强了其对微生物的杀伤力。但NETs增多在抗感染作用增强的同时,还可能导致机体的免疫损伤,这可能是患者反复发生下呼吸道感染的原因之一[15],具体发病机制有待于进一步研究。
头孢哌酮钠舒巴坦钠是治疗下呼吸道感染的广谱、高效抗生素,其使用的适应证、剂量和时机均至关重要。本研究通过头孢哌酮钠舒巴坦钠与中性粒细胞共同孵育研究药物对NETs的影响发现:头孢哌酮钠舒巴坦钠可以明显抑制NETs的形成。本文作者推测:对反复下呼吸道感染患者反复应用抗生素杀菌的同时,也抑制了中性粒细胞NETs的形成,导致中性粒细胞杀菌能力明显下降,从而抑制了中性粒细胞的免疫作用,但其具体机制尚需进一步研究。因此,适宜的剂量、浓度和应用时间是决定抗生素发挥最大治疗效益的主要因素,提示临床中不宜大量、过度使用抗生素。头孢哌酮钠舒巴坦钠如何作用于中性粒细胞,引起NETs功能下调,目前尚不清楚,如何调控抗生素和NETs功能之间的平衡是未来研究的重点,这将为抗生素治疗方案提供新的评判指标。
| [1] | Brinkmann V, Reichard U, Goosmann C, et al. Neutrophil extracellular traps kill bacteria[J]. Science, 2004, 303(5663): 1532–1535. DOI:10.1126/science.1092385 |
| [2] | Grabcanovic-Musija F, Obermayer A, Stoiber W, et al. Neutrophil extracellular trap (NET) formation characterises stable and exacerbated COPD and correlates with airflow limitation[J]. Respir Res, 2015, 16(1): 59. DOI:10.1186/s12931-015-0221-7 |
| [3] | 杨俊. 研究舒普深在治疗中重度下呼吸道感染中的有效性[J]. 世界最新医学信息文摘, 2015, 15(60): 95. DOI:10.3969/j.issn.1671-3141.2015.60.085 |
| [4] | Brinkmann V, Laube B, Abu UA, et al. Neutrophil extracellular traps:how to generate and visualize them[J]. J Vis Exp, 2010, 36(36): 77–82. |
| [5] | Obermayer A, Stoiber W, Krautgartner WD, et al. New aspects on the structure of neutrophil extracellular traps from chronic obstructive pulmonary disease and in vitrogeneration[J]. PLoS One, 2014, 9(5): e97784. DOI:10.1371/journal.pone.0097784 |
| [6] | Hamaguchi S, Hirose T, Matsumoto N, et al. Neutrophil extracellular traps in bronchial aspirates:a quantitative analysis[J]. Eur Respir J, 2014, 43(6): 1709–1718. DOI:10.1183/09031936.00139813 |
| [7] | Hamaguchi S, Hirose T, Akeda Y, et al. Identification of neutrophil extracellular traps in the blood of patients with systemic inflammatory response syndrome[J]. J Int Med Res, 2013, 41(1): 162–168. DOI:10.1177/0300060513475958 |
| [8] | Parker H, Dragunow M, Hampton MB, et al. Requirements for NADPH oxidase and myeloperoxidase in neutrophil extracellular trap formation differ depending on the stimulus[J]. J Leukoc Biol, 2012, 92(4): 841–849. DOI:10.1189/jlb.1211601 |
| [9] | Funchal GA, Jaeger N, Czepielewski RS, et al. Respiratory syncytial virus fusion protein promotes TLR-4-dependent neutrophil extracellular trap formation by human neutrophils[J]. PLoS One, 2015, 10(4): e0124082. DOI:10.1371/journal.pone.0124082 |
| [10] | 原铭贞, 高广媛, 李波, 等. 过氧化物酶6与肺部炎症性疾病关系的研究进展[J]. 吉林大学学报:医学版, 2014, 40(1): 210–214. |
| [11] | Chalmers JD, Hill AT. Mechanisms of immune dysfunction and bacterial persistence in non-cystic fibrosis bronchiectasis[J]. Mol Immunol, 2013, 55(1): 27–34. DOI:10.1016/j.molimm.2012.09.011 |
| [12] | 金梅. 中性粒细胞外陷阱(NETs)杀灭金黄色葡萄球菌及糖皮质激素对其影响的体外研究[D]. 杭州: 浙江大学, 2014. |
| [13] | Gonzalez DJ, Corriden R, Akong-Moore K, et al. N-terminal ArgD peptides from the classical Staphylococcus aureus Agr system have cytotoxic and proinflammatory activities[J]. Chem Biol, 2014, 21(11): 1457–1462. DOI:10.1016/j.chembiol.2014.09.015 |
| [14] | Jenne CN, Wong CH, Zemp FJ, et al. Neutrophils recruited to sites of infection protect from virus challenge by releasing neutrophil extracellular traps[J]. Cell Host Microbe, 2013, 13(2): 169–180. DOI:10.1016/j.chom.2013.01.005 |
| [15] | Wright TK, Gibson PG, Simpson JL, et al. Neutrophil extracellular traps are associated with inflammation in chronic airway disease[J]. Respirology, 2016, 21(3): 467–475. DOI:10.1111/resp.12730 |
 2017, Vol. 43
2017, Vol. 43


