扩展功能
文章信息
- 陈楠楠, 马宁, 车鸿泽, 焦鹏, 陈飞, 张莉
- CHEN Nannan, MA Ning, CHE Hongze, JIAO Peng, CHEN Fei, ZHANG Li
- 复方总黄酮聚乳酸-羟基乙酸共聚物微囊的制备及体外释药特性
- Preparation of compound TF-PLGA microcapsule and its drug release characteristics in vitro
- 吉林大学学报(医学版), 2017, 43(03): 593-599
- Journal of Jilin University (Medicine Edition), 2017, 43(03): 593-599
- 10.13481/j.1671-587x.20170325
-
文章历史
- 收稿日期: 2017-01-05
2. 吉林大学口腔医院急诊科, 吉林 长春 130021
2. Departmentof Emergency, Stomatology Hospital, Jilin University, Changchun 130021, China
颌骨缺损与多种口腔颌面部疾病伴发,严重影响患者的生活质量。基于口腔颌面部解剖位置的特殊性,要求骨修复材料在具有成骨作用的同时具有一定的抗炎抑菌作用。目前,美国FDA已批准骨形态发生蛋白(bone morphogenetic proteins, BMPs)结合于不同的生物活性材料,用于促进骨折愈合和脊柱融合。段宏等[1]已制备缓释碱性成纤维细胞生长因子(bFGF)微球并初步研究其成骨效果。然而上述制剂均存在价格昂贵、理化性质不稳定性、具有潜在的致异位骨化和成肿瘤作用等不足。传统中药在成骨方面有其独特疗效和优势。骨碎补总黄酮(total flavonoids of Rhizome Drynaria, TFRD)为“强骨”中药骨碎补的主要有效成分,可以通过促进成骨细胞的分化和增殖,诱导破骨细胞凋亡,抑制骨吸收从而促进骨折愈合[2]。野菊花总黄酮(total flavonoids of Chrysanthemum, TFC)为野菊的主要药理活性成分,具有抗菌消炎和清除氧自由基等多种生物学活性,被誉为中药中的“广谱抗生素”[3]。TFRD和TFC均为黄酮类化合物,具有雌激素样活性作用,可选择性与成骨细胞及破骨细胞等部位的雌激素受体结合[4]。目前,国内外对2种中药活性成分联合应用的相关研究较少。本研究将TFRD和TFC包载于缓释微囊中,既实现了口腔局部高浓度持续给药,又降低了成骨治疗的不良反应。缓释微囊选择聚乳酸-羟基乙酸共聚物(polylactic-co-glycolic acid, PLGA)作为载体材料,PLGA具有良好的生物相容性、生物降解性、载药性及骨传导性[5]。本研究制备复合TF-PLGA缓释微囊,以包封产率(encapsulation efficiency, EE)为评价指标,优化其制备工艺,以期获得更安全、成骨效果更好的缓释药物。
1 材料与方法 1.1 主要试剂和仪器PLGA(济南岱罡生物工程有限公司,PLA/PGA=75:25,相对分子质量为20000,批号A144-73),芦丁标准品(上海麦克林生物有限公司,CAS:153-18-4),强骨胶囊(北京岐黄制药有限公司,批号:141209),TFC(南京生力德生物技术有限公司,批号20150106),氯化钠(上海麦克琳公司)为化学纯,无水乙醇、二氯甲烷(DCM)和乙酸乙酯(EAC) (天津光复科技发展有限公司)均为分析纯,聚乙烯醇PVA(上海麦克琳公司),磷酸盐缓冲剂粉剂(北京鼎国生物技术有限责任公司,pH=7.4)。Precisa XB 220A电子天平(深圳市朗普电子科技有限公司),IKA C-MAG HS 7加热磁力搅拌器(德国艾卡公司),EYELA FDU-2200冷冻干燥机(日本东京理化EYELA有限公司),EVO18电子扫描显微镜(SEM,德国蔡司公司),OLYMPS IX71光学显微镜(LM,日本东京OLYMPS有限公司),Eppendorf 5810R冷冻高速大容量离心机(德国艾本德中国有限公司),尤尼柯UV-4802H型紫外分光光度计(深圳市凯明杰仪器有限公司),Synergy HT美国Biotek多功能酶标仪(美国BioTek公司),Incushaker IS-RSDA恒温震荡器(美国Crystal有限公司)。
1.2 TF-PLGA缓释微囊制备工艺的筛选 1.2.1 TF-PLGA缓释微囊的制备按照初步改良的复乳-溶剂挥发法(W1/O/W2)制备TF-PLGA缓释微囊。精密称取100 mg PLGA溶于1mLDCM与EAC (1:2) 的混合溶液中形成油相(O);量取0.2 mLTFRD和TFC(1:1) 组成的内水相溶液(W1),缓慢滴加到油相(O)中,磁力搅拌机上冰浴2000 r·min-1搅拌6min形成初乳;将乳液缓慢滴加到4 mL3 %PVA和2% NaCl组成的外水相溶液(W2)之中,3000 r·min-1冰浴下搅拌3 min形成复乳(W1/O/W2);最后将复乳倒入40 mL 3% PVA和2% NaCl组成的稀释相溶液之中,常温300 r·min-1搅拌过夜,使DCM及EAC完全挥发,达到固化微囊的目的;3000 r·min-1低温离心10 min,重复3次收集微囊。采用LM和SEM对微囊的形态特征、离散程度和粒径大小等进行观察。
1.2.2 单因素实验以EE为主要衡量指标,考察油相组成、PLGA浓度、油相体积、乳化时间和乳化速度5个因素对微囊制备的影响。
1.2.3 正交实验优化配方根据单因素试验的结果,为定量分析各主要影响因素对总的试验结果的影响程度,采用4因素3水平的正交设计法考察PLGA浓度、油相体积、乳化时间和乳化速度4个因素对制备微囊的影响(表 1),确定最优工艺处方并进行重复性实验。
| Level | PLGA(A) [ρB/(g·L-1)] |
Vo(B) (V/mL) |
EV(C) (r·min-1) |
ET(D) (t/min) |
| 1 | 100 | 1.0 | 1 000 | 5 |
| 2 | 120 | 1.2 | 1 500 | 6 |
| 3 | 140 | 1.4 | 2 000 | 7 |
按照中国药典2010年版操作方法对TF供试品溶液和芦丁对照品溶液进行紫外可见光谱扫描,波长范围为200~600 nm,发现TF和芦丁在360 nm处最大吸收峰重合度较好,因此明确TF最大吸收波长为360 nm。
1.3.2 绘制标准曲线配置浓度分别为1、2、4、8、16、32、40和48 mg·L-1芦丁对照品溶液。采用紫外分光光度法进行定量分析,在360 nm波长处分别测定吸光度(A)值,以A值为纵坐标,浓度(mg·L-1)为横坐标,绘制标准曲线,线性回归得到标准曲线方程A=0.18934+0.02022C(R2=0.9989),线性范围=0~40 mg·L-1。
1.3.3 TF-PLGA微囊DL和EE的测定精密称取5 mg TF-PLGA缓释微囊溶于0.5 mL DCM溶液中,加入10 mL去离子水进行萃取,超声下使微囊中药物充分释放,滤过离心,测定上清液的A值,计算药物的质量。计算微囊的DL和EE。DL=微囊中药物总量/微囊质量=cV/m1×100%, EE=微囊中药物总量/制备微囊时的投药时=cVm3/m1m2×100%, c为样品溶液的质量浓度(g·L-1), V为样品溶液体积(mL), m1、m2和m3分别为称取的微囊质量、投药量和所得微囊总量(mg)。
1.4 体外释放实验计算释药率和累计释放曲线的绘制以恒温振荡法(提取法)进行体外释药试验。精密称取10 mg TF-PLGA-MC装于离心管中,加入10 mL释放介质(pH 7.4磷酸盐缓冲溶液、水和生理盐水)溶解。整个缓释过程持续恒温振荡(100 r·min-1,37℃),分别在0、0.5、1、2、3、5、10、15、...、50 d等不同时间段取出离心管,离心,取出2 mL上清液立即补充等体积的释放介质,测定其A值,计算累计释药率,绘制累计释放曲线。
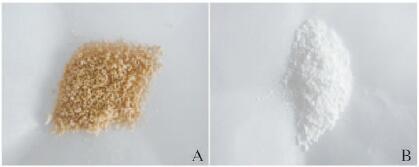
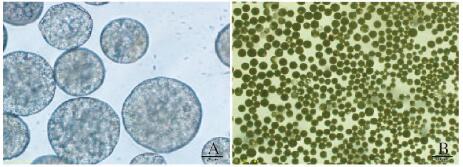
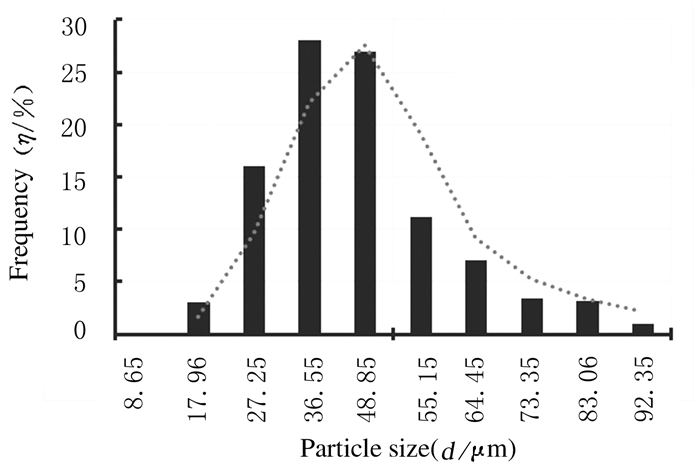
2 结果 2.1 TF-PLGA微囊的表征冻干后TF-PLGA缓释微囊外观呈棕黄色疏松粉末(图 1A, 见插页四),与空白微囊(图 1B,见插页四)呈鲜明对比。LM和SEM观察:微囊形态圆整,成球性良好(图 2,见插页四),表面光滑无裂隙,分散性好(图 3)。采用Nano Measurer软件随机对500个微囊的粒径进行分析,粒径范围为13.3~96.17 μm,平均粒径为(44.34±14.68)μm,粒径分布呈现单峰形态,符合正态分布。见图 4。
|
| 图 1 TF-PLGA微囊的肉眼观照片 Figure 1 Gross appearance of TF-PLGA microcaspules |
|
|
|
| A: Bar =20 μm; B: Bar=200 μm. 图 2 光镜下TF-PLGA微囊的形态表现 Figure 2 Morphology of TF-PLGA microcaspules under LM |
|
|

|
| A: Bar=10 μm; B: Bar=200 μm. 图 3 SEM观察TF-PLGA微囊的形态表现 Figure 3 Morphology of TF-PLGA microcapsules observed under SEM |
|
|
|
| 图 4 TF-PLGA微囊的粒径分布图 Figure 4 Diagram of distribution of particle sizes of TF-PLGA microcapsules |
|
|
各因素对TF-PLGA微囊EE、DL及粒径均有一定影响。以EE为主要评价指标,其中PLGA浓度(A)、油相体积(B)、乳化速度(C)、初乳乳化时间(D)4个因素对EE的影响较明显。当DCM与EAC比例为2:1时EE最大,成球良好;随着PLGA浓度增加,EE明显变大;随着水油比值的减小,EE有所升高,油相体积从0.6 mL增加到1.4 mL时,EE明显升高;随着乳化速度的增大,EE有所升高,当速度大于2 500 r· min-1时EE反而降低;随着乳化时间的延长,EE有所升高,当乳化时间超过8 min时,EE反而有所下降。见表 2~6。
| No. | Formulation of oil phase(mL:mL) | DL (η/%) |
EE (η/%) |
Y (η/%) |
Mean diameter(d/μm) |
| 1 | DCM:EAC=1:0 | 7.03 | 38.24 | 49.45 | 52.06 |
| 2 | DCM:EAC=0.66:0.34 | 9.80 | 84.99 | 79.63 | 54.25 |
| 3 | DCM:EAC=0.5:0.5 | 5.94 | 54.11 | 82.81 | 82.12 |
| 4 | DCM:EAC=0.34:0.66 | 7.63 | 39.82 | 47.45 | 52.44 |
| 5 | DCM:EAC=0:1 | 5.48 | 41.59 | 69.00 | 52.11 |
| No. | PLGA concentration [ρB/(g·L-1)] |
DL (η/%) |
EE (η/%) |
Y (η/%) |
Mean diameter (d/μm) |
| 1 | 60 | 4.64 | 10.17 | 41.85 | 52.06 |
| 2 | 80 | 4.87 | 30.67 | 51.11 | 54.25 |
| 3 | 100 | 7.63 | 39.82 | 82.81 | 82.12 |
| 4 | 120 | 4.82 | 48.85 | 81.76 | 52.44 |
| 5 | 140 | 8.14 | 75.18 | 90.80 | 52.11 |
| No. | W1/O (mL:mL) |
DL (η/%) |
EE (η/%) |
Y (η/%) |
Mean diameter (d/μm) |
| 1 | 1:03 | 4.64 | 10.17 | 19.90 | 77.82 |
| 2 | 1:04 | 4.87 | 30.97 | 57.81 | 31.91 |
| 3 | 1:05 | 7.63 | 39.82 | 82.81 | 82.12 |
| 4 | 1:06 | 4.89 | 49.61 | 92.09 | 41.35 |
| 5 | 1:07 | 8.14 | 75.18 | 83.90 | 48.81 |
| No. | EV (r·min-1) |
DL (η/%) |
EE (η/%) |
Y (η/%) |
Mean diameter (d/μm) |
| 1 | 1 000 | 6.34 | 44.38 | 63.63 | 91.48 |
| 2 | 1 500 | 13.36 | 93.55 | 63.18 | 63.17 |
| 3 | 2 000 | 7.63 | 39.82 | 82.81 | 82.12 |
| 4 | 2 500 | 13.32 | 98.56 | 67.27 | 71.58 |
| 5 | 3 000 | 4.69 | 36.96 | 71.63 | 52.83 |
| No. | ET (t/min) |
DL (η/%) |
EE (η/%) |
Y (η/%) |
Mean diameter (d/μm) |
| 1 | 4 | 3.85 | 18.46 | 43.54 | 41.05 |
| 2 | 5 | 4.16 | 20.38 | 44.54 | 45.37 |
| 3 | 6 | 7.63 | 39.82 | 82.81 | 82.12 |
| 4 | 7 | 6.98 | 53.90 | 42.63 | 75.35 |
| 5 | 8 | 5.31 | 41.03 | 70.18 | 38.87 |
经正交试验进行极差分析发现:4个因素对微囊EE的影响程度依次为PLGA浓度>乳化速度>油相体积>初乳乳化时间,见表 7(表中K1、K2、K3分别表示各因素3个水平的均数;R代表极差,极差=平均得率最大值-平均得率最小值)。
| No. | PLGA [ρB/(g·L-1)] |
Vo (V/mL) |
EV (r·min-1) |
ET (t/min) |
DL (η/%) |
EE (η/%) |
Y (η/%) |
CE (η/%) |
| 1 | 100 | 1 | 1 000 | 5 | 5.62 | 49.79 | 79.89 | 38.142 |
| 2 | 100 | 1.2 | 1 500 | 6 | 4.89 | 49.61 | 92.09 | 40.21 |
| 3 | 100 | 1.4 | 2 000 | 7 | 6.40 | 57.47 | 82.08 | 41.96 |
| 4 | 120 | 1.0 | 1 500 | 7 | 5.78 | 63.92 | 82.59 | 44.39 |
| 5 | 120 | 1.2 | 2 000 | 5 | 6.44 | 64.14 | 77.08 | 43.64 |
| 6 | 120 | 1.4 | 1 000 | 6 | 5.33 | 59.53 | 84.68 | 42.88 |
| 7 | 140 | 1.0 | 2 000 | 6 | 5.38 | 65.15 | 80.84 | 44.38 |
| 8 | 140 | 1.2 | 1 000 | 7 | 4.03 | 53.92 | 88.66 | 40.91 |
| 9 | 140 | 1.4 | 1 500 | 5 | 5.57 | 76.53 | 92.21 | 51.28 |
| EE(η/%) | ||||||||
| K1 | 52.29 | 59.62 | 54.41 | 63.48 | ||||
| K2 | 62.53 | 55.89 | 63.35 | 58.09 | A > C > B > D | A3B3C2D1 | ||
| K3 | 65.20 | 64.51 | 62.25 | 58.43 | ||||
| R | 12.91 | 8.62 | 8.94 | 5.39 | ||||
| Vo:Volume of organic phase; EV:Emulsifying velocity; ET:Emulsification time; Y:Yield; CE:Comprehensive evaluation. | ||||||||
综合评分后第9次的评分最高。所以根据实际需求综合平衡后确定最优工艺为A3B3C2D1,即PLGA浓度=140 g·L-1,油相体积=1.4 mL,乳化速度=1500 r·min-1,乳化时间=5 min。按优化配方重复制备3批TF-PLGA-MC,测定其平均ER为(95.28±0.29)%,平均EE为(83.89±2.30)%,平均DL为(5.90±0.07)%,平均收率为(94.76±2.28)%,说明EE、DL和收率均较高,且优化配方重复性较好。见表 8。
| (n=3, η/%) | ||||
| No. | ER | EE | DL | Y |
| 1 | 95.54 | 86.26 | 5.90 | 96.62 |
| 2 | 94.96 | 81.65 | 5.83 | 92.21 |
| 3 | 95.34 | 83.78 | 5.98 | 95.45 |
| RSD | 0.30 | 2.74 | 1.18 | 2.40 |
| Mean | 95.28±0.29 | 83.89±2.30 | 5.90±0.07 | 94.76±2.28 |
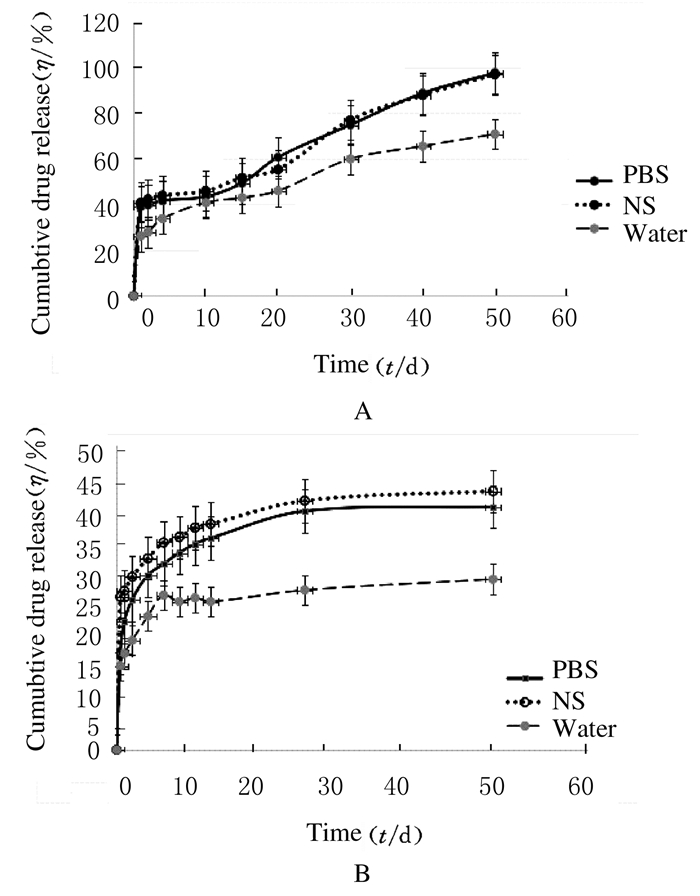
TF-PLGA缓释微囊在3种释放介质中均可缓慢释放,但在水中微囊释放不完全(图 5A)。这可能是因为实验过程中微囊在水中出现板结,不能均匀地分散,所以释药速度明显降低,并且出现不规则释药情况,故水不适合作为释放介质。TF-PLGA微囊缓释时间为50 d,其体外释放行为由突释相和缓释相2个相组成。TF-PLGA微囊在前24 h有较明显的突释效应,累计突释量达到40%左右(图 5B)。24 h后,TF-PLGA微囊的体外释药行为表现为缓释相,TF体外放明显放缓,曲线变得平稳。在前12 d左右,累计缓释率均超过了50%;30 d后药物的缓释基本趋于稳定。在50 d时,TF的累积释药率超过90%,之后TF从TF-PLGA微囊中的释放更加平缓,药物基本释放完毕。
|
| 图 5 不同时间点TF-PLGA微囊在不同释放介质中的长期释放情况(A)和实释情况(B) Figure 5 Long-term(A) and abruptly delivery(B) of TF-PLGA microcapsules in different release mediators at different time points |
|
|
目前颌骨缺损的治疗药物仍为双膦酸盐类和降钙素等,口腔局部缓释制剂相对匮乏。近年来对于促进成骨的缓释制剂相关研究主要集中在蛋白质类生长因子制剂上,但因其提取困难及价格较高等缺点较难推广应用。中药治疗骨伤疾病历史悠久,疗效确切,其多成分、多系统、多靶点、低不良反应和廉价等优势日益凸显,具有较大的应用前景[6]。因此利用中药有效成分开发研制治疗颌骨缺损的新药具有优势。TFRD和TFC作为中药骨碎补和野菊花的有效成分,提取工艺完善、价格低廉、容易获得。研究[7-8]显示:TFRD可以使骨保护蛋白(OPG)表达上调,RANKL表达下调,调节OPG/RANKL/RANK轴的平衡和参与骨内谷氨酸信号通路,从而促进成骨细胞分化增殖抑制破骨细胞的分化成熟,介导骨重建。研究[9]显示:TFC是通过影响花生四烯酸的代谢,平衡细胞因子的产生, 清除氧自由基、减少PGE2和TLB4等炎症介质的释放来调节机体抗炎免疫功能。故本实验利用PLGA搭载TFRD和TFC制备缓释制剂,以期在口腔颌面部颌骨缺损治疗中起到积极效果。
由于TFRD和TFC均属于黄酮类化合物,在水中溶解度良好,因此在制备微囊时选择对其活性有很好的保护作用的复乳-溶液挥发法进行制备[10]。微囊的质量评价指标主要为EE。因DL和收率随着投入药物和PLGA的量不同而产生较大的差异,可比性不强,所以作为辅助考察指标。EE值愈高愈好[11]。本研究通过单因素实验和正交试验优化工艺提高EE的同时,在制备微囊的过程中采用冰浴、外水相中加入加入了一定量NaCl等措施来辅助提高药物的EE。
微囊的降解受众多因素的影响。本研究选用的聚合物PLGA丙交酯与乙交酯的比例为75:25,乙交酯的摩尔比例较低(乙交酯比例越高降解速度越快),符合药物缓释释放的要求。制备的微囊平均粒径为(44.34±14.68) μm,粒径大小符合局部用药的特点,不会被单核巨噬细胞吞噬[12]。微囊中药物的缓释主要通过微囊表面药物的扩散和聚合物的侵蚀降解2个途径进行[13]。体外释放结果显示:24 h微囊有较明显的突释效应,这可能是由于微囊表面有少量点状的药物残留和有机溶剂挥发留下的空洞,使得释放较迅速;24 h后微囊释放速率相对较低,曲线较平缓,表现为缓释相。该阶段微囊表面药物溶出形成的孔道使缓释介质向微囊内部渗透,受到聚合物材料的阻碍作用,使得药物向外溶出缓慢[14-16]。30 d后微囊释放更加缓慢,因为与之相对应的是PLGA基体的缓慢降解。
综上所述,本实验采用复乳溶液挥发法所制备的TF-PLGA缓释微囊方法简单,EE高,微囊形态完整,体外释放速适中,且工艺优化后重复性良好。利用PLGA搭载TF制备缓释制剂,在注重中药之间内在联系的同时,达到载药和缓释的双重效果,既提高中药制剂的生物利用率,又避免了全身给药的不良反应,还突破了传统中药单一的给药方式。但是本研究仍存在一些问题, 如2种总黄酮的最佳配比比例、细胞及动物实验探讨缓释微囊的疗效及毒副作用等,仍需进一步深入研究。
| [1] | 段宏, 樊瑜波, 屠重棋, 等. 缓释bFGF微球的制备及微球对成骨细胞的作用[J]. 华西药学杂志, 2007, 22(3): 259–262. |
| [2] | Jia M, Nie Y, Cao DP, et al. Potential antiosteoporotic agents from plants:A comprehensive review[J]. Evid Based Complement Alternat Med, 2012, 2012: 364604. |
| [3] | 陈春雨, 刘鹤, 何畔, 等. 野菊花提取物对牙龈卟啉单胞菌胰酶样蛋白酶活性的抑制作用[J]. 吉林大学学报:医学版, 2015, 41(5): 941–945. |
| [4] | Kumar S, Pandey AK. Chemistry and biological activitiesof flavonoids:An overview[J]. SciWorldJ, 2013, 2013: 162750. |
| [5] | Wang H, Liu J, Tao S, et al. Tetracycline-grafted PLGA nanoparticles as bone-targeting drug delivery system[J]. Int J Nanomed, 2015, 10(1): 5671–5685. |
| [6] | Hines DJ, Kaplan DL. Poly (lactic-co-glycolic) acid controlled release systems:experimental and modeling insights[J]. Crit Rev Ther Drug Carrier Syst, 2013, 30(3): 257–276. DOI:10.1615/CritRevTherDrugCarrierSyst.v30.i3 |
| [7] | 方霁, 杨丽, 沈家珍, 等. 骨碎补总黄酮对去卵巢骨质疏松大鼠骨内谷氨酸信号Glu、mGluR5以及EAAT1的影响[J]. 中国生化药物杂志, 2014, 34(2): 10–12. |
| [8] | 尹文哲, 徐展望, 王利, 等. 骨碎补总黄酮对模拟失重下共育骨细胞中ALP活性及BMP-2和OPG基因表达影响[J]. 中药材, 2012, 35(3): 452–455. |
| [9] | 张骏艳, 张磊, 金涌, 等. 野菊花总黄酮抗炎作用及部分机制[J]. 安徽医科大学学报, 2005, 40(5): 405–408. |
| [10] | Cózar-Bernal MJ, Holgado MA, Arias JL, et al. Insulin-loaded PLGA microparticles:flow focusing versus double emulsion/solvent evaporation[J]. Microencapsul, 2011, 28(5): 430–441. DOI:10.3109/02652048.2011.576786 |
| [11] | Giri TK, Choudhary C, Ajazuddin, et al. Prospects of pharmaceuticals and biopharmaceualticals loaded microparticles prepared by double emulsion technique for controlleddelivery[J]. Saudi Pharm J, 2013, 21(2): 125–141. DOI:10.1016/j.jsps.2012.05.009 |
| [12] | Hong X, Wei L, Ma L, et al. Novel preparation methodfor sustained-release PLGA microcapsules usingwater-in-oil-in-hydrophilic-oil-in-water emulsion[J]. Int J Nanomed, 2013, 8(1): 2433–2441. |
| [13] | Han FY, Thurecht KJ, Whittaker AK, et al. Bioerodable PLGA-based microparticles for producing sustained-release drug formulations and strategies for improving drug loading[J]. FrontPharmacol, 2016, 7: 185. |
| [14] | Meinel L, Ili OE, Zapf J, et al. Stabilizing insulin-like growth factor-I in poly(D, L-lactide-co-glycolide) microcapsules[J]. J Control Release, 2001, 70(1): 193–202. |
| [15] | Wu T, Nan KH, Chen JD, et al. A new bone repair scaffold combined with chitosan/hydroxyapatite and sustained releasing icariin[J]. Chin SciBull, 2009, 54(17): 2953–2961. |
| [16] | 张晔, 张连阳, 孙士锦, 等. 脂多糖作用下血管内皮钙黏蛋白经网格蛋白和微囊介导胞吞后的亚细胞分布差异[J]. 解放军医学杂志, 2016, 41(1): 22–25. DOI:10.11855/j.issn.0577-7402.2016.01.05 |
 2017, Vol. 43
2017, Vol. 43


