扩展功能
文章信息
- 李昆, 李佳芮, 张佳悦, 董丹阳, 张强, 杨擎, 刘英娜, 李娜
- LI Kun, LI Jiarui, ZHANG Jiayue, DONG Danyang, ZHANG Qiang, YANG Qing, LIU Yingna, LI Na
- 五味子乙素对阿尔兹海默病小鼠的抗氧化损伤作用及其机制
- Anti-oxidative damage effect in Schisandrin B in mice of Alzheimer's disease and its mechanism
- 吉林大学学报(医学版), 2017, 43(03): 582-587
- Journal of Jilin University (Medicine Edition), 2017, 43(03): 582-587
- 10.13481/j.1671-587x.20170323
-
文章历史
- 收稿日期: 2016-11-29
2. 吉林大学口腔医院学生办公室, 吉林 长春 130021;
3. 延边大学医学院学生办公室, 吉林 延吉 133002;
4. 长春中医药大学研发中心, 吉林 长春 130117
2. Department of Students, Stomatology Hospital, Jilin University, Changchun 130021, China;
3. Department of Students, School of Medical Sciences, Yanbian University, Yanji 133002, China;
4. Center of Research and Development, Changchun University of Chinese Medicine, Changchun 130117, China
阿尔兹海默病(Alzheimer’s disease, AD)俗称老年痴呆症,是最常见的中枢性神经系统退行性疾病,病理变化为神经元纤维缠结、淀粉样蛋白沉积、老年斑形成、神经元颗粒空泡样变性和神经元丢失[1-2],患者临床表现为记忆力衰退及认知障碍等[3],AD可对老年人身体健康和生活质量造成严重影响[4],目前临床药物治疗效果不佳,国内目前主要采用针对胆碱酯酶抑制剂减少乙酰胆碱降解、增强胆碱能神经元的途径治疗AD,但尚无有效彻底根治方法[5-6]。因此,开发安全有效的防治AD的药物成为研究热点。五味子乙素是中药五味子中的木脂素类成分[7],现代药理研究[8-9]表明:AD与自由基大量产生和脂质过氧化有关,而五味子乙素具有抗氧化及抗细胞凋亡的作用。目前国内外尚未见相关研究报道。本课题组前期研究[10]显示:五味子乙素对损伤的神经元具有保护作用,本研究通过动物实验进一步观察五味子乙素对AD模型小鼠的预防保护作用,探讨其抗氧化损伤的分子机制,为研究五味子预防AD的作用提供实验依据。
1 材料与方法 1.1 实验动物和主要试剂50只Balb/c雄性小鼠购自吉林大学基础医学院实验动物中心,动物合格证号:201600015240。兔抗Nrf2和Keap1单克隆抗体购自美国Proteintech公司,乳酸脱氢酶(lactate dehydrogenase, LDH)、丙二醛(malonyldialdehyde, MDA)、超氧化物歧化酶(superoxide dismutase, SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-Px)和过氧化氢酶(catalase, CAT)检测试剂盒购自于南京建成生物工程有限公司,活性氧(reactive oxygen species, ROS)检测试剂盒购于杭州碧云天生物技术研究所。
1.2 实验动物和分组将50只小鼠随机分成空白组、模型组、阳性药对照组、低剂量五味子乙素组和高剂量五味子乙素组,每组10只。除空白组外,其余4组小鼠每天腹腔注射D-半乳糖(60 mg·kg-1)和氢溴酸东莨菪碱(0.5 mg·kg-1)复制AD动物模型,空白组小鼠每天腹腔注射和灌胃给予等容量的生理盐水,低和高剂量五味子乙素组小鼠每日灌胃给予0.1和0.5 g·kg-1五味子乙素,阳性药对照组小鼠每日灌胃给予阳性对照药盐酸美金刚(3 mg·kg-1)。低和高剂量五味子乙素组、阳性药对照组小鼠在造模前分别预先给药保护2周,给药同时给予D-半乳糖和氢溴酸东莨菪碱造模30 d,进行行为学检测。小鼠麻醉后眼球取血,分离血清检测LDH水平;每组取3只小鼠脑组织,一侧脑半球冷冻后提取脑组织匀浆,检测MDA含量及CAT、GSH-Px和SOD活性,另一侧脑组织于4%多聚甲醛固定用于形态表现检测;取3只小鼠的脑组织研磨单细胞用于流式细胞术检测;取3只小鼠的脑组织提取蛋白用于Western blotting检测。
1.3 避暗实验采用成都泰盟科技有限公司生产的避暗实验装置BA-200。将小鼠头部背向洞口放入明室,使其适应环境后给予5 min持续电流,小鼠进入暗室即受电击返回明室,以2 d为训练期。训练48 h后进行小鼠避暗实验,将实验开始至小鼠第一次进入暗室的时间记为避暗潜伏期,并记录5 min内小鼠进入暗室次数(错误次数)。实验期内未进入暗室的小鼠潜伏期计为300 s。
1.4 刚果红染色取多聚甲醛固定的小鼠脑组织,石蜡包埋后进行刚果红染色,观察小鼠脑组织形态表现和淀粉样变。
1.5 流式细胞术检测各组小鼠脑组织中ROS水平将小鼠脑组织研磨分离单细胞后过滤,离心收集各组细胞,并重悬浮于含10 μmol·L-1 DCFH-DA的无血清培养基中,参照检测试剂盒说明书,采用流式细胞术检测小鼠脑组织中ROS水平,以各组平均荧光强度值表示小鼠脑组织中ROS水平。
1.6 各组小鼠脑组织匀浆中MDA含量、LDH水平及CAT、GSH-Px和SOD活性的检测采用生化法检测小鼠脑组织匀浆中MDA含量,采用氧化酶法测定AD小鼠脑组织匀浆中LDH水平及CAT、GSH-Px和SOD活性。
1.7 Western blotting方法检测各组小鼠脑组织中Nrf2和Keap1蛋白表达水平提取小鼠脑组织蛋白,采用考马斯亮蓝法进行蛋白定量,SDS-PAGE垂直电泳后电转至PVDF膜上,转膜后用TBST洗膜3次,每次5 min,采用脱脂奶粉封闭1 h,再次用TBST洗膜。将膜放入稀释好的一抗中,4℃孵育过夜,二抗室温孵育1 h,TBST洗膜,在NBT/BCIP显色液中避光显色,采用凝胶成像分析系统测定吸光度(A)值,进行半定量分析。蛋白表达水平=(目的蛋白A值×平均A值)/(内参蛋白A值×平均A值)。
1.8 统计学分析采用SPSS17.0统计软件进行统计学分析。各组小鼠避暗实验潜伏期和错误次数,小鼠脑组织中ROS与LDH水平,MDA含量,CAT、GSH-Px和SOD活性及Nrf和Keap1蛋白表达水平以x±s表示;组间比较采用方差分析。以α=0.05为检验水准。
2 结果 2.1 各组小鼠避暗潜伏期和错误次数避暗实验结果显示:与空白组比较,模型组小鼠避暗潜伏期缩短,错误次数增加,说明AD模型制备成功;与模型组比较,低和高剂量五味子乙素组小鼠避暗潜伏期延长(P<0.01),错误次数减少(P<0.05或P<0.01)。见表 1。
| (n=10,x±s) | ||
| Group | Latency | Number of errors |
| Blank | 192.71±72.76 | 0.71±0.49 |
| Model | 106.43±30.89* | 2.17±0.98* |
| Positive control | 208.50±80.48△ | 0.86±0.69△ |
| Schisandrin B | ||
| Low dose | 161.28±15.02△△ | 0.86±0.69△△ |
| High dose | 192.86±39.31△△ | 1.00±0.82△ |
| * P < 0.05 vs blank group; △ P < 0.05, △△ P < 0.01 vs model group. | ||
刚果红染色结果显示:与空白组比较,模型组小鼠脑组织神经元中淀粉样变明显;而与模型组比较,各剂量五味子乙素组小鼠脑组织神经元中淀粉样变明显减轻,说明五味子乙素能够减轻AD小鼠的神经元损伤。见图 1(插页四)。
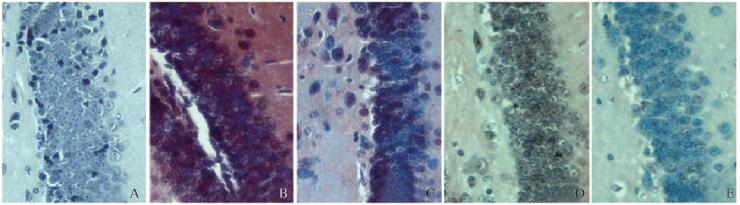
|
| A: Blank group; B: Model group; C: Positive control group; D: Low dose of Schisandrin B group; E: High Low dose of Schisandrin B group. 图 1 各组小鼠脑组织神经元中淀粉样变表现 Figure 1 Amyloidosis in nerve cells in brain tissue of mice in various groups (seen on page 584 in paragraph) |
|
|
与空白组(7.24±3.08) 比较,模型组小鼠脑组织中ROS水平(78.34±3.74) 明显升高(P<0.01);与模型组比较,阳性药对照组(58.95±6.31)、低剂量五味子乙素组(67.33±5.78) 和高剂量五味子乙素组(43.84±13.62) 小鼠脑组织中ROS水平明显降低(P<0.05)。见图 2。
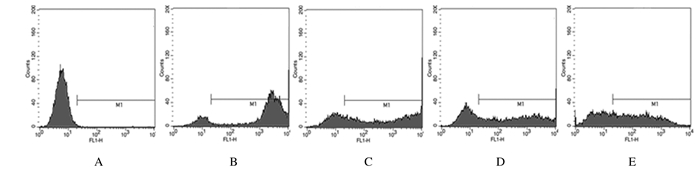
|
| A: Blank group; B: Model group; C:Positive control group; D: Low dose of Schisandrin B group; E:High dose of Schisandrin B group. 图 2 各组小鼠脑组织中ROS水平 Figure 2 Levels of ROS in brain tissue of mice in various groups |
|
|
与空白组比较,模型组小鼠脑组织中LDH水平和MDA含量升高,而SOD、CAT和GSH-Px活性明显降低(P<0.05或P<0.01)。与模型组比较,低和高剂量五味子乙素组小鼠脑组织中MDA含量和LDH水平均明显降低(P<0.01),SOD、CAT和GSH-Px活性明显升高(P<0.01)。低剂量五味子乙素组小鼠MDA含量和SOD、GSH-Px活性均低于高剂量五味子乙素组(P<0.01)。见表 2。
| (n=10,x±s) | |||||
| Group | MDA [mB/(μmol·g-1)] |
LDH [λB/(U·L-1)] |
CAT [λB/(U·mg-1)] |
SOD [λB/(U·mg-1)] |
GSH-Px [λB/(U·mg-1)] |
| Blank | 5.80±0.74 | 1 021.23±155.06 | 3.46±0.36 | 68.37±4.96 | 606.09±19.95 |
| Model | 12.17±0.74** | 3 577.56±110.92** | 2.71±0.30** | 55.36±16.40* | 428.97±9.47** |
| Positive control | 3.39±0.18△ | 2 462.36±309.26△ | 3.59±0.21△ | 87.36±1.34△ | 668.86±49.47△ |
| Schisandrin B | |||||
| Low dose | 9.39±0.45△ | 1 892.43±253.61△ | 3.37±0.40△ | 79.86±1.09△ | 582.68±37.21△ |
| High dose | 10.79±0.44△# | 2 061.47±272.89△ | 2.99±0.37 | 86.26±1.88△# | 698.38±23.32△# |
| * P < 0.05, ** P < 0.01 vs blank group;△ P < 0.01 vs model group;# P < 0.01 vs low dose of Schisandrin B group. | |||||
与空白组比较,低和高剂量五味子乙素组小鼠脑组织中Nrf2蛋白表达水平明显降低(P<0.01),Keap1蛋白表达水平升高(P<0.01)。与模型组比较,低剂量五味子乙素组小鼠脑组织中Nrf2蛋白表达水平明显升高(P<0.01),高剂量五味子乙素组小鼠脑组织中Nrf2蛋白表达水平降低(P<0.01);低和高剂量五味子乙素组小鼠脑组织中Keap1蛋白表达水平均降低(P<0.01)。见表 3和图 3。
| (n=10,x±s) | ||
| Group | Nrf2 | Keap1 |
| Blank | 0.98±0.09 | 0.89±0.07 |
| Model | 0.59±0.09* | 1.51±0.10* |
| Positive control | 0.41±0.10 | 0.94±0.08 |
| Schisandrin B | ||
| Low dose | 0.78±0.19△ | 0.96±0.07△ |
| High dose | 0.26±0.09△ | 1.28±0.10△ |
| * P < 0.05 vs blank group;△ P < 0.01 vs model group. | ||

|
| Lane 1:Blank group;Lane 2:Model group;Lane 3-4:Low and high doses of Schisandrin B groups. 图 3 各组小鼠脑组织中Nrf2和Keap1蛋白表达水平电泳图 Figure 3 Electrophoregram of expression levels of Nrf2 and Keap1 protein in brain tissue of mice in various groups |
|
|
AD是一种神经退行性疾病,与脑组织氧化损伤有关。五味子最早记载于《神农本草经》,为木兰科植物干燥成熟果实,有益气生津和补肾宁心等功效[11],五味子富含木质素类成分,而五味子乙素为其主要活性成分[12],有明显的抗炎和抗氧化作用[13]。本课题组前期实验[10]结果显示:五味子乙素对体外培养的神经元具有预防和保护作用,本研究进一步观察其对AD模型小鼠预防保护作用的结果显示:五味子乙素作用于AD小鼠后避暗实验潜伏期延长及错误次数明显减少,提示五味子乙素对AD小鼠记忆功能具有预防和改善作用。刚果红染色结果显示:应用五味子乙素的小鼠脑组织神经元中淀粉样变减少;LDH检测结果显示:五味子乙素组小鼠脑组织中LDH水平明显降低;均提示五味子乙素能够明显减轻AD小鼠的神经元损伤。但这种保护作用是否与五味子乙素对通过调节Nrf2信号通路抗氧化损伤有关,目前少有报道。
研究[14]表明:AD患者海马组织中脂质过氧化水平升高,而抗氧化酶活性降低,ROS的大量产生可造成脑组织脂质过氧化水平升高。MDA是膜脂过氧化的产物之一,因此通过检测脑组织中ROS水平和MDA含量可以反映脑组织脂质过氧化水平,即反映不同脑组织自由基损伤程度。本研究结果显示:经不同剂量五味子乙素作用后,小鼠脑组织中ROS水平和MDA含量均有所降低,提示五味子乙素可通过降低ROS水平,降低脑组织过氧化水平,预防AD的发生。
脑组织中有很多抗氧化酶,如SOD、CAT和GSH-Px,可以清除ROS以保护脑细胞免受自由基的氧化损伤,避免脑组织神经元损伤[15]。为了探讨五味子乙素是否通过提高抗氧化酶的活性来降低脑组织脂质过氧化水平,达到抗氧化损伤作用,本研究检测CAT、GSH-Px及SOD活性的结果显示:经不同剂量五味子乙素作用后,小鼠脑组织中CAT、GSH-Px及SOD活性均较模型组升高,提示五味子乙素可能是通过增加抗氧化酶的转录合成,提高体内抗氧化酶活性,从而降低自由基含量,减轻AD小鼠脑组织脂质过氧化水平及自由基氧化损伤,进而发挥其预防和治疗AD的作用。
Nrf2是参与机体抗氧化反应调节的核转录因子,在心血管、中枢神经和消化系统和肾脏、肺脏等疾病防治中具有关键作用[16]。正常情况下,Nrf2与胞浆中的抑制因子Keap1结合,处于无活性状态继而被降解,无法发挥其信号传递功能。在氧化应激状态或体内的氧化磷酸化作用下,胞浆中的Nrf2被激活,随后入核,并与其相关抗氧化反应元件结合,启动Nrf2信号通路,促进下游抗氧化基因的表达,其中包括SOD、CAT和GSH-Px的转录表达[17-20]。抗氧化酶SOD、CAT和GSH-Px活性升高,降低机体脂质过氧化水平,即降低ROS水平与MDA含量,达到抗氧化损伤目的。为了证实五味子乙素干预后小鼠脑组织中SOD、CAT和GSH-Px活性升高是否通过Nrf2信号通路完成,本实验检测了Nrf2信号通路蛋白。给予适量五味子乙素后AD小鼠脑组织中Nrf2蛋白表达水平有所升高,其结合抑制因子Keap1蛋白表达水平降低,可使Nrf2与Keap1抑制因子分离,促进其活化入核,启动下游抗氧化基因表达,最终使得脑细胞中抗氧化酶SOD、CAT和GSH-Px活性升高,达到抗氧化损伤的目的。
综上所述,五味子乙素可通过抑制Keap1抑制因子与Nrf2转录因子的结合,解放并活化Nrf2转录因子使其入核,激活Nrf2信号通路,促进下游抗氧化基因转录表达,使得SOD、CAT和GSH-Px活性升高。抗氧化酶SOD、CAT和GSH-Px可清除脑组织中过量的ROS,使MDA含量和LDH水平降低,降低脑组织的脂质过氧化水平及氧化损伤,从而发挥其对AD小鼠神经元的预防保护作用,改善其认知功能障碍。本研究为临床开发五味子以防治AD提供了实验依据。
| [1] | Heneka MT, Carson MJ, Khoury JE, et al. Neuroinflammation in Alzheimer's disease[J]. Lancet Neurol, 2015, 14(4): 388–405. DOI:10.1016/S1474-4422(15)70016-5 |
| [2] | Heppner FL, Ransohoff RM, Becher B. Immune attack:the role of inflammation in Alzheimer disease[J]. Nat Rev Neurosci, 2015, 16(6): 358–372. DOI:10.1038/nrn3880 |
| [3] | 孙文静, 贺斌, 尹又. 阿尔兹海默病睡眠障碍的机制与治疗进展[J]. 中国临床医学, 2016, 23(4): 514–518. DOI:10.12025/j.issn.1008-6358.2016.20160098 |
| [4] | Zahodne LB, Ornstein K, Cosentino S, et al. Longitudinal relationships between Alzheimer disease progression and psychosis, depressed mood, and agitation/aggression[J]. Am J Geriatr Psychiatry, 2015, 23(2): 130–140. DOI:10.1016/j.jagp.2013.03.014 |
| [5] | Scheltens P, Blennow K, Breteler MM, et al. Alzheimer's disease[J]. Lancet, 2016, 388(10043): 505–571. DOI:10.1016/S0140-6736(15)01124-1 |
| [6] | 陈思, 董培良. 阿尔兹海默症与氧化应激反应的关系及抗氧化药物的研究进展[J]. 中国现代医药杂志, 2016, 18(11): 98–100. DOI:10.3969/j.issn.1672-9463.2016.11.031 |
| [7] | 吴念, 陈亚琼, 陈晓, 等. 五味子乙素对BaP致HTR8-SVneo细胞损伤的保护作用及机制[J]. 国际妇产科学杂志, 2016, 43(1): 45–48. |
| [8] | Mohsenzadegan M, Mirshafiey A. The immunopathogenic role of reactive oxygen species in Alzheimer disease[J]. Iran J Allergy Asthma Immunol, 2012, 11(3): 203–216. |
| [9] | Zhang XY, Zhang LX, Guo YL. Schisandrin B inhibits the proliferation of airway smooth muscle cells via microRNA-135a suppressing the expression of transient receptor potential channel 1[J]. Cell Biol Int, 2016, 40(7): 742–749. DOI:10.1002/cbin.v40.7 |
| [10] | 杨擎, 隋欣, 王宝森, 等. 五味子乙素对谷氨酸诱导SH-SY5Y细胞损伤的保护作用及其机制[J]. 吉林大学学报:医学版, 2016, 42(1): 80–84. |
| [11] | 于洋, 赖巧. ERK等激酶途径介导五味子提取物激活Nrf2信号通路的研究[J]. 广州中医药大学学报, 2014, 31(6): 957–962. |
| [12] | 肖瑞颖, 王伟, 钱俊峰. 五味子不同产地、部位及提取工艺对木脂素成分含量影响的研究[J]. 天津药学, 2016, 28(5): 8–11. |
| [13] | Li LB, Zhang TR. Schisandrin B attenuates acetaminophen-induced hepatic injury through heat-shock protein 27 and 70 in mice[J]. J Gastroenterol Hepatol, 2014, 29(3): 640–647. DOI:10.1111/jgh.12425 |
| [14] | 马园, 王大朋, 许熙国, 等. 活性氧、丙二醛及超氧化物歧化酶在NaAsO2致人角质形成细胞恶性转化过程中的动态变化[J]. 卫生研究, 2015, 44(3): 456–561. |
| [15] | Al-Amin MM, Akhter S, Hasan AT, et al. The antioxidant effect of astaxanthin is higher in young mice than aged:a region specific study on brain[J]. Metab Brain Dis, 2015, 30(5): 1237–1246. DOI:10.1007/s11011-015-9699-4 |
| [16] | 谭亲友, 张靖. Nrf2-ARE信号通路功能与临床疾病及相关药物的研究新进展[J]. 中国医院药学杂志, 2016, 36(15): 1331–1336. |
| [17] | 李梅, 金晶, 李佳, 等. 五味子乙素激活Nrf2/ARE通路对顺铂致HK-2细胞氧化应激损伤的保护作用[J]. 药学学报, 2012, 47(11): 1434–1439. |
| [18] | 黄小平, 邓常清, 邱咏园, 等. 黄芪甲苷和三七的三种有效成分配伍对小鼠脑缺血/再灌注后氧化应激和Nrf2/HO1途径的影响[J]. 中国药理学通报, 2013, 29(11): 1596–1601. DOI:10.3969/j.issn.1001-1978.2013.11.028 |
| [19] | 董渠龙, 王华, 侯海燕, 等. Nrf2-ARE信号通路功能的研究进展[J]. 国际妇产科学杂志, 2015, 42(4): 425–428. |
| [20] | 王欣欣, 马姗姗, 孟楠, 等. hUC-MSCs和白藜芦醇对AD小鼠学习忆记能力及脑内SIRT1信号通路的影响[J]. 郑州大学学报:医学版, 2016, 51(5): 576–579. |
 2017, Vol. 43
2017, Vol. 43


