扩展功能
文章信息
- 陈志华, 林素勇, 韩宏景, 苏小宝, 陈绍勤, 戴起宝
- CHEN Zhihua, LIN Suyong, HAN Hongjing, SU Xiaobao, CHEN Shaoqin, DAI Qibao
- 慢病毒转染KISS1基因对人结直肠癌HCT116细胞增殖、侵袭和迁移能力的影响
- Effects of KISS1 gene transfected by lentivirus on proliferation, invasion, and migration abilities of human colorectal cancer HCT116 cells
- 吉林大学学报(医学版), 2017, 43(03): 577-581
- Journal of Jilin University (Medicine Edition), 2017, 43(03): 577-581
- 10.13481/j.1671-587x.20170322
-
文章历史
- 收稿日期: 2016-07-12
结直肠癌是人类最常见的恶性肿瘤之一,随着生活方式的改变和环境等因素的影响,其发病率有逐年上升趋势,且结直肠癌的总体生存率仍较低,结直肠癌的局部复发和远程转移是影响预后的主要原因;KISS1基因是一种新近发现的肿瘤转移抑制基因之一,本课题组前期研究[1-3]显示:KISS1mRNA及其蛋白(metastin)表达水平降低与结直肠癌的TNM分期和转移密切相关,提示KISS1基因能够抑制直肠癌的远处转移,但是目前对KISS1基因抑制结直肠癌转移的具体作用机制尚不十分清楚。本课题组利用慢病毒转染KISS1基因,观察其对KISS1表达情况以及对结直肠癌细胞生物学特性(主要包括侵袭和迁移)的影响,探讨过表达KISS1对结直肠癌细胞的影响,为抑制结直肠癌转移提供理论基础。
1 材料与方法 1.1 细胞株和主要试剂人结肠癌细胞株LoVo、SW620、SW480、HCT-116和HT29为本院中心实验室保存。慢病毒载体的构建和病毒包装由上海吉凯生物公司完成。RPMI-1640培养基为美国Gibco公司产品,TRIzol Reagent和M-MLV逆转录酶为美国Invitrogen公司产品,SYBR®Premix Ex TaqTM(Tli RNaseH Plus)为日本TaKaRa公司产品,BCA蛋白分析试剂盒为美国Thermo Fisher公司产品,DMSO、Matrigel和Transwell小室为美国BD公司产品,KISS1和GAPDH抗体为美国Abcam公司产品。其余试剂均为国产分析纯。
1.2 细胞分组和培养细胞分为对照组、空载体组和过表达组。对照组为等量PBS处理的HCT116细胞,空载体组采用不含KISS1基因的空白Lipofectamine 2000载体与HCT116细胞共培养处理,过表达组采用制备好的含KISS1基因的DNA溶液与Lipofectamine 2000载体转染后,与HCT116细胞共培养处理。细胞贴壁生长于含有10%胎牛血清和100 IU·mL-1青霉素和链霉素的RPMI-1640培养基中,置于37℃、5%CO2的饱和湿度培养箱中培养,每2~3d以0.25%胰蛋白酶消化及传代1次。
1.3 慢病毒转染KISS1基因将对数生长期的HCT116细胞重新接种和培养,待细胞密度达70%~80%时即可用于转染,并在转染前2 h更换为无血清培养基。将制备好的各DNA溶液(pGC-LV载体20 μg、pHelper 1.0载体15 μg和pHelper 2.0载体10 μg)与相应体积Opti-MEM混匀,调整总体积为2.5 mL,另取100 mL Lipofectamine 2000与2.4 mL Opti-MEM混合,均室温下温育5 min后,将两者轻柔颠倒和混匀,室温下温育20min。将混合液转移至细胞培养液中,混匀及培养。8h后倒去含有转染混合物的培养基,PBS轻柔洗涤1次。再加入含10%胎牛血清的培养基25 mL继续培养48 h。
1.4 荧光法测定转染的荧光率(multiplicity of infection,MOI)将已转染的HCT116细胞加入96孔板,每孔加入4×104个细胞,体积为100 μL。根据病毒预期滴度,准备7~10个无菌EP管,每管加入90 μL无血清培养基及待测病毒原液10 μL,混匀。每个待测细胞孔吸除90 μL培养基,加入90μL稀释好的病毒溶液。放入培养箱培养24 h后,加入完全培养基100 μL(不要吹起细胞),4d后观察EGFP荧光表达情况。以同一视野下荧光与普通显微镜观察到细胞数之比为MOI,MOI=(带有绿色荧光的细胞数/普通显微镜下观察的总细胞数)×100%。
1.5 Real-time PCR法检测KISS1 mRNA的表达量收集细胞,以TRIzol提取总RNA,定量后取2 μg总RNA,采用M-MLV逆转录酶逆转录成cDNA,采用ABI 7500 Real-time PCR反应仪检测KISS1及GAPGH mRNA表达量,反应体系为20 μL(cDNA 1 μL,2.5μmol·L-1上、下游引物各1 μL,SYBR Premix Ex Taq 10 μL,25 mmol·L-1 Mg2+ 4 μL,ddH2O 8 μL)。反应程序:95℃、30 s,95℃、5 s,60℃、34 s,共40个循环。引物序列由上海吉凯基因技术化学技术有限公司合成,采用Primer 5.0软件设计引物序列(表 1)。采用相对定量方法RQ=2-△△Ct计算KISS1基因mRNA的表达量。
| Primer | Sequence | Product (bp) | |
| KISSl | Forward | TACTGCTTTTCCTCTGTGCCACC | 89 |
| Reverse | TAGCTGCTGGCCTGTGGGTCT | ||
| GAPDH | Forward | TGACTTCAACAGCGACACCCA | 121 |
| Reverse | CACCCTGTTGCTGTAGCCAAA |
收集细胞,细胞蛋白裂解液裂解,超声剪切DNA,考马斯亮蓝法测定浓度后,行SDS-PAGE电泳,进行KISS1蛋白及GAPDH抗体的蛋白免疫印迹分析实验。显色后观察和量化分析采用化学发光法和GIS1000软件分析系统。KISS1蛋白相对表达量=KISS1灰度值/GAPDH灰度值。
1.7 CCK-8法检测细胞增殖活力每次接种4个培养板,分别于不同时间点(24、48、72和96 h)进行CCK-8检测;于48 h时对余下2个培养板更换新鲜培养基,以保证细胞有充足营养进行生长分裂。每孔加入10 μL CCK-8检测试剂,培养箱中温育2 h后,采用酶联免疫检测仪检测450 nm处吸光度(A)值,以A值表示细胞增殖活力。
1.8 Transwell小室法检测细胞侵袭和迁移能力采用50 μL 1:3稀释的基质胶Matrigel包被Transwell小室上室底部,4℃风干。每孔加入50 μL含10 g·L-1 BSA的无血清培养液,37℃水化30 min。取200 μL 密度为1×105mL-1 细胞悬液接种入上室,下室加入500 μL含5% FBS的培养基,注意避免产生气泡产生;常规培养细胞24 h后,棉签小心擦去基质胶和上室内的细胞,室温下将膜风干,4%多聚甲醛固定15 min,PBS洗涤2次后风干,加入500 μL结晶紫染色液,使膜浸润在染色液中,再于37℃培养箱中孵育15~20 min后取出,PBS洗涤2次;风干后在200倍倒置显微镜下随机选取16个视野拍照及计数。Transwell迁移实验步骤与侵袭实验基本一致,区别是Transwell小室基底膜不需要包被Matrigel胶,细胞密度为1×106mL-1,下室应用含2.5% FBS的完全培养基培养。细胞侵袭和迁移能力以每个高倍镜下细胞个数表示。
1.9 统计学分析采用SPSS19.0统计软件进行统计学分析。各细胞株中KISS1 mRNA和蛋白的表达量、细胞增殖活力、侵袭和迁移能力以x±s表示,组间两两比较时先进行多样本方差齐性检验,若方差齐,则行LSD-t检验。以α=0.05为检验水准。
2 结果 2.1 各细胞中KISS1 mRNA和蛋白的表达量KISS1 mRNA相对表达量:SW620>SW480>LoVo>HT29>HCT-116,SW620和HCT-116与SW480细胞中KISS1 mRNA表达量比较差异有统计学意义(P<0.05);而LoVo、HT29和SW480细胞组间比较差异无统计学意义(P>0.05)。KISS1蛋白相对表达量:SW620>SW480>HT29>LoVo≈HCT-116,HCT-116细胞株中KISS1蛋白相对表达量最少。与SW620细胞比较,HCT-116和LoVo细胞中KISS1蛋白相对表达量降低(P<0.05)。见表 2和图 1。因而筛选出HCT-116细胞株作为后续研究载体。
| (x±s) | ||
| Cell | KISSl mRNA | KISSl protein |
| SW480 | 1.004±0.060 | 0.513±0.019 |
| HT29 | 0.831±0.036 | 0.351±0.022 |
| HCT-116 | 0.364±0.029* | 0.269±0.013* |
| LoVo | 0.852±0.066 | 0.272±0.016* |
| SW620 | 2.548±0.252* | 0.762±0.026* |
| * P < 0.05 vs SW480 cells. | ||

|
| Lane 1:HCT-116 cells; Lane 2:HT29 cells; Lane 3:SW480 cells; Lane 4:Lovo cells; Lane 5:SW620 cells. 图 1 Western blotting法检测各细胞株中KISS1蛋白表达电泳图 Figure 1 Electrophoregram of expressions of KISS1 protein in different cell lines detected by Western blotting method |
|
|
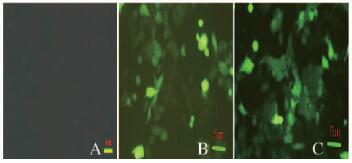
荧光显微镜下(激发波长488 nm,发射波长507 nm)观察各组荧光细胞数,计算MOI;普通显微镜下对照组细胞状态良好,排布均匀呈椭圆形,但未见荧光;对照组和空载体组细胞在荧光显微镜下均可看到增强绿色荧光蛋白(EGFP)(绿色荧光)。见图 2(插页四)。过表达组细胞转染的MOI为84.18%,空载体组则为82.67%。见表 3。
|
| A: Control group; B: Empty group; C: Overexpression group. 图 2 转染后各组细胞中EGFP蛋白表达(×200) Figure 2 Expressions of EGFP protein in cells in various groups after transfection (×200) |
|
|
| Group | No.of cells under ordinary microscope | No.of cells under fluorescence microscope | MOI(η/%) |
| Control | 197.36±6.372 | 0 | 0 |
| Empty | 174.72±4.721 | 147.08±5.821 | 84.18 |
| Over-expression | 162.92±4.926 | 134.69±4.927 | 82.67 |
过表达组细胞中KISS1 mRNA相对表达量(121.731 ± 4.721) 明显高于对照组(0.829 ± 0.082) 和空载体组(1.295 ± 0.063)(P<0.05),而空载体组与对照组细胞中KISS 1 mRNA相对表达量比较差异无统计学意义(P>0.05)。
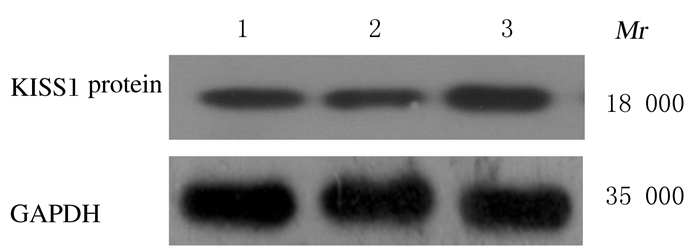
2.4 各组细胞中KISS1蛋白的表达量转染后,过表达组细胞中KISS1蛋白表达量(0.638 4±0.024 2) 高于对照组(0.298 1±0.014 7) 和空载体组(0.282 1±0.017 3)(P<0.05),而空载体组与对照组细胞中KISS1蛋白表达量比较差异无统计学意义(P>0.05)。见图 3。
|
| Lane 1:Control group; Lane 2:Empty vector group; Lane 3:Over-expression group. 图 3 Western blotting法检测转染后各组细胞中KISS1蛋白表达电泳图 Figure 3 Electrophoregram of expressions of KISS1 protein in cells in various groups after transfection detected by Western blotting method |
|
|
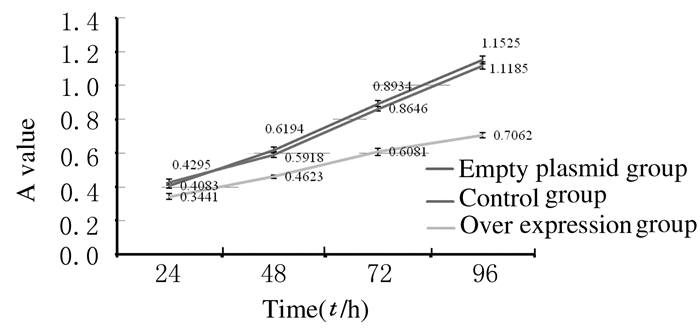
过表达组细胞增殖活力低于对照组和空载体组(P<0.05),而空载体组和对照组细胞增殖活力比较差异无统计学意义(P>0.05)。见图 4。
|
| 图 4 CCK-8法检测各组细胞不同时间的增殖活力 Figure 4 Proliferation ablilties of cells in various groups at diferent time points after transfection detected by CCK-8 method |
|
|
侵袭能力:转染后,过表达组HCT-116细胞侵袭数目(73.821±4.897) 明显少于对照组(153.670±6.367) 和空载体组(148.820±6.353)(P<0.05),而空载体组和对照组侵袭细胞数目比较差异无统计学意义(P=0.093)。迁移能力:过表达组细胞迁移数目(86.150±3.281) 明显少于对照组(218.830±5.328) 和空载体组(226.540±5.273)(P<0.05),而空载体组与对照组迁移细胞数目比较差异无统计学意义(P>0.05)。见图 5(插页四)。

|
| A—C: Invasion; D—F: Migration; A, D:Control group; B, E:Empty group; C, F :Over-expression group. 图 5 各组HCT116细胞侵袭和迁移情况 Figure 5 Invasion and migration HCT116 cells in various groups |
|
|
结直肠癌发病率和病死率分别居恶性肿瘤发病率和死亡率的第3和4位[4]。全球每年新发病例约125万,我国结直肠癌的发病率呈逐年增长趋势[5]。研究[6]显示:患者存活率与转移程度有关联,未发生转移的患者5年存活率可达80%~90%,但存在淋巴转移和(或)远处转移的患者5年存活率仅为60%~68%,转移是影响结直肠癌预后最主要的因素。因此寻找防治结直肠癌转移的方法是提高临床疗效的主要手段,具有重要意义。
KISS1基因为新近发现的肿瘤转移抑制基因之一,近年来日益受到关注,在恶性黑色素瘤中首先发现KISS1基因,随后相继在胃癌、乳腺癌、肾细胞癌和胰腺癌等[7-8]多种恶性肿瘤中均发现KISS1基因的肿瘤转移抑制特性。KISS1基因的最初翻译产物是1种含有145个氨基酸的亲水性蛋白,KISS1蛋白各磷酸化位点磷酸化后可以产生54个氨基酸、14个氨基酸、13个氨基酸和10个氨基酸等大小不等的残基肽,其中1种由54个氨基酸残基肽构成的蛋白受到了广泛的关注,命名为metastin,metastin抑制肿瘤细胞的转移可能是通过降低癌细胞的移行能力[9]、抑制肿瘤细胞的集落形成等机制实现的[10]。本课题组前期研究[4-5]利用免疫组织化学法和RT-PCR法,分析结直肠癌组织中KISS1 mRNA水平与正常结直肠组织的差异以及在不同临床病理分期结直肠癌组织中的差异发现:KISS1基因可能与结直肠癌的恶性程度和转移有关联,这与国内外报道[11-12]结果相一致。本研究筛选出KISS1表达最低的结直肠癌细胞株HCT-116作为研究载体,利用慢病毒转染,转染后KISS1蛋白表达水平明显升高,发现过表达KISS1基因的过表达组细胞侵袭和迁移能力明显降低,提示内源性metastin能够抑制结直肠癌细胞增殖和侵袭能力,且降低了细胞的增殖能力,证实KISS1基因发挥抑制结直肠癌转移的作用,这与其在恶性黑色素瘤细胞及胃癌细胞中的作用[13-14]一致。KISS1基因可抑制结肠癌细胞的侵袭和迁移能力,为防治结直肠癌转移提供了思路。KISS1基因通过何种信号传导途径发挥抑制结直肠癌细胞侵袭和迁移能力的作用机制尚未明确,KISS1基因可能通过KISS1R发挥作用[15]。研究[16-17]表明:过表达KISS1基因可能通过PI3K/Akt/NF-κB信号通路降低基质金属蛋白酶9(MMP-9) 的表达,但具体机制仍不明确。
本研究结果显示:KISS1基因可能具有抑制结直肠癌转移的作用,过表达KISS1基因能够抑制结直肠癌细胞的转移能力,这为KISS1基因成为防治结直肠癌转移的治疗靶点提供了理论基础。
| [1] | 林素勇, 戴起宝, 陈绍勤. Kiss-l蛋白及其受体GPR54在结直肠癌中表达的意义[J]. 肿瘤研究与临床, 2010, 22(6): 406–409. |
| [2] | Chen SQ, Chen ZH, Lin SY, et al. KISS1 methylation and expression as predictors of disease progression in colorectal cancer patients[J]. World J Gastroenterol, 2014, 20(29): 10071–10081. DOI:10.3748/wjg.v20.i29.10071 |
| [3] | 陈绍勤, 林素勇, 戴起宝, 等. 肿瘤转移抑制基因Kiss-1对构建原代人结直肠癌裸鼠肝转移瘤模型的影响[J]. 中华实验外科学, 2012, 29(2): 209–211. |
| [4] | Jemal A, Bray F, Center MM, et al. Global cancer statistics[J]. CA Cancer J Clin, 2011, 61(2): 69–90. DOI:10.3322/caac.v61:2 |
| [5] | Chen Q, Liu ZC, Cheng LP, et al. An analysis of incidence and mortality of colorectal cancer in China 2003-2007[J]. China Cancer, 2012, 21(3): 179–182. |
| [6] | Slipicevic A, Holm R, Emilsen E, et al. Cytoplasmic Brmsl expression in malignant melanoma is associated with increased disease-free survival[J]. BMC Cancer, 2012, 12(1): 73. DOI:10.1186/1471-2407-12-73 |
| [7] | Cho SG, Wang Y, Rodriguez M, et al. Haploinsufficiency in the pro-metastasis KISS1 receptor Gpr54 delays breast tumor initiation, progression and lung metastasis[J]. Cancer Res, 2011, 1571(20): 6535–6546. |
| [8] | Chen Y, Yusenko MV, Kovacs G, et al. Lack of KISS1R expression is associated with rapid progression of conventional renal cell carcinomas[J]. J Pathol, 2011, 223(1): 46–53. DOI:10.1002/path.v223:1 |
| [9] | Ohtaki T, Shintani Y, Honda S, et al. Metastasis suppressor gene Kiss-1 encodes peptide liand of a G-protein-coupled receptor[J]. Nature, 2001, 411(6837): 613–617. DOI:10.1038/35079135 |
| [10] | Navenot JM, Fujii N, Peiper SC, et al. Kiss-1 metastasis suppressor gene product induces suppression of tyrosine kinase receptor signaling to Akt, tumor necrosis factor family ligand expression, and apoptosis[J]. Mol Pharmacol, 2009, 75(5): 1074–1083. DOI:10.1124/mol.108.054270 |
| [11] | Kostakis ID, Agrogiannis G, Vaiopoulos AG, et al. KISS1 expression in colorectal cancer[J]. APMIS, 2013, 121(10): 1004–1010. DOI:10.1111/apm.2013.121.issue-10 |
| [12] | Zhu C, Takasu C, Morine Y, et al. KISS1 associates with better outcome via inhibiting matrix metalloproteinase-9 in colorectal liver metastasis[J]. Ann Surg Oncol, 2015, 22(3): 1516–1523. |
| [13] | Murata K, Inoue M. Metastasis-associated genes in colorectal cancer[J]. Nihon Rinsho, 2003, 61(7): 102–106. |
| [14] | Nash KT, Welch DR. The KISS1 metastasis suppressor:Mechanistic insights and clinical utility[J]. Frontiers Biosci, 2006, 11: 647–659. DOI:10.2741/1824 |
| [15] | Kostakis ID, Agrogiannis G, Vaiopoulos AG, et al. A clinicopathological analysis of KISS1 and KISS1R expression in colorectal cancer[J]. APMIS, 2015, 123(7): 629–637. DOI:10.1111/apm.12397 |
| [16] | Chen S, Chen W, Zhang X, et al. Overexpression of KiSS-1 reduces colorectal cancer cell invasion by downregulating MMP-9 via blocking PI3K/Akt/NF-κB signal pathway[J]. Int J Oncol, 2016, 48(4): 1391–1398. |
| [17] | Chen S, Su X, Gao J, et al. Suppression of Kiss-1 gene inhibits HCT116 human colorectal carcinoma cell migration in vitro via nuclear factor-κB signaling pathway[J]. Nan Fang Yi Ke Da Xue Xue Bao, 2015, 35(11): 1643–1648. |
 2017, Vol. 43
2017, Vol. 43


