扩展功能
文章信息
- 谢慧臣, 罗丽华, 杨强
- XIE Huichen, LUO Li hua, YANG Qiang
- 头顶一颗珠提取物对非酒精性脂肪肝大鼠的治疗作用及其机制
- Therapeutical effect of Toudingyikezhu extract on rats with nonalcoholic fatty liver and its mechanism
- 吉林大学学报(医学版), 2017, 43(03): 566-571
- Journal of Jilin University (Medicine Edition), 2017, 43(03): 566-571
- 10.13481/j.1671-587x.20170320
-
文章历史
- 收稿日期: 2016-04-01
2. 湖北省恩施州中心医院肿瘤科, 湖北 恩施 445000
2. Department of Tumor, Central Hospital, Enshi State, Hubei Province, Enshi 445000, China
研究[1]表明:世界范围内非酒精性脂肪肝(nonalcoholic fatty liver disease, NAFLD)患病率为6%~33%,平均为20%,NAFLD已经成为一种全球性疾病,并呈低龄化、大众化趋势,是一种最常见的肝脏疾病。NAFLD的发生由多种原因造成,其发病与肥胖、高脂血症、糖尿病、胰岛素抵抗、代谢综合征、遗传和环境因素等有关[2]。1998年Day等[3]提出的“二次打击”学说在NAFLD的发生机制中占主导地位。目前NAFLD的发病机制错综复杂,尚缺乏治疗的时效西药,临床治疗主要采用调节血脂的药物作为辅助治疗。西药治疗NAFLD尚缺少可靠的治疗效果,并且有多种不良反应,如可引起血清转氨酶水平升高、水肿、肠胃不适和肝脏负担加重等[4]。研究[5-7]表明:中药在治疗NAFLD方面疗效稳定、资源丰富、经济实惠、毒副作用小,可以多靶点多途径发挥药效,具有广阔的应用前景。目前已有一些治疗NAFLD疗效肯定的中药制剂,头顶一颗珠又名延龄草,是土家族珍稀药材,具有抗癌、降脂、抗炎镇痛和调节免疫等功效[8],但相关的药理机制尚不明确。为加快民族中药的研究和开发,本实验观察头顶一颗珠治疗NAFLD的疗效,初步阐明其对NAFLD的作用机制,为其后续开发和利用提供理论依据。
1 材料与方法 1.1 实验动物和分组清洁级健康雄性SD大鼠60只,体质量(180±20) g,购自武汉博士德生物工程有限公司,动物许可证号:SYXK(鄂)2015-0115。大鼠平衡喂养1周后随机分为正常组,模型组,多烯磷脂酰胆碱组,低、中和高剂量头顶一颗珠提取物组,每组10只。
1.2 药物、主要试剂和仪器制备头顶一颗珠提取物:500 g头顶一颗珠饮片加入500 mL水煮沸,浓缩清膏500 mL,生药含量1g·mL-1,储存备用。高脂饲料50 kg购于湖北人福药业,批号20150102。血清肿瘤坏死因子α(serum tumor necrosis factor-α,TNF-α)、白细胞介素1(interleukin-1,IL-1) 和白细胞介素6(interleukin-6,IL-6) ELISA试剂盒(批号分别为20151016、20150304和20150205) 均购于通蔚试剂(上海)有限公司,糖调节蛋白78(glucose regulated protein 78,GRP78)、兔多克隆抗体、GRP78mRNA实时荧光定量PCR试剂盒(批号分别为20150403和20150105) 和引物均购自北京齐一生物科技公司。ESJ-B精密电子分析天平购自武汉华士特称重科技有限公司,AXTDL5M-Ⅱ低温离心机购自江苏省盐城市安信实验仪器有限公司,SLAN荧光定量PCR检测系统购自上海宏石科技公司。PCR引物序列、产物长度和退火温度见表 1。
| Primer | Sequence(5′-3′) | Length of product(bp) | Temperature(θ/℃) |
| R-actin-S R-actin-A |
ACGCGCACTTTCATTACGGCT CCTGTATACGATTACCTCCTTC |
289 | 66 |
| R-GRP78-S R-GRP78-A |
GTTCCAGCTCTTTACACTCCA CTCGTCTATCCATGGTGCCAAT |
266 | 66 |
除正常组外,其余各组大鼠按文献[9]以0.01 mL·g-1四氯化碳食用油溶液腹腔注射(造模第3周起)联合高脂饮食(造模第1周起)制备大鼠NAFLD模型,持续6周。低、中和高剂量头顶一颗珠提取物组及多烯磷脂酰胆碱组大鼠每日用药量按临床等效剂量及体表面积公式计算分别设定为0.50、1.00和2.00 g·mL-1及0.20 g·L-1,将上述药物以生理盐水配制,正常组和模型组大鼠以生理盐水灌胃,每日灌胃量均为2 mL,共4周。
1.4 大鼠一般情况、体质量和肝指数测定实验结束,所有大鼠禁食不禁水24 h并称体质量,单位为g。所有大鼠均腹腔注射1.2 mL 1%戊巴比妥钠溶液,待大鼠麻醉后腹主动脉采血5 mL,低温离心15 min(3 000 r·min-1),将上清吸取入EP管中,-20℃保存。然后脱颈椎处死大鼠,腹腔剖开并取出动物肝脏,观察其质地弹性、颜色和形态等,以滤纸将肝表面水分吸干并称质量,此为肝湿重,单位为mg,计算肝指数,肝指数=肝湿重/体质量×100%。
1.5 HE染色观察大鼠肝组织病理形态表现取大鼠肝组织同一部位标本,10%甲醛固定,石蜡包埋,常规切片,HE染色,光镜下观察大鼠肝组织脂肪变性及炎症、坏死情况,判断标准参考2003年中华医学会肝脏病学分会脂肪肝和酒精性肝病学组制定的《非酒精性脂肪肝诊断标准》[5]。肝组织炎症、坏死评分标准依据肝叶内炎症细胞浸润和坏死程度设定为无、轻微、轻度、中度和重度5个层次,积分分别为0、1、2、3和4分;肝组织脂肪变性评分标准依据肝细胞含脂滴的百分比设定为无、≤25%、26%~50%、51%~75%、 > 75%这5个层次,积分分别为0、1、2、3和4分。
1.6 ELISA法检测大鼠血清TNF-α、IL-1和IL-6水平大鼠血清TNF-α、IL-1和IL-6水平测定按照试剂盒说明书进行,采用双抗体夹心ELISA法测定。
1.7 免疫组织化学法检测大鼠肝组织中GRP78蛋白表达水平采用免疫组织化学(SP)法和DAB显色法检测肝组织中GRP78蛋白表达水平,每组内每张切片随机挑选5个200倍视野进行拍照,于光镜下观察,棕黄色颗粒为GRP78蛋白阳性产物,采用Image-Pro Plus6.0软件对每张照片进行灰度分析,得出每张照片中阳性细胞的累积吸光度(IA)值,每组所有照片的平均值代表该组IA值。
1.8 PCR法检测大鼠肝组织中GRP78 mRNA表达水平取100mg肝组织,加入到匀浆器中,充分研磨,取上清,离心,采用TRIzol试剂提取肝脏组织总RNA,孵育,用Nanodrop 2000检测RNA浓度和纯度。取RNA溶液,采用RT-PCR试剂盒进行反转录反应,制备cDNA。采用实时荧光定量PCR仪进行扩增,预变性,95℃、10min;循环40次;95℃、15s;60℃、60s;熔解曲线:75℃→95℃,每20s升温1℃;mRNA表达水平计算采用ΔΔCT法:A=CT(目的基因,待测样本)-CT(内标基因,待测样本);B=CT(目的基因,对照样本)-CT(内标基因,对照样本);K=A-B;表达倍数=2-K。
1.9 统计学分析采用SPSS17.0统计软件进行统计学分析。各组大鼠体质量,肝湿重,肝指数,肝脏脂肪变性程度、炎症及坏死积分,血清TNF-α、IL-1和IL-6水平,肝组织中GRP78蛋白和mRNA表达水平以x±s表示,组间比较采用方差分析或LSD检验。以α=0.05为检验水准。
2 结果 2.1 大鼠一般情况、体质量和肝指数正常组大鼠肝脏呈鲜红色,手感柔软且弹性充分;模型组大鼠肝脏色暗红,体积较正常组明显增大,有局灶性变性灶,手感饱满紧张,油腻;其他4组大鼠肝脏形、色及手感与模型组比较均有不同程度好转,其中高剂量头顶一颗珠提取物组大鼠肝脏恢复最为明显,颜色、质地、弹性和柔韧性等均最接近正常组。与正常组比较,模型组大鼠体质量、肝湿重和肝指数均明显增加(P < 0.01);与模型组比较,各剂量头顶一颗珠组和多烯磷脂酰胆碱组大鼠体质量、肝湿重和肝指数均明显降低(P < 0.05或P < 0.01);与多烯磷脂酰胆碱组比较,中和高剂量头顶一颗珠组大鼠体质量、肝湿重和肝指数均明显降低(P < 0.05或P < 0.01);与低剂量头顶一颗珠组比较,中和高剂量头顶一颗珠组大鼠体质量、肝湿重和肝指数均明显降低,且呈剂量依赖性(P < 0.05或P < 0.01)。见表 2。
| (n=10, x±s) | |||
| Group | Body weight (m/g) | Liver wet weight (m/mg) | Liver index (η/%) |
| Control | 239.3±12.9 | 8.3±0.4 | 3.2±0.1 |
| Model | 309.2±17.9* | 16.0±0.7* | 6.0±0.5* |
| Phosphatidylcholine | 270.4±15.2△ | 12.7±0.6△△ | 4.8±0.4△△ |
| Toudingyikezhu extract | |||
| Low dose | 288.4±16.0△ | 13.1±0.6△ | 4.9±0.5△ |
| Middle dose | 260.3±15.1△△#▲ | 11.2±0.5△△▲ | 4.2±0.3△△▲ |
| High dose | 244.1±13.2△△#▲▲ | 8.9±0.8△△#▲▲ | 3.3±0.3△△#▲▲ |
| *P < 0.01vs control group; △P < 0.05, △△P < 0.01 vs model group; #P < 0.05, ##P < 0.01 vs phosphatidylcholine group; ▲P < 0.05, ▲▲P < 0.01 vs low dose of Toudingyikezhu extract group. | |||
HE染色显示:正常组大鼠肝组织肝小叶结构完整清晰,肝窦排列整齐,染色较淡,未见炎性浸润;模型组大鼠肝小叶结构紊乱,肝窦排列紊乱,肝细胞肿胀变形,染色较深,有大量炎细胞浸润;多烯磷脂酰胆碱组和各剂量头顶一颗珠提取物组大鼠肝组织肝小叶结构及肝窦排列较模型组有不同程度改善,染色不同程度变淡,炎性浸润亦不同程度减轻。见图 1(插页三)。

|
| A: Control group B: Model group C: Phosphatidylcholine group D: Low dose of Toudingyikezhu extract group; E: Middle dose of Toudingyikezhu extract group; F: High dose of Toudingyikezhu extract group. 图 1 各组大鼠肝组织病理形态表现(HE, ×200) Figure 1 Pathomorphology of liver tissue of rats in various groups(HE, ×200) |
|
|
与正常组比较,模型组大鼠脂肪变性程度、炎症和坏死积分均明显升高(P < 0.01);与模型组比较,各剂量头顶一颗珠提取物组和多烯磷脂酰胆碱组大鼠脂肪变性程度、炎症和坏死积分均明显降低(P < 0.05或P < 0.01)。与多烯磷脂酰胆碱组比较,中剂量头顶一颗珠提取物组大鼠肝脏脂肪变性程度、炎症积分降低不明显(P > 0.05),而肝脏坏死积分明显降低(P < 0.05);高剂量头顶一颗珠提取物组大鼠肝脏脂肪变性程度、炎症和坏死积分明显降低(P < 0.05或P < 0.01)。与低剂量头顶一颗珠提取物组比较,中和高剂量头顶一颗珠提取物组大鼠脂肪变性程度、炎症和坏死积分均明显降低(P < 0.05或P < 0.01)。见表 3。
| (n=10, x±s) | |||
| Group | Fatty degeneration | Inflammation score | Necrosis score |
| Control | 0.12±0.02 | 0 | 0 |
| Model | 4.01±0.25* | 4.02±0.52* | 0.50±0.05* |
| Phosphatidylcholine | 1.31±0.20△△ | 1.35±0.26△△ | 0.20±0.03△ |
| Toudingyikezhu extract | |||
| Low dose | 2.31±0.22△ | 2.31±0.27△ | 0.29±0.04△ |
| Middle dose | 1.31±0.13△△▲ | 1.34±0.10△△▲ | 0.14±0.02△△#▲ |
| High dose | 0.64±0.06△△#▲▲ | 0.53±0.05△△#▲▲ | 0.05±0.01△△##▲▲ |
| *P < 0.01vs control group; △P < 0.05, △△P < 0.01 vs model group; #P < 0.05, ##P < 0.01 vs phosphatidylcholine group;▲P < 0.05,▲▲P < 0.01 vs low dose of Toudingyikezhu extract group. | |||
与正常组比较,模型组大鼠血清TNF-α、IL-1和IL-6水平均明显升高(P < 0.01);与模型组比较,各剂量头顶一颗珠提取物组和多烯磷脂酰胆碱组大鼠血清TNF-α、IL-1和IL-6水平均明显降低(P < 0.05或P < 0.01);与多烯磷脂酰胆碱组比较,中和高剂量头顶一颗珠提取物组大鼠血清IL-1和IL-6水平均明显降低(P < 0.01),高剂量头顶一颗珠提取物组大鼠血清TNF-α水平明显降低(P < 0.05);与低剂量头顶一颗珠提取物组比较,中和高剂量头顶一颗珠提取物组大鼠血清TNF-α、IL-1和IL-6水平均明显降低(P < 0.05或P < 0.01)。见表 4。
| [n=10, x±s, ρB/(ng·L-1)] | |||
| Group | TNF-α | IL-1 | IL-6 |
| Control | 52.4±4.3 | 114.1±8.7 | 110.2±8.3 |
| Model | 94.2±8.0* | 191.4±12.6* | 171.4±11.5* |
| Phosphatidylcholine | 67.7±5.6## | 155.7±9.9# | 147.5±9.4# |
| Toudingyikezhu extract | |||
| Low dose | 81.3±7.3# | 161.8±10.5# | 150.4±10.7# |
| Middle dose | 66.4±6.6△△▲ | 143.6±9.7△△#▲ | 135.4±9.2△△#▲ |
| High dose | 53.7±4.6△△##▲▲ | 117.8±8.9△△##▲▲ | 112.8±8.7△△##▲▲ |
| *P < 0.01vs control group; △P < 0.05, △△P < 0.01 vs model group;#P < 0.05,##P < 0.01 vs phosphatidylcholine group; ▲P < 0.05, ▲▲P < 0.01 vs low dose of Toudingyikezhu extract group. | |||
与正常组比较,模型组大鼠肝组织中GRP78蛋白阳性表达强度明显增加(图 2,见插页四),GRP78蛋白表达水平明显升高(P < 0.01);与模型组比较,多烯磷脂酰胆碱组和各剂量头顶一颗珠提取物组大鼠肝组织中GRP78蛋白表达水平明显降低(P < 0.05或P < 0.01);与多烯磷脂酰胆碱组比较,中和高剂量头顶一颗珠提取物组大鼠肝组织中GRP78蛋白表达水平不同程度降低(P < 0.05或P < 0.01);与低剂量头顶一颗珠提取物组比较,中和高剂量头顶一颗珠提取物组GRP78蛋白表达水平不同程度降低(P < 0.05或P < 0.01);而高剂量头顶一颗珠提取物组GRP78蛋白表达水平已接近正常组(P > 0.05)。见表 5。
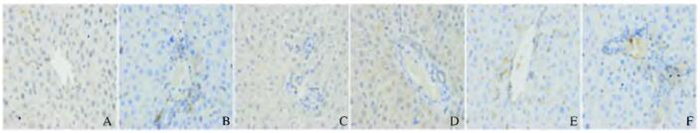
|
| A: Control group; B: Model group; C: Phosphatidylcholine group; D: Low dose of Toudingyikezhu extract group; E: Middle dose of Toudingyikezhu extract group; F: High dose of Toudingyikezhu extract group. 图 2 各组大鼠肝组织中GRP78蛋白表达(SP, ×400) Figure 2 Expressions of GRP78 protein in liver tissue of rats in various groups(SP, ×400) |
|
|
| (n=10, x±s) | ||
| Group | GRP78protein | GRP78 mRNA |
| Control | 5.23±1.02 | 1.10±0.11 |
| Model | 17.43±2.02* | 3.08±0.20* |
| Phosphatidylcholine | 12.57±2.06△ | 2.16±0.15△ |
| Toudingyikezhu extract | ||
| Low dose | 13.15±2.07△ | 2.23±0.16△ |
| Middle dose | 9.66±1.07△△#▲ | 1.67±0.13△△#▲ |
| High dose | 5.92±1.12△△##▲▲ | 1.16±0.12△△##▲▲ |
| *P < 0.01vs control group; △P < 0.05, △△P < 0.01 vs model group; #P < 0.05,##P < 0.01 vs phosphatidylcholine group;▲P < 0.05, ▲▲P < 0.01 vs low dose of Toudingyikezhu extract group. | ||
与正常组比较,模型组大鼠肝组织中GRP78mRNA表达水平明显升高(P < 0.01);与模型组比较,多烯磷脂酰胆碱组和各剂量头顶一颗珠提取物组大鼠肝组织中GRP78mRNA表达水平均明显降低(P < 0.01);与多烯磷脂酰胆碱组比较,中和高剂量头顶一颗珠提取物组大鼠肝组织中GRP78mRNA表达水平不同程度降低(P < 0.05或P < 0.01);与低剂量头顶一颗珠提取物组比较,中和高剂量头顶一颗珠提取物组大鼠肝组织中GRP78mRNA表达水平不同程度降低(P < 0.05或P < 0.01);而高剂量头顶一颗珠提取物组大鼠肝组织中GRP78mRNA表达水平已接近正常组(P > 0.05)。见表 5。
3 讨论NAFLD是一种非明确病因的肝脏损害,严重威胁着人们的健康。NAFLD的发病机制至今尚未完全清楚,目前现代医学对NAFLD的治疗尚缺乏有效手段,主要以护肝、抗肝纤维化并针对并发症进行治疗[10]。中医药在NAFLD的防治方面有一定优势,NAFLD属于中医的“胁痛”和“积聚”范畴,其病因与禀赋、饮食和情志等均有一定的关系,而其病机多属肝脾功能失调、痰湿热淤互结而痹阻肝脏导致脂肪肝的形成。头顶一颗珠属百合科植物,又名延龄草,有抗癌、降脂、抗炎镇痛和调节免疫等功效。研究[11-12]显示:头顶一颗珠能明显降低肝损伤小鼠血清转氨酶水平,增强肝细胞的抗氧化性。
本研究所采用的NAFLD造模法已有文献[13]报道,效果较好,本实验结果显示该方法造模效果良好。采用头顶一颗珠提取物治疗后,镜下观察大鼠肝脏病理形态表现可见:肝组织修复明显,脂肪变性程度、炎症和坏死情况较模型组大鼠明显好转,且与剂量有关。
TNF-α、IL-1和IL-6均由巨噬细胞等免疫细胞产生,是重要的炎症反应介质, 均参与肝脏损伤过程,其表达水平与NAFLD的发生发展有密切关系,且与肝脏病变程度密切相关。TNF-α和IL-6可加速甘油三酯(TG)在肝细胞的合成并促进脂肪酸聚集,使脂肪酸的氧化受到抑制,导致蛋白酶加速分泌和炎细胞浸润及大量氧化产物产生,对肝脏造成二次打击,IL-1可趋化白细胞向肝组织浸润,并可导致大量炎性物质释放,进一步破坏肝细胞[13-14]。本研究结果表明:头顶一颗珠提取物能降低大鼠血液中TNF-α、IL-1和IL-6水平,能对NAFLD大鼠肝脏起到保护作用。
内质网(endoplasmic reticulum,ER)的主要生理功能是负责正确折叠蛋白质的合成转运、信号肽识别和糖基化修饰、Ca2+的贮存和调节及信号转导等。然而,当ER摄取、释放Ca2+紊乱或者蛋白质的加工运输障碍时,就会引起内质网应激(endoplasmic reticulum stress,ERS) [15]。GRP78是内质网分子伴侣蛋白,介导新生蛋白的加工成熟,是促进正常生长状态下细胞蛋白质成熟、维系细胞机能和生命的关键性调节蛋白,被认为是ERS标志性蛋白[16]。研究[17]表明:在应激状态下,内质网内新生蛋白发生错误折叠,通过活化转录因子6作用于GRP78启动子,上调GRP78基因的转录活性,使其表达量升高。肝细胞拥有高度发达的ER,参与肝细胞的许多重要功能,诸如蛋白质合成、糖化和分泌、脂类物质的代谢、糖代谢、毒物及药物代谢等。当肝组织发生损伤时,蛋白质不能在肝细胞内进行正常折叠,可能引发ERS。
近些年关于ERS与各种原因引起肝损伤的关系已逐渐被关注。研究[18]显示:酒精性脂肪肝细胞中有ERS发生,ERS发生时膜表面合成的胆固醇减少,因此通过激活胆固醇调节元件结合蛋白通路反应途径进入细胞核,与靶基因结合,增强靶基因转录,发挥调节脂质代谢的作用。本研究结果显示:四氯化碳食用油溶液腹腔注射联合高脂饮食可明显升高模型大鼠GRP78蛋白和mRNA的表达水平,采用头顶一颗珠提取物治疗后,大鼠GRP78蛋白和mRNA的表达水平均明显降低,且呈剂量依赖性,提示头顶一颗珠提取物可能通过下调大鼠肝组织ESR通路相关分子GRP78的表达抑制或阻断ERS,从而减弱脂质的合成,加速其分解,发挥其抗NAFLD大鼠肝细胞损伤的作用。
| [1] | 舒泳翔, 谭诗云, 吴鹏波. 非酒精性脂肪肝病自噬机制的研究进展[J]. 医学研究杂志, 2016, 45(1): 4–7. DOI:10.11969/j.issn.1673-548X.2016.01.002 |
| [2] | 宋晓超, 马庆华, 毛建良, 等. 非酒精性脂肪肝相关危险因素分析[J]. 江苏预防医学, 2016, 27(1): 21–25. |
| [3] | Day CP, James OF. Steatohepatitis:a tale of two "hits"[J]. Gastroenterology, 1998, 114(4): 842–845. DOI:10.1016/S0016-5085(98)70599-2 |
| [4] | 胡义扬. 中医药治疗非酒精性脂肪性肝病的优势与展望[J]. 世界中医药, 2015, 11(2): 149–152. |
| [5] | 隋晓丹, 邓厚波, 刘铁军. 中医药防治非酒精性脂肪肝病的研究进展[J]. 世界华人消化杂志, 2013, 21(18): 1708–1713. |
| [6] | 陶森, 庞树朝, 郭卉. 中医分期论治非酒精性脂肪性肝病探微[J]. 上海中医药杂志, 2015, 49(2): 61–62. |
| [7] | 杨小平, 张连俊. 中医药治疗非酒精性脂肪性肝病研究进展[J]. 河南中医, 2012, 32(8): 1005–1007. |
| [8] | 李志勇, 周凤琴, 图雅, 等. 土家族药头顶一颗珠现代研究进展[J]. 中国中医药信息杂志, 2011, 18(1): 104–106. |
| [9] | 王俊杰, 方会龙, 李纯伟, 等. 非酒精性脂肪肝模型小鼠的建立[J]. 中国组织工程研究与临床康复, 2011, 15(24): 4395–4399. DOI:10.3969/j.issn.1673-8225.2011.24.007 |
| [10] | 侯鹏高, 吕长淮. 非酒精性脂肪性肝病成因及相关因素研究进展[J]. 齐齐哈尔医学院学报, 2014(22): 3355–3357. |
| [11] | 詹光杰. 头顶一棵珠抗炎镇痛作用的实验研究[J]. 数理医药学杂志, 2011, 24(1): 85–87. |
| [12] | 钟灵, 王振富. 头顶一颗珠对烧伤大鼠微血管反应性及抗氧化酶的影响[J]. 中国应用生理学杂志, 2011, 27(4): 483–484. |
| [13] | 王羚, 董梁, 夏国园, 等. 高脂高糖低蛋白构建大鼠非酒精性脂肪肝模型的实验研究[J]. 职业与健康, 2015, 31(2): 190–192. |
| [14] | 王军英, 王红梅, 王军, 等. 非酒精性脂肪肝患者血清TNF-α、IL-6水平及意义[J]. 中国现代医学杂志, 2013, 23(33): 42–46. DOI:10.3969/j.issn.1005-8982.2013.33.009 |
| [15] | 郎丽翔, 辛雅萍, 丰树焕, 等. 妊娠期糖尿病大鼠胰腺组织中GRP78、TRAF2、Caspase-12蛋白的表达[J]. 郑州大学学报:医学版, 2016, 51(4): 458–462. |
| [16] | 李小会, 赵永凯, 李永杰, 等. 通络益肾方对高糖诱导肾小球系膜细胞GRP78 mRNA及JNK mRNA表达的影响[J]. 中医杂志, 2016, 57(7): 605–609. |
| [17] | 陈梦露, 董仕桢, 常永超, 等. 5-羟色胺对肠炎小鼠结肠组织中GRP78表达的影响[J]. 郑州大学学报:医学版, 2016, 51(2): 171–175. |
| [18] | 谢汝佳, 韩冰, 杨婷, 等. 内质网应激凋亡通路中Caspase12激活介导的肝纤维化大鼠肝细胞凋亡[J]. 世界华人消化杂志, 2016, 24(16): 2470–2477. |
 2017, Vol. 43
2017, Vol. 43


