扩展功能
文章信息
- 蒋雪园, 朴仙姬, 刘畅, 罗英花, 孙虎男, 韩英浩, 申贵男, 臧延青, 金成浩
- JIANG Xueyuan, PIAO Xianji, LIU Chang, LUO Yinghua, SUN Hunan, HAN Yinghao, SHEN Guinan, ZANG Yanqing, JIN Chenghao
- 四溴苯三唑对宫颈癌HeLa细胞凋亡的诱导作用及其机制
- Apoptotic effect of 4, 5, 6, 7-tetrabromobenzotriazole on human cervical cancer HeLa cells and its mechanism
- 吉林大学学报(医学版), 2017, 43(03): 561-565
- Journal of Jilin University (Medicine Edition), 2017, 43(03): 561-565
- 10.13481/j.1671-587x.20170319
-
文章历史
- 收稿日期: 2016-08-10
2. 哈尔滨医科大学附属第五医院妇产科, 黑龙江 大庆 163319
2. Department of Gynecology and Obstetrics, Fifth Affiliated Hospital, Harbin Medical University, Daqing 163319, China
宫颈癌是最常见的妇科恶性肿瘤,在中国女性中发病率居第一位,近年来其发病呈年轻化趋势,因此寻找一种高效、安全和廉价的治疗宫颈癌药物已成为亟待解决的问题[1-2]。四溴苯三唑(4, 5, 6, 7-tetrabromobenzotriazole,TBB)是苯并三唑类衍生物,研究[3-5]表明:苯并三唑类衍生物具有良好的生物活性,如抗菌、抗病毒和抑制肿瘤生长等。目前国内外研究[6-8]显示:TBB可通过不同的机制诱导多种肿瘤细胞,如乳腺癌MCF-7和甲状腺鳞癌SW579等细胞凋亡,但其具体的抗肿瘤机制尚不清楚,尤其TBB对宫颈癌HeLa细胞的作用机制方面的研究少有报道。本研究探讨TBB对人宫颈癌HeLa细胞的杀伤作用、诱导凋亡作用和相关信号通路,进而揭示TBB的抗癌机制,旨在为TBB的临床开发及应用提供实验依据。
1 材料与方法 1.1 细胞和主要试剂人宫颈癌HeLa细胞购自中国科学院细胞研究所。TBB(HPLC,≥98%)购自美国Sigma公司,胰蛋白酶和细胞凋亡检测试剂盒购自北京索莱宝公司,DMEM高糖液体培养基、PBS和青/链霉素购自美国HyClone公司,FBS购自美国Gibco公司,MTT购自美国Amresco公司,Akt、p-Akt(兔抗人多克隆抗体)、β-actin、Bax、Bcl-2、cleaved-caspases-3(鼠抗人多克隆抗体)、Pro-caspase-3(兔抗人多克隆抗体)、HRP标记山羊抗兔IgG和HRP标记山羊抗鼠IgG购自美国Santa Cruz公司。
1.2 人宫颈癌HeLa细胞的培养和实验分组采用含10%胎牛血清、100 U·mL-1青霉素和100 mg·L-1链霉素的DMEM高糖培养基,在5% CO2、37℃饱和湿度的培养箱中孵育人宫颈癌HeLa细胞,待细胞长至70%~80%时进行传代。取对数生长期的细胞进行实验。将人宫颈癌细胞分为以下2组:① 对照组。未加入处理因素;② 实验组。给予TBB,又分为不同时间梯度(3、6、12和24 h)及不同浓度梯度(1、3、10、30和100 μmol·L-1)TBB组。
1.3 MTT法测定HeLa细胞存活率接种人宫颈癌HeLa细胞于96孔板中,使每孔细胞数约为1×104个。在5% CO2、37℃培养箱里孵育24 h,采用含有1% FBS的培养液血清饥饿细胞2 h后,加入不同浓度TBB(1、3、10、30和100 μmol·L-1)处理24 h。各浓度设置8个复孔,同时实验组分别设置溶剂对照组(加入等量的1 μL DMSO)和调零组(加入100 μL DMSO)。每孔加入15 μL MTT,培养箱孵育2 h。弃去培养液,加入100 μL DMSO,放在振荡器上震荡15 min后,采用酶联免疫检测仪在540 nm处测定吸光度(A)值,并计算各组细胞的存活率。每组实验重复3次。细胞存活率=(实验组A值-空白调零组A值)/(对照组A值-空白调零组值)[9]×100%。
1.4 倒置显微镜下观察HeLa细胞形态表现取对数生长期的人宫颈癌HeLa细胞,调整细胞密度至每孔1×105个,采用30 μmol·L-1 TBB分别处理细胞0、3、6、12和24 h后,置于倒置显微镜下观察细胞形态表现。
1.5 Annexin Ⅴ-FITC/PI双染检测HeLa细胞凋亡率取对数生长期的人宫颈癌HeLa细胞接种于6孔板中(每孔1×105个细胞),采用30 μmol·L-1 TBB分别处理细胞0、3、6、12和24 h后,弃去培养液,采用PBS洗涤2次,加入195 μL Annexin Ⅴ-FITC结合液,再依次加入3 μL Annexin Ⅴ-FITC和2 μL PI染色液,敲打混匀后通过荧光显微镜观察细胞凋亡率。细胞凋亡率=凋亡细胞数/(凋亡细胞数+正常细胞数)×100%[10]。
1.6 流式细胞术检测HeLa细胞凋亡率取对数生长期的人宫颈癌HeLa细胞,调整细胞密度至每孔1×105个,接种至6孔板中,采用30 μmol·L-1TBB分别处理细胞0、3、6、12和24 h后,弃去培养液,磷酸盐缓冲液(PBS)洗涤1次,将细胞收集至1.5 mL离心管中,加入195 μL Annexin Ⅴ结合液重选细胞,再加入3 μL Annexin Ⅴ-FITC和2 μL PI染色液混匀后,室温避光孵育15 min,立即采用流式细胞术检测细胞凋亡率。细胞凋亡率=凋亡细胞数/(凋亡细胞数+正常细胞数)×100%[11]。
1.7 Western blotting法检测细胞中凋亡相关蛋白p-Akt、Akt、Bcl-2、Bax、cleaved-caspase-3和Pro-caspase-3表达水平收集对照组和实验组HeLa细胞至离心管中,按常规方法裂解细胞,考马斯亮蓝法测定蛋白浓度。取30 μg样品与5×buffer上样缓冲液混合,沸水浴5 min后,进行12% SDS-PAGE电泳分离,然后转移到硝酸纤维素膜(NC膜)上,置于5%脱脂乳的TBST封闭液中封闭1 h,加入一抗(抗凋亡蛋白p-Akt、Akt和Bcl-2,促凋亡蛋白Bax、cleaved-caspase-3和Pro-caspase-3)4℃过夜孵育。采用TBST洗涤5次,每次5 min,加入HRP标记的二抗,室温孵育1 h,ECL化学发光试剂显色。通过化学发光型凝胶成像系统呈像,内参为β-actin。采用ImageJ 1.42q软件进行灰度分析。蛋白表达水平=实验组灰度值/对照组灰度值。
1.8 统计学分析采用SPSS 13.0统计软件进行统计学分析。各组细胞存活率、细胞凋亡率和细胞中凋亡相关蛋白p-Akt、Akt、Bcl-2、Bax、cleaved-caspase-3及Pro-caspase-3表达水平以x±s表示,组间比较采用独立样本t检验。以α=0.05为检验水准。
2 结果 2.1 MTT比色法检测TBB处理后HeLa细胞存活率随着TBB浓度的增加,细胞存活率明显降低。1、3、10、30和100 μmol·L-1TBB处理后,细胞存活率分别为(84.66±5.79)%、(54.29±10.40)%、(34.64±6.51)%、(20.24±4.34)%和(5.43±1.60)%,组间比较差异均有统计学意义(P < 0.01)。
2.2 各组HeLa细胞形态表现倒置显微镜下观察,对照组细胞生长旺盛,形态呈梭型或多边形,细胞贴壁牢固,细胞膜边界完整。经30 μmol·L-1 TBB处理3、6、12和24 h后,随着药物处理时间的增加,细胞增殖变得缓慢,且细胞形态发生皱缩凝聚、逐渐变圆,可见大量细胞悬浮在培养皿中。TBB处理时间越长,上述细胞形态改变越明显。见图 1。

|
| A:Control group; B-E:Experiment group (3, 6, 12 and 24 h). 图 1 倒置显微镜下各组HeLa细胞形态表现(×200) Figure 1 Morphology of HeLa cells in various groups under inverted microscope(×200) |
|
|
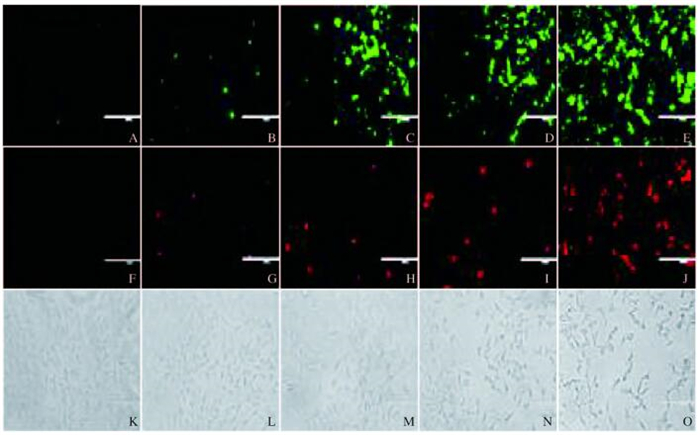
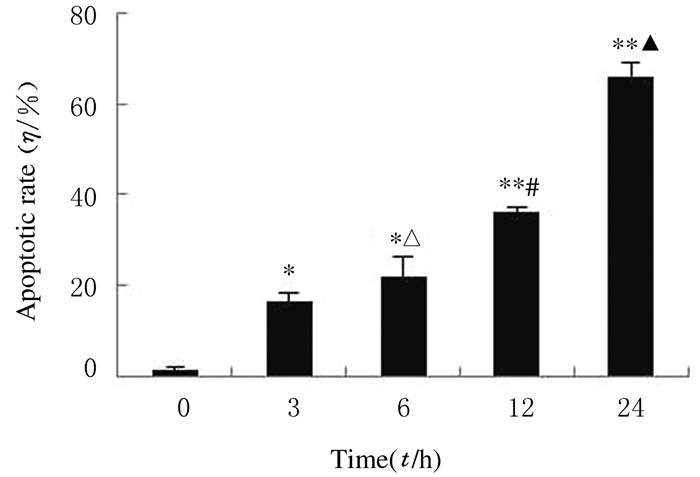
随着药物处理时间的延长,细胞中荧光强度明显增加,HeLa细胞凋亡率逐渐升高,不同处理时间HeLa细胞凋亡率组间比较差异具有统计学意义(P < 0.01)。见图 2(插页三)和3。
|
| A—E: Annexin Ⅴ-FITC; F—J: PI; K: Control group; L—O: Experiment group (3, 6, 12 and 24 h). 图 2 Amiexin Ⅴ-FITC/PI双染法检测各组HeLa细胞凋亡形态表现(×200) Figure 2 Apoptotic morphology of HeLa cells in various groups detected with Annexin Ⅴ-FITC/PI double staining (×200) |
|
|
|
| *P < 0.05, **P < 0.01 compared with control group(0 h); △P < 0.05 compared with 3 h; #P < 0.05 compared with 6 h; ▲P < 0.05 compared with 12 h. 图 3 Annexin Ⅴ-FITC/PI双染法检测HeLa细胞凋亡率 Figure 3 Apoptotic rates of HeLa cells detected by Annexin Ⅴ-FITC/PI double staining |
|
|
HeLa细胞经30 μmol·L-1 TBB处理不同时间(3、6、12和24 h)后,出现明显的凋亡现象,并呈时间依赖性。当药物处理时间为3 h时,其细胞凋亡率仅为8.11%,而处理时间达到24 h时,细胞凋亡率达63.46%。见图 4。

|
| A: Flow cytometry; B: Quantitative analysis.*P < 0.05, ** P < 0.01 compared with control group(0 h); △P < 0.05 compared with 3 h; #P < 0.05 compared with 6 h; ▲P < 0.05 compared with 12 h. 图 4 流式细胞术检测HeLa细胞凋亡率 Figure 4 Apoptotic rates of HeLa cells detected by flow cytometry |
|
|
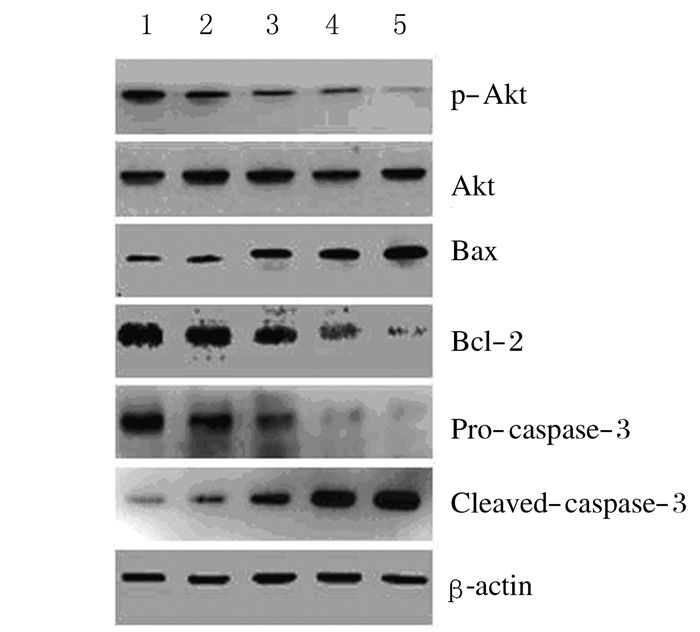
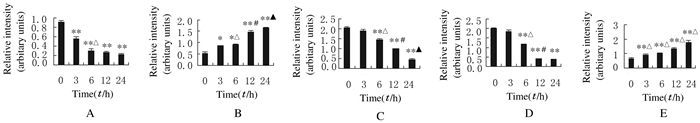
与对照组比较,实验组HeLa细胞中抗凋亡蛋白p-Akt和Bcl-2的表达水平随处理时间的延长逐渐降低;促凋亡蛋白Bax和cleaved-caspase-3表达水平逐渐升高,Pro-caspase-3表达水平逐渐降低(P < 0.05或P < 0.01)。见图 5和6。
|
| Lane 1: Control group; Lane 2-5: Experiment group (3, 6, 12 and 24 h). 图 5 Western blotting法检测HeLa细胞中凋亡相关蛋白的表达电泳图 Figure 5 Electrophoregram of expressions of apoptosis-related proteins in HeLa cells detected by Western blotting method |
|
|
|
| A: P-Akt; B: Bax; C: Bcl-2; D: Pro-caspase-3;E:Cleaved-caspase-3. *P < 0.05, **P < 0.01 compared with control group(0 h); △P < 0.05 compared with 3 h; #P < 0.05 compared with 6 h; ▲P < 0.05 compared with 12 h. 图 6 各组HeLa细胞中凋亡相关蛋白的表达水平 Figure 6 Expression levels of apoptosis-related proteins in HeLa cells in various groups |
|
|
本研究首先采用形态学和MTT比色法对TBB的细胞杀伤作用进行初步检测,结果显示:TBB可以抑制人宫颈癌HeLa细胞的增殖。对照组细胞的生长状态良好,细胞形态规则,贴壁牢固;而实验组细胞生长受到抑制,可见细胞皱缩,膜泡增加,且其变化的程度随TBB浓度的增加而增加,呈剂量依赖性,说明TBB对人宫颈癌HeLa细胞具有杀伤作用。
细胞凋亡是多基因严格控制的细胞自主有序死亡过程,然而凋亡过程紊乱可能与肿瘤发生发展有直接或间接的联系[12]。因此,诱导细胞凋亡被认为是抗肿瘤药物研发的新靶点,通过调控细胞信号转导途径诱导癌细胞的凋亡已成为目前肿瘤学领域的研究热点之一。Akt信号通路作为细胞中重要的信号传导途径参与调控细胞生存、增殖及凋亡[13]。研究[14]表明:在宫颈癌病变组织中PI3K/Akt阳性表达率逐渐升高,提示Akt信号通路与宫颈癌的发生有密切联系。本研究探讨TBB是否能够诱导人宫颈癌HeLa细胞发生凋亡,采用Annexin Ⅴ-FITC/PI双染法和流式细胞术检测细胞凋亡情况,结果显示:TBB可诱导人宫颈癌HeLa细胞发生凋亡,细胞凋亡率随着TBB处理时间的延长而升高。为了阐明TBB诱导细胞发生凋亡的机制,本研究采用Western blotting法在分子水平上检测细胞凋亡相关蛋白表达水平变化的结果显示:抗凋亡蛋白p-Akt和Bcl-2表达水平逐渐降低,促凋亡蛋白Bax和cleaved-caspase-3表达水平逐渐增加,Pro-caspase-3表达水平逐渐降低。PI3K激活的Akt可以通过磷酸化作用激发或抑制下游靶蛋白Bad、Bcl-2、caspase-9、caspase-3和NF-κB等蛋白,达到抑制细胞凋亡的目的[15-16],验证了TBB可能通过调控Akt信号通路的活性实现诱导HeLa细胞凋亡。
综上所述,TBB可能通过抑制Akt信号通路的活性诱导人宫颈癌HeLa细胞发生凋亡。本实验结果初步证明了TBB诱导人宫颈癌HeLa细胞凋亡的作用机制,为今后宫颈癌的治疗提供了实验依据。
| [1] | 廖震华. 宫颈癌患者临床病理特征及预后分析[D]. 厦门: 福建医科大学, 2010. |
| [2] | 付艳, 邓伟国, 韩淑梅, 等. 宫颈癌的青年化与早期发现[J]. 吉林大学学报:医学版, 2002, 28(5): 494–497. |
| [3] | 肖锡港, 房林, 李华, 等. 酪蛋白激酶Ⅱ抑制剂促进MCF-7乳腺癌细胞凋亡[J]. 中华实验外科杂志, 2011, 28(12): 2121–2123. DOI:10.3760/cma.j.issn.1001-9030.2011.12.031 |
| [4] | Handratta VD, Vasaitis TS, Njar VCO, et al. Novel C-17-heteroaryl steroidal CYP17 inhibitors/antiandrogens:synthesis, in vitro biological activity, pharmacokinetics and antitumor activity in the LAPC4 human prostate cancer xenograft model[J]. J Med Chem, 2005, 48(8): 2972–2984. DOI:10.1021/jm040202w |
| [5] | Gyenis L, Kus A, Bretner M, et al. Functional proteomic strategy for validation of protein kinase inhibitors reveals new targets for a TBB-derived inhibitor of protein kinase CK2[J]. J Proteomics, 2013, 81(9): 70–79. |
| [6] | 刘超, 刘洋, 赵颂. 蛋白激酶CK2抑制剂TBB对甲状腺鳞癌细胞株SW579 CK2β和A-表达的影响[J]. 吉林大学学报:医学版, 2012, 38(2): 276–280. |
| [7] | 闫威, 任丽莉, 孟智超, 等. 蛋白激酶CK2抑制剂四溴苯三唑可促进卵巢癌CAOV3细胞凋亡[J]. 第三军医大学学报, 2015, 37(14): 1478–1481. |
| [8] | 王翠瑶, 刘超, 任丽莉, 等. TBB通过WNT/β-catenin通路抑制甲状腺滤泡状癌细胞FTC133的增殖与迁移[J]. 基础医学与临床, 2014, 34(10): 1381–1385. DOI:10.3969/j.issn.1001-6325.2014.10.015 |
| [9] | 张巍, 吴亚猛, 陈思瑶, 等. 胡桃醌对宫颈癌SiHa细胞增殖及细胞周期的影响[J]. 吉林大学学报:医学版, 2015, 41(4): 697–700. |
| [10] | 刘阳, 刘畅, 罗英花, 等. 黄芪有效成分对人食道癌HCE-4细胞凋亡的影响[J]. 药物评价研究, 2016, 39(3): 377–381. |
| [11] | 刘畅, 罗英花, 蒋雪园, 等. 大黄素对人肝癌Huh7细胞的凋亡作用及机制研究[J]. 药物评价研究, 2016, 39(3): 367–371. |
| [12] | Velasco G, Sánchez C, Guzmán M. Anticancer mechanisms of cannabinoids[J]. Curr Oncol, 2016, 23(2): S23–S32. |
| [13] | 齐世美, 戚之琳. 七叶皂苷钠通过抑制A-和ERK信号通路诱导HeLa细胞凋亡及对死亡受体表达的影响[J]. 中国病理生理杂志, 2014, 30(2): 239–244. |
| [14] | 石海燕, 左艳丽, 林齐睿, 等. 子宫颈病变组织中HPV16感染与TLR4介导的PI3K/A-信号通路相关蛋白表达的关系[J]. 临床与试验病理学杂志, 2014, 30(11): 1232–1236. |
| [15] | Shin DY, Kim GY, Hwang HJ, et al. Diallyl trisulfide-induced apoptosis of bladder cancer cells is caspase-dependent and regulated by PI3K/Akt and JNK pathways[J]. Environ Toxicol Pharmacol, 2014, 37(1): 74–83. DOI:10.1016/j.etap.2013.11.002 |
| [16] | 王李俊, 杨琴, 王飞, 等. 桦褐孔菌醇诱导人乳腺癌MCF-7细胞凋亡的分子机制研究[J]. 中草药, 2016, 47(6): 970–973. |
 2017, Vol. 43
2017, Vol. 43


