扩展功能
文章信息
- 杨战锋, 李晓勇, 周百中, 陈升阳
- YANG Zhanfeng, LI Xiaoyong, ZHOU Baizhong, CHEN Shengyang
- 栀子大黄汤对酒精性脂肪肝大鼠的保护作用
- Protective effect of Zhi Zi Da Huang Tang on rats with alcoholic fatty liver
- 吉林大学学报(医学版), 2017, 43(03): 555-560
- Journal of Jilin University (Medicine Edition), 2017, 43(03): 555-560
- 10.13481/j.1671-587x.20170318
-
文章历史
- 收稿日期: 2017-01-03
酒精性脂肪肝(alcoholic fatty liver,AFL)是我国常见的肝病之一,近年来其发病率呈上升趋势,严重危害人民的生命健康。AFL的形成原因主要包括长期酒精刺激和高脂饮食。AFL起初主要表现为脂肪肝,包括甘油三酯(TG)等指标升高,随着饮酒的继续,脂肪肝进一步恶化,从而产生了炎症性病变,发展为肝炎。如若不及时治疗,最终会导致肝纤维化,甚至肝癌[1]。而目前针对AFL的治疗多以降脂保肝等治疗方法为主[2-3]。
栀子大黄汤来源于《金匮要略》,作为临床中经典的中药方剂,主要由栀子、大黄、枳实和豆豉4种中药组成,临床上常采用加减方进行黄疸等的治疗[4]。研究[5]表明:栀子大黄汤具有保肝抗炎等相关作用,但是栀子大黄汤的保肝和抗炎作用机制尚未明确,栀子大黄汤对AFL是否具有一定的保护作用尚不清楚。本研究探讨栀子大黄汤治疗AFL的药效作用和保护机制,为栀子大黄汤的临床应用提供实验依据。
1 材料与方法 1.1 实验动物、主要试剂和仪器54只雄性SPF级SD大鼠购自于广东省医学实验动物中心,体质量(250±10) g,动物许可证号:(粤)2013-0005。大黄、栀子、枳实和豆豉(广州汉古中医药房,批号:160215、151228、151203和151025),天门冬氨酸氨基转移酶(AST)和谷氨酸氨基转移酶(ALT)(南京建成生物试剂有限公司),乙醇脱氢酶(ADH)、乙醛脱氢酶(ALDH)、肿瘤坏死因子α(TNF-α)、白细胞介素6(IL-6) 和IL-1β酶联免疫试剂盒(武汉华美生物技术有限公司),苏木素-伊红(HE,广州浩码生物技术有限公司),PBS(美国Hyclone公司,批号:076094),水合氯醛(广州齐云生物科技公司),辛伐他汀(美国Sigma公司)。油脂含量为45%的高脂饲料购于广东省医学实验动物中心(批号为20151208)。电动匀浆机(日本IKA公司),病理全扫描显微镜(日本Nikon公司);CU600型电热恒温水浴锅(上海一恒科学仪器有限公司),组织切片机(美国Leica公司),旋转蒸发仪(广州东巨公司),低速离心机、移液枪和酶标仪(美国Thermo公司)。
1.2 动物分组和给药方法造模前54只大鼠分为正常对照组和模型对照组,其中正常对照组10只,模型对照组44只,模型对照组大鼠饲喂油脂含量为45%的高脂饲料,正常对照组大鼠给予普通饲料;模型对照组大鼠按照6.0mL·kg-1剂量灌胃给予50%乙醇溶液,每天1次,持续4周;4只大鼠未造模成功。正常对照组大鼠灌胃给予同等体积的蒸馏水作为对照。造模结束后大鼠尾静脉取血,经3000r·min-1离心10min取血清,测定2组大鼠血清总胆固醇(TC)、TG、AST和ALT水平,根据相关指标将模型对照组大鼠分成模型组、阳性药物组(辛伐他汀10.0 mg·kg-1)、低剂量栀子大黄汤组(5.0 g·kg-1)和高剂量栀子大黄汤组(10.0 g·kg-1)。药物制备:将大黄、栀子、枳实和豆豉按照3:9:12:10的比例采用水煎煮的方法,经过2次煎煮后,合并水煎液并滤过,用旋转蒸发仪将水煎液浓缩成每毫升含生药1g,4℃冰箱保存备用。给药持续4周,每2周经尾静脉取血测定血清TC、TG、AST和ALT水平,给药结束后,采用10%水合氯醛麻醉大鼠,腹主动脉取血,3000 r·min-1离心10min后分离血清,测定血清相关指标;分离大鼠肝脏称质量并计算肝脏系数,肝脏系数=肝质量/体质量×100%;取一小部分肝脏用4%多聚甲醛固定,用于病理组织检查,剩余肝脏组织分装冻存于-80℃,备用。
1.3 大鼠血清相关指标的检测大鼠血清TC、TG、AST、ALT、TNF-α、IL-1β和IL-6水平测定严格按照试剂盒说明书进行。
1.4 大鼠肝组织中TC、TG、ADH、ALDH、AST和ALT水平的检测取冻存的肝组织,用剪刀将其剪碎成小块,肝脏重量和PBS按照1:10的比例采用电动匀浆机研磨2min之后将匀浆液以3000r·min-1离心10min,取上清液用于测定ADH、ALDH、AST和ALT水平;肝组织中TC和TG水平的测定采用异丙醇作为匀浆介质,提取肝组织后,离心取上清液,用于测定肝组织中TC和TG水平。
1.5 大鼠肝组织病理形态表现观察和评分经多聚甲醛完全浸泡之后,取出肝组织,脱水、石蜡包埋、切片,于62℃恒温烘烤6h,采用HE染色后由本院病理科医师参照《肝脏病理学》进行病理学观察并评分[6-8]。
1.6 统计学分析采用SPSS 21.0统计软件进行统计学分析。各组大鼠体质量,血清及肝组织中TC、TG、AST、ALT、ADH、ALDH、TNF-α、IL-6和IL-1β水平以x±s表示, 组间比较采用单因素方差分析。以α=0.05为检验水准。
2 结果 2.1 各组大鼠体质量和血清TC、TG、AST和ALT水平与正常对照组比较,模型对照组大鼠血清TC、TG、AST和ALT水平明显升高(P < 0.05或P < 0.01)。见表 1。
| (x±s) | ||||||
Group |
n | Body weight (m/g) |
TC [cB/(mmol·L-1)] |
TG [cB/(mmol·L-1)] |
AST [λB/(U·L-1)] |
ALT [λB/(U·L-1)] |
| Normal control | 10 | 325.6±20.1 | 3.80±0.49 | 1.70±0.15 | 34.0±5.8 | 49.0±3.2 |
| Model control | 40 | 380.9±22.4** | 5.40±0.66** | 3.50±0.31** | 82.0±9.3** | 67.0±10.2* |
| *P < 0.05, ** P < 0.01 vs normal control group. | ||||||
给药2周后,与正常对照组比较,其他各组大鼠体质量均增加(P < 0.01)。与模型组比较,辛伐他汀和高剂量栀子大黄汤组大鼠血清TC和TG水平明显降低(P < 0.05或P < 0.01),低剂量栀子大黄汤组大鼠血清TC和TG水平无明显变化(P > 0.05), 与模型组比较,辛伐他汀组、低和高剂量栀子大黄汤组大鼠血清AST水平降低(P < 0.01),高剂量栀子大黄汤组大鼠血清ALT水平降低(P < 0.05)。见表 2。
| (n=10, x±s) | |||||
| Group | Body weight (m/g) |
TC [cB/(mmol·L-1)] |
TG [cB/(mmol·L-1)] |
AST [λB/(U·L-1)] |
ALT [λB/(U·L-1)] |
| Normal control | 352.0±20.1 | 3.70±0.32 | 1.90±0.19 | 32.0±6.1 | 39.0±4.9 |
| Model | 422.4±22.4** | 5.50±0.48** | 3.60±0.25** | 94.0±7.8** | 72.0±11.5* |
| Simvastatin | 408.7±19.4** | 4.30±0.66**△△ | 2.70±0.29**△ | 74.0±11.5**△△ | 68.0±9.8** |
| ZZDHT | |||||
| Low dose | 422.5±18.0** | 5.40±0.54** | 3.40±0.42** | 89.0±9.7**△△ | 68.0±7.9** |
| High dose | 415.6±15.2** | 4.90±0.49**△ | 2.90±0.88**△ | 71.0±11.3**△△ | 55.0±4.3**△ |
| *P < 0.05, **P < 0.01 compared with normal control group; △P < 0.05, △△P < 0.01 compared with model group. | |||||
给药4周后,与正常对照组比较,其他各组大鼠体质量明显增加(P < 0.01)。与模型组比较,辛伐他汀组、低和高剂量栀子大黄汤组大鼠血清TC、TG、AST和ALT水平明显降低(P < 0.05或P < 0.01),辛伐他汀和高剂量栀子大黄汤组大鼠血清IL-6、TNF-α和IL-1β水平明显降低(P < 0.01),辛伐他汀和高剂量栀子大黄汤组大鼠血清ADH和ALDH水平明显降低(P < 0.05或P < 0.01),低剂量栀子大黄汤组大鼠血清ADH水平明显降低(P < 0.05)。见表 3和4。
| (n=10, x±s) | |||||
| Group | Body weight (m/g) |
TC [cB/(mmol·L-1)] |
TG [cB/(mmol·L-1)] |
AST [λB/(U·L-1)] |
ALT [λB/(U·L-1)] |
| Normal control | 363.0±17.2 | 3.20±0.58 | 1.90±0.30 | 38.0±6.2 | 41.0±4.8 |
| Model | 468.0±19.0* | 5.90±1.03* | 3.90±0.22* | 127.0±12.4* | 97.0±8.9* |
| Simvastatin | 418.3±18.4*△△ | 4.40±0.73*△△ | 2.40±0.48*△△ | 80.0±13.5*△△ | 72.0±12.4*△△ |
| ZZDHT | |||||
| Low dose | 431.1±19.8*△ | 5.10±1.20*△ | 3.30±0.33*△ | 72.0±14.2*△△ | 70.0±17.8*△ |
| High dose | 425.9±31.5*△△ | 4.60±0.99*△△ | 2.70±0.49*△△ | 56.0±12.9*△△ | 58.0±9.2*△△ |
| *P < 0.01 compared with normal control group; △P < 0.05, △△P < 0.01 compared with model group. | |||||
| (n=10, x±s) | |||||
| Group | IL-6 [ρB/(μg·L-1)] |
TNF-α [ρB/(μg·L-1)] |
IL-1β [ρB/(μg·L-1)] |
ADH [λB/(U·L-1)] |
ALDH [λB/(U·L-1)] |
| Normal control | 1.02±0.11 | 92.50±10.61 | 32.90±5.26 | 1.40±0.32 | 0.60±0.12 |
| Model | 3.24±0.42**△△ | 209.40±15.26** | 125.40±9.42** | 4.80±1.49** | 1.80±0.37** |
| Simvastatin | 2.32±0.39** | 172.40±25.46**△△ | 98.00±10.26**△△ | 3.70±1.06**△ | 1.20±0.18**△△ |
| ZZDHT | |||||
| Low dose | 2.95±0.14** | 156.20±23.26**△△ | 72.20±13.29**△△ | 3.80±0.99**△ | 1.40±0.49* |
| High dose | 2.21±0.26**△△ | 138.40±9.88**△△ | 66.50±11.20**△△ | 3.20±1.31**△△ | 1.20±0.21**△ |
| *P < 0.05, **P < 0.01 compared with normal control group; △P < 0.05, △△P < 0.01 compared with model group. | |||||
与模型组比较,辛伐他汀组、低和高剂量栀子大黄汤组大鼠肝组织中TC、TG、AST、ALT、ADH和ALDH水平降低(P < 0.05或P < 0.01),与血清相关指标变化基本吻合。见表 5。
| (n=10, x±s) | ||||||
| Group | TC [cB/(mmol·L-1)] |
TG [cB/(mmol·L-1)] |
AST [λB/(U·L-1)] |
ALT [λB/(U·L-1)] |
ADH [λB/(U·mg-1)] |
ALDH [λB/(U·mg-1)] |
| Normal control | 2.80±0.33 | 1.20±0.11 | 28.0±2.9 | 19.0±4.1 | 0.90±0.18 | 0.40±0.17 |
| Model | 4.60±0.22** | 2.60±0.14** | 91.0±5.3** | 70.0±8.2** | 2.30±0.26** | 1.60±0.22** |
| Simvastatin | 3.10±0.26*△△ | 1.80±0.09**△△ | 78.0±3.9**△△ | 44.0±8.0**△△ | 1.90±0.31**△ | 0.90±0.13**△△ |
| ZZDHT | ||||||
| Low dose | 3.50±0.83*△△ | 2.30±0.17*△△ | 57.0±6.8**△△ | 49.0±7.8**△△ | 1.50±0.44**△△ | 1.20±0.21**△ |
| High dose | 3.30±0.12**△△ | 2.10±0.22**△△ | 45.0±3.2**△△ | 46.0±7.2**△△ | 1.60±0.20**△△ | 0.70±0.16*△△ |
| *P < 0.05, **P < 0.01 compared with normal control group;△P < 0.05, △△P < 0.01 compared with model group. | ||||||
在造模给药之后,与正常对照组比较,模型组大鼠肝脏出现明显的脂肪化和肝损伤,肝细胞成块状坏死,出现气球样空泡。辛伐他汀组和高剂量栀子大黄汤组大鼠肝组织病理损伤的情况明显改善,低剂量栀子大黄汤组也有一定的改善趋势,药效作用相对高剂量栀子大黄汤组和辛伐他汀组明显下降。模型组大鼠病理评分最高,肝脏系数最大;与模型组比较,辛伐他汀组和高剂量栀子大黄汤组肝脏系数和病理评分明显降低(P < 0.01),低剂量栀子大黄汤组肝脏病理评分降低(P < 0.01)。见表 6和图 1(插页三)。
| (n=10, x±s) | |||||
| Group | Liver index(η/%) | Pathological score | |||
| Normal control | 1.30±0.38 | 0.68±0.03 | |||
| Model | 3.70±0.52* | 6.78±1.26* | |||
| Simvastatin | 2.10±0.30*△△ | 3.98±0.91*△△ | |||
| ZZDHT | |||||
| Low dose | 3.10±0.32*△ | 5.59±0.96*△ | |||
| High dose | 2.40±0.43*△△ | 4.31±0.84*△△ | |||
| *P < 0.01 compared with normal control group;△P < 0.05, △△P < 0.01 compared with model group. | |||||
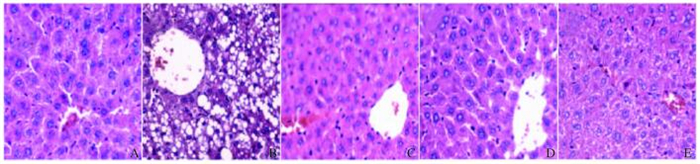
|
| A: Normal control group; B: Model group; C: Simvastatin group; D: High dose of ZZDHT group; E: Low dose of ZZDHT group. 图 1 各组大鼠肝组织病理形态表现(HE,×100) Figure 1 Pathomorphogy of liver tissue of rats in various groups(HE, ×100) |
|
|
AFL是一种临床中常见的肝病,具有普遍性,这种疾病前期无明显的临床症状,经常被患者忽视[9]。研究[10]显示:AFL是肝炎、肝硬化甚至肝癌等严重肝病的前兆,如不加以干预将严重威胁人类的身体健康。本研究通过对SD大鼠施行长期酒精刺激联合高脂饮食模拟人类AFL的病因,制备AFL大鼠模型,生理生化指标测定结果显示本研究模型稳定可靠、相关数据指标稳定有效。目前针对AFL的发病原因有很多不同的研究成果,其中主要包括脂质沉积[11]、酒精性肝损伤、炎症[12]、氧化损伤[10]和肠道菌群失调[13]等。由于AFL的疾病成因较为复杂,最新相关研究成果也较丰富,故本研究主要从脂质沉积、肝功能和炎症这3个方面来探讨栀子大黄汤对AFL的治疗作用。脂质沉积被认为是肝脏脂肪化的首要原因,多数脂肪肝患者存在血脂过高和肝损伤的情况。本研究结果显示:栀子大黄汤能明显降低AFL大鼠血清TC和TG水平,提示栀子大黄汤能明显降低大鼠肝脏脂肪性病变,同时也能减轻大鼠肝组织中ALT和AST水平,提示药物具有一定的保肝作用,相关药效作用的发挥可能依赖于大黄和栀子利胆退黄的药效作用。本研究结果显示:高剂量栀子大黄汤组能明显降低AFL大鼠血清IL-6、TNF-α和IL-1β水平,提示栀子大黄汤具有很好的抗炎作用,并且抗炎效果呈剂量依赖性。栀子大黄汤中的君药和臣药均含有黄酮和蒽醌类化合物,现代药理研究提示:这2种成分具有很好的抗炎效果,说明栀子大黄汤抗炎药效作用的发挥主要依赖于黄酮和蒽醌类化合物。
在机体中10%酒精随呼吸挥发,其余90%的酒精通过肝脏代谢,通过肝脏中相关的酶对酒精进行氧化分解,其中最主要的2种与酒精代谢相关的酶是ADH和ALDH[14-16]。本研究中模型组大鼠在长期灌胃酒精后,体内的ADH和ALDH水平明显升高,提示肝脏的解酒能力增强,负荷加大,长期酒精刺激容易促进肝细胞凋亡,造成肝损伤。高剂量栀子大黄汤组大鼠肝组织中ADH和ALDH的水平明显降低,提示栀子大黄汤能促进肝脏代偿性损伤的恢复,栀子大黄汤可能是通过保护肝细胞或增强酒精在肝脏中的代谢效率来降低血清和肝脏中ADH和ALDH水平。
本研究主要探讨了栀子大黄汤对AFL的保护作用,相关机制研究并未深入。栀子大黄汤中成分以黄酮和蒽醌类为主,现代药动学研究[4, 17]显示:这2种化学成分很少能被肠道吸收入血,栀子大黄汤的药效作用可能作用于肠道菌群,而肠道菌群失调可能是诱发AFL的主要原因之一,提示应进一步探究栀子大黄汤的提取物和分离的有效部位对AFL大鼠肠道菌群的影响。本研究结果为临床上拓展栀子大黄汤的应用提供了实验依据。
| [1] | 姜维, 侯疏影, 谷宏伟. 水飞蓟素对酒精性脂肪肝患者肝功能和血脂水平的影响[J]. 中国中医药科技, 2011(5): 376. |
| [2] | Gao B, Bataller R. Alcoholic liver disease:pathogenesis and new therapeutic targets[J]. Gastroenterology, 2011, 141(5): 1572–1585. DOI:10.1053/j.gastro.2011.09.002 |
| [3] | Sung H, Kim SW, Hong M, et al. Microbiota-based treatments in alcoholic liver disease[J]. World J Gastroenterol, 2016, 22(29): 6673–6682. DOI:10.3748/wjg.v22.i29.6673 |
| [4] | 唐峥, 尹然, 毕开顺, 等. 栀子大黄汤血清药物化学的初步研究[J]. 中草药, 2014, 45(23): 3377–3382. DOI:10.7501/j.issn.0253-2670.2014.23.004 |
| [5] | 陈科霖. 栀子大黄汤对ANIT诱导的肝内胆汁淤积大鼠的保护作用及其药效物质研究[D]. 沈阳: 沈阳药科大学, 2014. |
| [6] | 周琼. 小鼠急性肝损伤模型的建立及GSTA1分析[D]. 哈尔滨: 东北农业大学, 2012. |
| [7] | 陆新烈, 袁建芬, 徐建立, 等. 大黄酸对非酒精性脂肪性肝病大鼠肝脏病理组织学及超微结构变化的影响[J]. 中国中医药科技, 2013(5): 477–478. |
| [8] | 张超. 栀子柏皮汤对α-萘异硫氰酸酯致大鼠肝损伤的保护作用[J]. 时珍国医国药, 2013(8): 1862–1864. |
| [9] | Bailey SM, Cunningham CC. Contribution of mitochondria to oxidative stress associated with alcoholic liver disease[J]. Free Radical Bio Med, 2002, 32(1): 11–16. DOI:10.1016/S0891-5849(01)00769-9 |
| [10] | Wu D, Cederbaum AI. Oxidative stress and alcoholic liver disease[J]. Alcohol Health Res World, 1997, 21(4): 321–324. |
| [11] | Ezquer F, Bruna F, Calligaris SN, et al. Multipotent mesenchymal stromal cells:A promising strategy to manage alcoholic liver disease[J]. World J Gastroenterol, 2016, 22(1): 24–36. DOI:10.3748/wjg.v22.i1.24 |
| [12] | Tilg H, Moschen AR, Szabo G. Interleukin-1 and inflammasomes in alcoholic liver disease/acute alcoholic hepatitis and nonalcoholic fatty liver disease/nonalcoholic steatohepatitis[J]. Hepatology, 2016, 64(3): 25–28. |
| [13] | Park B, Lee HR, Lee YJ. Alcoholic liver disease:Focus on prodromal gut health[J]. J Digest Dis, 2016, 17(8): 184–195. |
| [14] | Rao R. Endotoxemia and gut barrier dysfunction in alcoholic liver disease[J]. Hepatology, 2009, 50(2): 638–644. DOI:10.1002/hep.23009 |
| [15] | Albano E. Oxidative mechanisms in the pathogenesis of alcoholic liver disease[J]. Mol Aspects Med, 2008, 29(1): 9–16. |
| [16] | Zintzaras E, Stefanidis I, Santos M, et al. Do alcohol-metabolizing enzyme gene polymorphisms increase the risk of alcoholism and alcoholic liver disease?[J]. Hepatology, 2006, 43(2): 352–361. DOI:10.1002/hep.v43:2 |
| [17] | 李欣昕, 陈林飞, 欧阳永中, 等. 栀子大黄汤对酒精性肝损伤保护作用的质谱评价[J]. 中国药科大学学报, 2015, 28(5): 579–586. DOI:10.11665/j.issn.1000-5048.20150511 |
| [18] | 范建高, 颜士岩. 代谢综合征与脂肪肝[J]. 临床肝胆病杂志, 2016, 32(3): 407–410. |
 2017, Vol. 43
2017, Vol. 43


