扩展功能
文章信息
- 方艳秋, 米旭光, 李首庆, 魏海峰, 许淑芬, 谭岩
- FANG Yanqiu, MI Xuguang, LI Shouqing, WEI Haifeng, XU Shufen, TAN Yan
- 重组鼠白细胞介素18在肝癌小鼠体内的抗肿瘤作用
- Anti-tumor effect of rmIL-18 in mice with hepatocellular carcinoma
- 吉林大学学报(医学版), 2017, 43(03): 550-554
- Journal of Jilin University (Medicine Edition), 2017, 43(03): 550-554
- 10.13481/j.1671-587x.20170317
-
文章历史
- 收稿日期: 2017-01-15
白细胞介素18(interleukin-18, IL-18) 主要由活化的巨噬细胞产生,是细胞因子网络中的重要成员,IL-18能将NK细胞、吞噬细胞介导的非特异性免疫与Th、Tc细胞介导的特异性免疫有机地结合起来,从而在增强免疫、抗肿瘤和抗感染等方面发挥重要的作用[1-3]。在体内抗肿瘤研究中,重组IL-18应用的途径、剂量、时机存在较大差异,并且抗肿瘤的效果也差异较大[4-9]。因此,明确应用IL-18抗肿瘤的最佳途径对于未来临床应用具有重要的理论支持价值。本课题组[10]前期应用重组鼠白细胞介素18(recombinant mouse interleukin-18, rmIL-18) 在体外培养系统(coculture systerm in vitro,CCs)中诱导出肿瘤特异性细胞毒性T淋巴细胞(cytotoxic T lymphocyte,CTL),并且这种CTL输入小鼠体内具有抗肿瘤活性,但是体内直接应用IL-18与CTL之间抗肿瘤效果的差异尚未见报道。本文作者探讨不同剂量和输注方式的rmIL-18对荷肝癌小鼠生存时间和肿瘤生长的影响,阐明rmIL-18在体内抗肿瘤的合理应用方式,为进一步应用IL-18治疗肿瘤提供实验依据。
1 材料与方法 1.1 细胞株和实验动物Babl/C小鼠肝细胞癌H22细胞株由本科经小鼠腹腔传代培养。90只Babl/C小鼠,雌性,6~8周龄,体质量20~25 g,购自生物制品研究所动物部,动物许可证号:201400015436。
1.2 主要试剂和仪器抗CD11b CMac-1、抗CD45R(B220)、抗髓样分化抗原(Gr-1)、抗红细胞样细胞(TER119)、抗红细胞样细胞(TER119)、抗CD22、抗F4/80、抗CD5ccy-1、抗髓样分化抗原(Gr-1)、抗CD2、抗CD3、抗CD45R(B220)、抗髓样分化抗原(Gr-1)、抗中性粒细胞抗原(7/4) 和抗红细胞样抗原(TER119) 单克隆抗体均购于美国StemColl Technologies公司。rmIL-18为本实验室制备。FORMA Ⅱ型CO2培养箱和1300 Series A2型超净细胞工作台均购自美国Thermo公司,DMI3000型荧光倒置显微镜购自德国Leica公司,TP-114型电子分析天平购自德国赛多利斯公司。
1.3 CCs中rmIL-18诱导肿瘤特异性CTL将丝裂霉素(MMC,100 mg·L-1)处理1 h的H22细胞按2%的比例加入CCs(分离纯化的小鼠脾脏NK细胞、T细胞及DCs按一定的细胞比例加入培养系统,其中NK细胞为16.5%、T细胞为82.7%、DCs为0.8%),再加入0.1 mg·L-1 rmIL-18,于37℃、5%CO2条件下培养96 h后收集细胞,作为rmIL-18诱导的肿瘤特异性CTL。
1.4 皮下接种肝癌H22细胞小鼠模型构建和生存率检测为观察皮下接种(右前肋)肝癌H22细胞对小鼠生存时间的影响,将30只Balb/C小鼠随机分为3组,分别接种5×105、1×106和2×106个肝癌H22细胞,记录小鼠生存时间,生存率采用SPSS 19.0统计软件中Kaplan-Meier乘积限法分析。
1.5 动物分组和给药方式将60只接种1×106个肝癌H22细胞的Babl/C小鼠随机分为6组,每组10只,分别为5μg rmIL-18腹腔内注射治疗组、0.5μg rmIL-18腹腔内注射治疗组、0.5μg rmIL-18肿瘤内注射治疗组、CTL腹腔内注射治疗组和CTL肿瘤内注射治疗组和生理盐水腹腔注射对照组。从接种肿瘤的第10天起,各组小鼠每隔1d进行注射治疗,共计10次。5μg rmIL-18腹腔内注射治疗组和0.5μg rmIL-18腹腔内注射治疗组小鼠每次腹腔内注射5和0.5μgrmIL-18,0.5μg rmIL-18肿瘤内注射治疗组小鼠每次肿瘤内注射0.5μg rmIL-18,CTL腹腔内注射治疗组和CTL肿瘤内注射治疗组小鼠分别腹腔及肿瘤内注射肿瘤特异性CTL(1×106个/只),生理盐水腹腔注射对照组小鼠通过腹腔内注射注射等体积(100 μL)生理盐水。每周测量各组小鼠肿瘤直径,并记录生存时间。小鼠动物肿瘤直径的测量方法(皮下荷瘤模型):肿瘤直径(mm)=(肿瘤最长直径+肿瘤最短直径)/2。
1.6 统计学分析采用SPSS 19.0统计软件进行统计学分析。各组小鼠的生存时间、肿瘤生长速度和肿瘤直径以x±s表示,组间两两比较采用t检验,多组比较采用完全随机设计的单因素方差分析。以α=0.05为检验水准。
2 结果 2.1 皮下接种H22细胞小鼠存活率接种5×105、1×106和2×106个H22细胞。皮下接种1×106个肿瘤细胞的小鼠平均生存时间为(39.0±6.6) d,半数致死期为35 d;皮下接种1×106个细胞最适合观察IL-18的治疗效果,且能区别因操作失误而引起的小鼠死亡。见图 1。
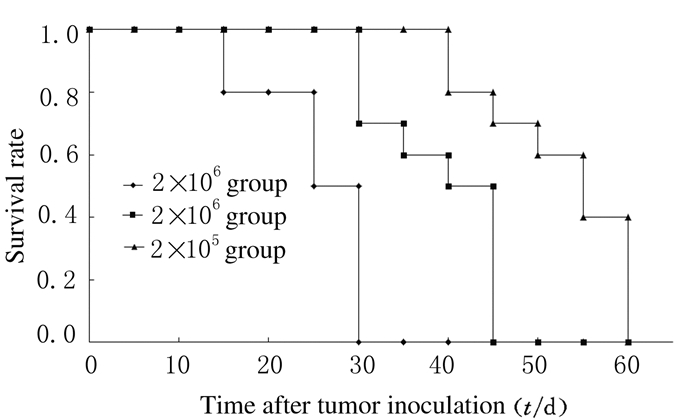
|
| 图 1 皮下接种肝癌H22细胞后各组小鼠存活率 Figure 1 Survival rates of mice inoculated subcutaneously with hepatocarcinoma H22cells in various groups |
|
|
与生理盐水腹膜注射对照组比较,各剂量rmIL-18给药组荷瘤小鼠肿瘤体积减小(P < 0.05);在相同的输入途径下,5μg rmIL-18腹腔内注射治疗组荷瘤小鼠的肿瘤体积小于0.5μg rmIL-18腹腔内注射治疗组(P < 0.01);在同等剂量rmIL-18作用下,0.5μg rmIL-18肿瘤内注射治疗组荷瘤小鼠肿瘤体积小于0.5μg rmIL-18腹腔内注射治疗组(P < 0.05)。见图 2。
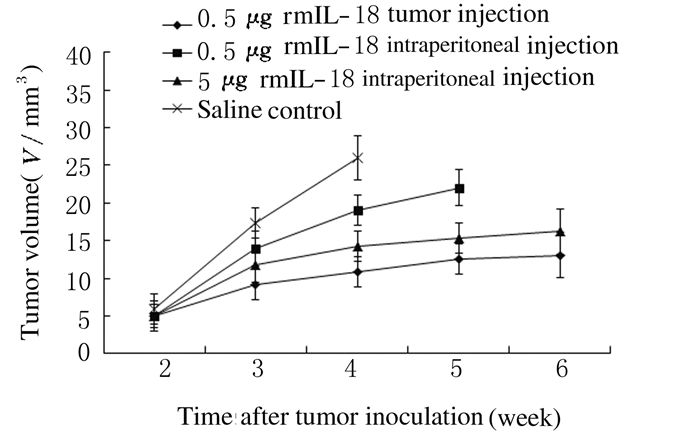
|
| 图 2 各组荷瘤小鼠的肿瘤体积 Figure 2 Tumor volumes of tumor-bearing mice in various groups |
|
|
与生理盐水腹腔注射对照组比较,各剂量rmIL-18给药均能提高荷瘤小鼠的存活率(P < 0.01);在相同的输入途径下,5μg rmIL-18腹腔内注射治疗组荷瘤小鼠存活率明显高于0.5μg rmIL-18腹腔内注射治疗组(P < 0.01);在同等剂量rmIL-18作用下,0.5μg rmIL-18肿瘤内注射治疗组荷瘤小鼠的存活率明显高于0.5μg rmIL-18腹腔内注射治疗组(P < 0.05)。见图 3。
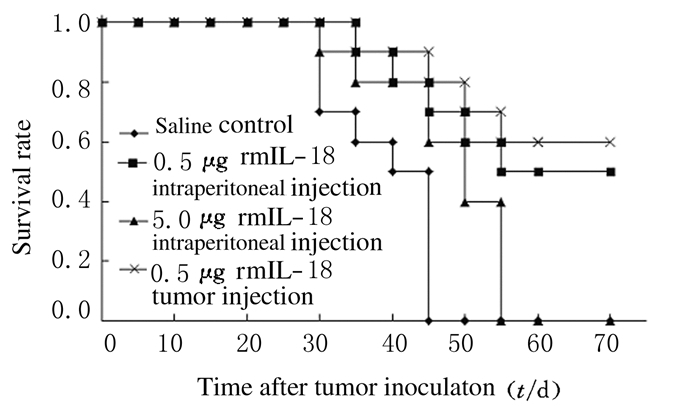
|
| 图 3 各组荷瘤小鼠的存活率 Figure 3 Survival rates of tumor-bearing mice in various groups |
|
|
荷瘤后第4周测量各组小鼠肿瘤体积,rmIL-18组或CTL组荷瘤小鼠的肿瘤体积明显小于生理盐水腹膜注射对照组(P < 0.01);CTL腹腔内注射治疗组荷瘤小鼠的肿瘤体积明显小于0.5μg rmIL-18腹腔内注射治疗组(P < 0.01);CTL肿瘤内注射治疗组荷瘤小鼠的肿瘤体积明显小于0.5μg rmIL-18肿瘤内注射治疗组(P < 0.01);各rmIL-18组和CTL组组内比较,肿瘤内注射治疗荷瘤小鼠的肿瘤体积均明显小于腹腔内注射治疗组(P < 0.05)。见图 4。
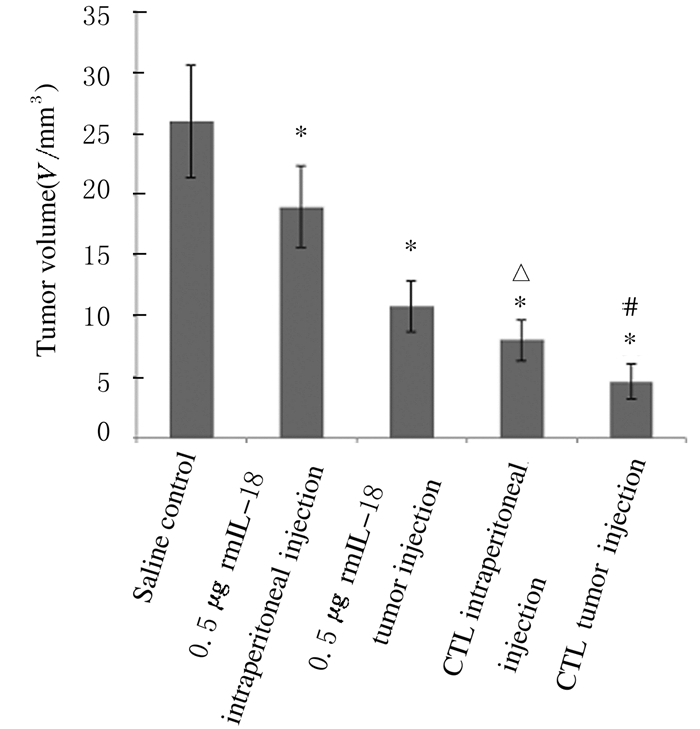
|
| *P < 0.01 vs saline control group; △P < 0.01 vs 0.5 μg rmIL-18 intraperitoneal injection group; #P < 0.01 vs 0.5μg rmIL-18 tumor injection group. 图 4 各组荷瘤小鼠的肿瘤体积 Figure 4 Tumor volumes of tumor-bearing mice in various groups |
|
|
与生理盐水腹腔注射对照组比较,各rmIL-18组和CTL组荷瘤小鼠的存活率均明显升高(P < 0.01);与0.5μg rmIL-18腹腔内注射治疗组比较,CTL腹腔内注射治疗组荷瘤小鼠的存活率明显升高(P < 0.01);与0.5μg rmIL-18肿瘤内注射治疗组比较,CTL肿瘤内注射治疗组荷瘤小鼠的存活率明显升高(P < 0.01);rmIL-18组和CTL组中,与腹腔内注射治疗比较,肿瘤内注射治疗荷瘤小鼠的存活率明显升高(P < 0.05)。见图 5。
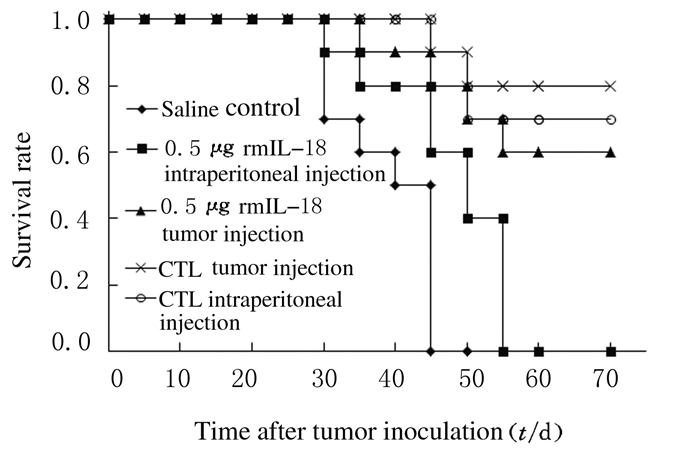
|
| 图 5 各组荷瘤小鼠的存活率 Figure 5 Survival rates of tumor-bearing mice in various groups |
|
|
IL-1家族的成员IL-18是促炎和免疫调节因子,其最初被鉴定为T细胞和NK细胞中的IFN-γ诱导因子,参与Th1应答。巨噬细胞、DC、小胶质细胞、滑膜成纤维细胞和上皮细胞等均可表达无活性前体pro-IL-18,最终pro-IL-18经过Casp1酶促加工成熟[11-13]。
IL-18具有刺激淋巴细胞活化的作用,能激活NK和CTL等细胞毒性细胞,促进其功能的成熟和增殖,有效杀伤肿瘤细胞。IL-18还能诱导FasL/Fas表达,诱导肿瘤细胞凋亡,且IL-18还是一种血管生成抑制剂,可通过特异性地抑制血管内皮细胞形成而抑制肿瘤的生长[3]。Lewis肺癌细胞株LLC[5]、C6胶质瘤细胞[8]和小鼠卵巢癌细胞OVHM[14]转染IL-18基因后,体内致瘤性均明显下降。IL-18还可以显著改善抗肿瘤药物的时间依赖性,增强化疗药物的杀灭率,并延长生存时间[15]。在小鼠体内,重组IL-18对多种异种移植肿瘤的生长具有抑制作用,并能延长荷瘤小鼠的生存时间。然而,重组IL-18抑瘤作用效果存在较大差异,特别是在裸鼠体内其抑瘤作用较弱[4-9]。产生这种现象原因,一方面是因为IL-18抗肿瘤存在多种途径,且主要依靠其他免疫细胞的激活发挥作用;另一方面,在各实验中IL-18给药途径以及用量存在较大差异,造成抗肿瘤效果差异较大。
本研究首先比较了不同剂量rmIL-18抗肿瘤作用,发现rmIL-18对荷瘤小鼠的肿瘤生长速度的抑制作用及小鼠存活率的升高均随着应用剂量的增大而增加,说明rmIL-18抗肿瘤存在剂量依赖性。另外,相同剂量条件下,肿瘤内应用rmIL-18较腹腔内应用的抗肿瘤效果好。本课题组前期采用rmIL-18在体外培养系统中诱导出CTL,并且这种CTL输入小鼠体内可发挥抗肿瘤作用。IL-18既能诱导特异性的CTL,又能促进IFN-γ、IL-2、DM-CSF和TNF-α等抗肿瘤细胞因子的产生和分泌[16-19],但其抗肿瘤作用是否优于CTL尚未明确本课题组比较了rmIL18与CTL体内抗肿瘤作用差异发现:直接输入肿瘤特异性CTL的抗肿瘤效果优于应用rmIL-18。这一结果并不能否定IL-18在体内的抗肿瘤作用,可能因为rmIL-18应用的剂量与输入肿瘤特异性CTL细胞量之间的不对等,本研究中rmIL-18应用的剂量较小。另一方面,荷瘤鼠体内存在免疫抑制因素,肿瘤细胞表面的IL-18结合蛋白拮抗了IL-18部分功能。
综上所述,肿瘤内注射rmIL-18可以发挥其最佳的抗肿瘤作用,并存在剂量依赖性。体内直接应用rmIL-18可有效避免体外诱导肿瘤特异性CTL所需的肿瘤特异性抗原难于寻找的问题,为肿瘤免疫治疗提供了新思路。
| [1] | Huang CC, Kuo KK, Cheng TC, et al. Development of membrane-bound GM-CSF and IL-18 as an effective tumor vaccine[J]. PLoS One, 2015, 10(7): 1–13. |
| [2] | Liu W, Hu M, Wang Y, et al. Overexpression of interleukin-18 protein reduces viability and induces apoptosis of tongue squamous cell carcinoma cells by activation of glycogen synthase kinase-3β signaling[J]. Oncol Rep, 2015, 33(3): 1049–1056. |
| [3] | 吕雨虹, 陈庆, 赵娟, 等. 转染白细胞介素18基因通过下调多药耐药基因表达增强顺铂对C6胶质瘤细胞毒作用[J]. 中国现代医学杂志, 2016, 26(10): 20–24. DOI:10.3969/j.issn.1005-8982.2016.10.005 |
| [4] | 宋杨英, 张建军, 程天军. IL-18基因转染对大鼠胶质瘤体内生长及肿瘤细胞凋亡的影响[J]. 河北北方学院学报:自然科学版, 2016, 42(2): 11–15. |
| [5] | 杨升, 卢辉山, 陈湘琦, 等. 白细胞介素-18对Lewis肺癌小鼠移植瘤生长及移植瘤细胞凋亡的作用[J]. 肿瘤防治研究, 2009, 28(7): 563–565. |
| [6] | 陈湘琦, 林挺岩, 李志鹰, 等. IL-18对Lewis肺癌小鼠移植瘤生长的抑制作用[J]. 现代肿瘤医学, 2008, 16(9): 1458–1459. |
| [7] | 刘炜炜, 嵇菲, 宋立巍, 等. IL-18对人舌癌移植瘤的抑制作用[J]. 吉林医学, 2011, 32(20): 4070–4072. DOI:10.3969/j.issn.1004-0412.2011.20.003 |
| [8] | 李文玲, 赵文清, 周娜静, 等. 外源性IL-18基因对C6胶质瘤细胞体内致瘤抑制作用[J]. 细胞生物学杂志, 2008, 30(1): 95–99. |
| [9] | 杨广民, 段秀梅, 李首庆, 等. 联合应用MAGE-1与IL-18基因疫苗体外抗肝癌作用的实验研究[J]. 中国现代医学, 2011, 21(31): 3872–3875. DOI:10.3969/j.issn.1005-8982.2011.31.007 |
| [10] | 方艳秋, 谭岩, 段秀梅, 等. IL-18在体外培养系统中诱导肿瘤快速杀伤效应及肿瘤特异性CTL[J]. 免疫学杂志, 2004, 20(4): 251–255. |
| [11] | Fabbi M, Carbotti G, Ferrini S. Context-dependent role of IL-18 in cancer biology and counter-regulation by IL-18BP[J]. J Leukoc Biol, 2015, 97(4): 665–675. DOI:10.1189/jlb.5RU0714-360RR |
| [12] | Stegmann KA, De Souza JB, Riley EM. IL-18-induced expression of high-affinity IL-2R on murine NK cells is essential for NK-cell IFN-γ production during murine Plasmodium yoelii infection[J]. Eur J Immunol, 2015, 45(12): 3431–3440. DOI:10.1002/eji.201546018 |
| [13] | 陈吉泉. IL-18及其抗肿瘤作用[J]. 国外医学:免疫学分册, 2000, 24(4): 239–242. |
| [14] | 崔潋, 郝淑维, 李新伟, 等. IL-18基因转染对小鼠卵巢癌OVHM体外增殖及体内成瘤的影响[J]. 细胞与分子免疫学杂志, 2008, 24(6): 577–580. |
| [15] | Alagkiozidis I, Facciabene A, Tsiatas M, et al. Time-dependent cytotoxic drugs selectively cooperate with IL-18 for cancer chemo-immunotherapy[J]. J Transl Med, 2011, 9(77): 1–12. |
| [16] | Shen YP, Lin SI, Chen IH, et al. A HLA-A2-restricted CTL epitope induces anti-tumor effects against human lung cancer in mouse xenograft model[J]. Oncotarget, 2016, 7(1): 671–683. |
| [17] | Wang Y, Xu Z, Zhou F, et al. The combination of dendritic cells-cytotoxic T lymphocytes/cytokine-induced killer (DC-CTL/CIK) therapy exerts immune and clinical responses in patients with malignant tumors[J]. Exp Hematol Oncol, 2015, 4(32): 1–12. |
| [18] | Markowitz GJ, Yang P, Fu J, et al. Inflammation-dependent IL18 signaling restricts hepatocellular carcinoma growth by enhancing the accumulation and activity of tumor-infiltrating lymphocytes[J]. Cancer Res, 2016, 76(8): 2394–2405. DOI:10.1158/0008-5472.CAN-15-1548 |
| [19] | 郝明志, 林海澜, 陈起忠, 等. 重组人血管内皮抑制素联合肝动脉介入治疗对中晚期肝癌无疾病进展生存期的影响[J]. 临床肝胆病杂志, 2016, 32(1): 92–96. |
 2017, Vol. 43
2017, Vol. 43


