扩展功能
文章信息
- 贾雪巍, 董金香, 于洋, 位鸿, 王畅, 贾艾玲
- JIA Xuewei, DONG Jinxiang, YU Yang, WEI Hong, WANG Chang, JIA Ailing
- 灵芝菌液体发酵人参茎叶总皂苷化学成分变化及其抗肿瘤活性
- Changes of chemical components and anti-tumor activity of total ginsenosides from ginseng stems and leaves tranformed by submerged fermentation of ganoderma lucidum
- 吉林大学学报(医学版), 2017, 43(03): 543-549
- Journal of Jilin University (Medicine Edition), 2017, 43(03): 543-549
- 10.13481/j.1671-587x.20170316
-
文章历史
- 收稿日期: 2017-01-12
2. 长春中医药大学药学院药剂与炮制 教研室, 吉林 长春 130117;
3. 长春中医药大学附属医院新药中心, 吉林 长春 130117
2. Teaching and Research Office of Pharmacy and Concocted, School of Pharmacy, Changchun University of Chinese Medicine, Changchun 130117, China;
3. New Drug Research and Development Center, Affiliated Hospital, Changchun University of Chinese Medicine, Changchun 130117, China
人参茎叶总皂苷为五加科植物人参(Panax ginseng C.A.Mey.)的干燥茎叶经加工制成的总皂苷[1],具有补元气、生津止渴和安神补脑等功效。现代药理和临床研究[2-3]证明:人参茎叶总皂苷具有人参的主要生理活性,其中人参稀有皂苷具有显著的抗肿瘤活性。人参皂苷Rg3能够在低氧状态下抑制人肝癌细胞中血管内皮生长因子(vascular endothelial growth factor,VEGF)的表达,从而抑制肿瘤细胞的增殖[4]。Yoon等[5]证实:人参皂苷Rh1能通过抑制激活蛋白酶1的活性抑制人肝癌细胞中基质金属蛋白酶的表达。Oh等[6]在研究人参皂苷(CK)诱导细胞凋亡的机制时发现:人参皂苷CK能促进细胞色素C的释放,形成凋亡循环。灵芝是担子菌纲多孔菌科灵芝属真菌赤芝或紫芝的干燥子实体[1],灵芝属的子实体、菌丝体和孢子中含有多糖类、核苷类、生物碱类、三萜类、脂肪酸和氨基酸类等成分[7-8]。Masuko等[9]发现:灵芝菌丝体中的9,11-DHEP可以通过诱导细胞周期蛋白依赖激酶从而抑制激活蛋白酶1的表达,诱导人结肠癌HT29细胞的凋亡。Cheung等[10]发现:灵芝提取物能抑制小鼠嗜铬细胞瘤PC12细胞增殖,并促其分化。目前,国内外未见有关灵芝菌种发酵人参茎叶总皂苷的文献报道。本课题组[11]前期以灵芝为发酵菌株、人参为药性基质进行双向固体发酵获得参灵菌质,既保留了人参和灵芝固有的有效成分,又使人参中稀有皂苷Rg3及Rh1水平明显升高。朱凯等[12]观察人参药性菌质对小鼠Lewis肺癌的抑制影响认为:人参药性菌质在体内具有抗小鼠肺癌LLC细胞成瘤的作用。本研究以人参茎叶总皂苷为底物,与灵芝菌种进行液体发酵,并与使用人参茎叶药材做底物相比较,该方法不仅可以降低成本,还能缩短人参皂苷转化为稀有人参皂苷的时间,尽可能地减少发酵过程中原有效成分的损失,根据发酵前后人参皂苷Rg1、Re、Rb1、Rd、CK、Rg3和Rh1水平变化,研究药效成分的生物转化规律,并初步探讨灵芝菌液体发酵人参茎叶总皂苷的药效物质基础。
1 材料与方法 1.1 菌株、细胞株、主要试剂和仪器灵芝菌株(Ganoderma lucidum)购于中国普通菌种保藏中心(CICC 14002),于长春中医药大学中药药剂实验室进行传代保存。人肝癌SMMC-7721细胞株购于中国科学院上海细胞研究所。人参茎叶和人参茎叶总皂苷(批号:130502,纯度≥98%)购于吉林省宏久生物科技股份有限公司,人参茎叶经长春中医药大学药学院鉴定为五加科植物人参的干燥茎叶;人参皂苷Rg1对照品(批号:110703-201529)、人参皂苷Rb1对照品(批号:110704-201424)、人参皂苷Re对照品(批号:110754-201525)、人参皂苷RO对照品(批号:111903-201303) 和人参皂苷Rd对照品(批号:111818-201302) 购于中国食品药品检定研究院;人参皂苷CK对照品、人参皂苷Rg3和人参皂苷Rh1对照品(纯度≥98%)购于成都曼思特生物科技有限公司;琼脂粉购于天津市光复精细化工研究所;葡萄糖购于北京化工厂;酵母粉和蛋白胨购于北京奥博星生物技术有限责任公司;硫酸镁购于天津市津北精细化工有限公司;磷酸二氢钾购于西陇化工股份有限公司;胎牛血清、青霉素-链霉素溶液和DMEM购于美国Gibco公司;四甲基偶氮唑盐(MTT)购于美国Sigma公司;二甲基亚砜(DMSO)购于天津市博迪化工有限公司;PBS磷酸盐缓冲剂(粉剂)购于北京鼎国昌盛生物技术有限公司;胰蛋白酶(干粉)购于美国Hylone公司;乙二胺四乙酸(EDTA)购于美国Amresco公司;甲醇和乙腈(色谱纯)购于美国Fisher公司;水为超纯水;其他试剂均为国产分析纯。Agilent 1260高效液相色谱仪购于美国Agilent公司,DNP-908ZBS-Ⅲ电热恒温培养箱购于济南博鑫生物技术有限公司,HYC-回转式恒温调速摇瓶机购于上海新苗医疗器械制造有限公司,01J2003-04型立式压力蒸汽灭菌器桶购于上海东亚压力容器制造有限公司,LC-15C型高效液相色谱仪购于日本岛津公司,DZF-6050型真空干燥箱购于上海一恒实验仪器总厂,KQ-500B型超声波清洗器购于昆山市超声仪器有限公司,EL-204型电子分析天平购于梅特勒-托利多国际贸易(上海)有限公司,TG328A(S)分析天平购于上海精科分析仪器厂,UV-9200紫外可见分光光度计购于北京瑞利分析仪器公司,DK-420型电热恒温水槽购于上海精宏实验设备有限公司,SW-CJ-IFDA超净工作台购于苏州安泰空气技术有限公司,BB16/BBSO60型CO2培养箱购于德国Heraus公司,X-70荧光倒置相差显微镜购于德国Leica公司,imark酶标仪购于美国Bio-Rad公司,LD4-2A离心机购于北京医用离心机厂。
1.2 人参茎叶药性菌质的制备按葡萄糖2%、KH2PO4 0.1%、MgSO4 0.1%、蛋白胨0.5%、酵母粉0.2%的配方比,pH自然,于121℃、高压灭菌30 min。接入灵芝斜面菌种,置摇床上,150 r·min-1、(28±1)℃培养7d,即得种子液。取9.0 g人参茎叶总皂苷粉末和0.45 g碳酸钙,加入30 mL去离子水溶解,混匀,121℃、高压灭菌30 min,即得液体培养基。将制备好的摇瓶种子液,接种至液体培养基中,置于摇床上,150 r·min-1、(28±1)℃避光培养,发酵至84 h取出,干燥、粉碎即得人参茎叶药性菌质样品。
1.3 人参茎叶药性菌质成分的检测 1.3.1 人参皂苷Rg1、Re、Rb1、Rd、Rg3、CK、RO和Rh1的薄层鉴别对照品溶液的制备:取人参皂苷Rg1、Re、Rb1、Rd、Rg3、CK、Ro和Rh1对照品,加入甲醇溶解制成0.2 g·L-1溶液,作为对照品溶液。供试品溶液的制备:取0.5 g人参茎叶药性菌质粉末(过60目筛),置于100 mL具塞锥形瓶内,加入50 mL甲醇,超声处理(功率250 W,频率50 kHz)30 min,冷却,补足失重,滤过,取续滤液,即得人参茎叶药性菌质供试品溶液;取0.1 g人参茎叶总皂苷,加入10 mL甲醇使溶解,即得人参茎叶总皂苷供试品溶液[1];取1 g人参茎叶药材粉末,加入100 mL水,煎煮2 h,干燥滤器滤过,滤液通过D101型大孔吸附树脂柱(内径为1 cm,柱高为15 cm),水洗至无色,再用体积分数为60%的乙醇20 mL洗脱,收集洗脱液,蒸干,残渣加入10 mL甲醇使溶解,即得人参茎叶药材供试品溶液[1];取1 g人参药材粉末,加入40 mL三氯甲烷,加热回流1 h,弃去三氯甲烷液,药渣挥干溶剂,加水0.5 mL搅拌湿润,加入10 mL水饱和正丁醇,超声处理(功率250 W,频率50 kHz)30 min,取上清液,加3倍量氨试液,摇匀,静置分层,收集上层液,蒸干,残渣加1 mL甲醇使充分溶解,即得人参药材供试品溶液[1]。测定方法:采用薄层色谱法,吸取上述溶液各2 μL,分别点于同一已活化的硅胶G薄层板上,以三氯甲烷-乙酸乙酯-甲醇-水(15:40:22:10) 的下层溶液(10℃以下放置)为展开剂,展开,取出,晾干,10%硫酸乙醇溶液显色,105℃均匀加热至斑点显色清晰,分别置于日光和紫外光灯(365 nm)下检视[1]。
1.3.2 人参茎叶总皂苷水平分析对照品溶液的制备:精密称量5.01 mg人参皂苷Re对照品,加入甲醇溶解定容至25 mL,即得质量浓度为0.200 4 g·L-1的对照品溶液。
标准曲线的绘制:精密吸取对照品溶液200、300、400、500、600、700、800和900 μL分别置于具塞试管中,低温挥去溶剂,加入1%香草醛高氯酸溶液0.5 mL,置于60℃恒温水浴上充分混匀后加热15 min,立即用冷水冷却2 min,加入77%硫酸溶液5 mL,摇匀;以相应试剂作为空白,采用紫外可见-分光光度法,在波长540 nm处测定吸光度(A)值,以A值作为纵坐标,溶液质量浓度作为横坐标绘制标准曲线[13]。供试品溶液的制备:精密称量25 mg人参茎叶总皂苷,置于25 mL容量瓶中,加入甲醇适量使溶解并定容,摇匀;精密称量25 mg人参茎叶药性菌质粉末(过60目筛),置于25 mL具塞锥形瓶中,称质量,加入甲醇10 mL超声处理(功率250 W,频率50 kHz)30 min,冷却,再次称质量,补足减失重量,摇匀,滤过,取续滤液即得。测定方法:精密吸取人参茎叶总皂苷溶液200 μL,人参茎叶药性菌质溶液300 μL,按照标准曲线制备方法测定A值,通过查得标准曲线的数据,即得总皂苷水平。
1.3.3 人参皂苷Rg1、Re、Rb1、Rd、CK、Rg3和Rh1水平测定对照品溶液的制备:精密称量5.06 mg人参皂苷Rg3对照品,加入甲醇溶解定容至25 mL,得到质量浓度为0.202 4 g·L-1的人参皂苷Rg3对照品溶液;精密称量5.02 mg人参皂苷CK对照品,加入甲醇溶解定容至25 mL,得到质量浓度为0.200 8 g·L-1的人参皂苷CK对照品溶液;分别精密称量5.02、5.06、5.09、5.08和5.01 mg的人参皂苷Rg1、Re、Rb1、Rd和Rh1对照品,加入甲醇溶解定容至25 mL,得到质量浓度分别为0.200 8、0.202 4、0.203 6、0.203 2和0.200 4g·L-1的人参皂苷Rg1、Re、Rb1、Rd和Rh1混合对照品溶液。供试品溶液的制备:精密称量25 mg人参茎叶总皂苷,置于25 mL量瓶中,加入甲醇溶解并稀释至刻度,滤过,取续滤液,即得到人参茎叶总皂苷供试品溶液;精密称量0.5 g人参茎叶药性菌质粉末(过60目筛),置于100 mL具塞锥形瓶中,加入甲醇50 mL超声处理(功率250 W,频率50 kHz)30 min,冷却,补足减失重,摇匀,滤过,取续滤液,即得人参茎叶药性菌质供试品溶液。色谱条件[14-15]:人参皂苷Rg3和人参皂苷CK的检测采用Agilent Zorbax SB-C18色谱柱,以乙腈为流动相A,以水为流动相B。人参皂苷Rg3流动相比例:0~40 min,40%流动相A,60%流动相B;柱温为30℃;流速为1.0 mL·min-1;检测波长为203 nm;进样量为10 μL。人参皂苷CK流动相比例:0~70 min,43%流动相A,57%流动相B,柱温为30℃;流速为1.0 mL·min-1;检测波长为203 nm;进样量为20 μL。人参皂苷Rg1、Re、Rb1、Rd和Rh1的检测采用Agilent Zorbax SB-C18色谱柱,以乙腈为流动相A,以0.4%磷酸水为流动相B,流动相梯度洗脱比例:0~35 min,19%流动相A,81%流动相B;35~55 min,19%~29%流动相A,55~70 min,29%流动相A,70~120 min,29%~49%流动相A,柱温为30℃;流速为1.0 mL·min-1;检测波长为203 nm;进样量为10 μL。
1.4 抗SMMC-7721细胞株的活性检测 1.4.1 溶液的配制DMEM完全培养液:取90%DMEM培养液、9%胎牛血清和1%双抗,混合均匀。置于4℃冰箱冷藏备用。PBS缓冲盐溶液:取0.5 gPBS磷酸盐缓冲剂,加入无菌水溶解定容至500 mL后置于4℃冰箱保存。EDTA溶液:取0.2 gEDTA粉末,加入PBS缓冲盐溶液溶解定容至100 mL后置于4℃冰箱冷藏备用。0.25%胰蛋白酶溶液:取2.5 g胰蛋白酶,加入PBS缓冲盐溶液1 000 mL,完全溶解后置于-20℃冰箱保存。MTT溶液:取250 mgMTT,溶于50 mLPBS缓冲盐溶液中,溶解完全,配成终浓度为5 g·L-1溶液,置于-20℃冰箱内避光冻存备用。试药的配置:分别精密称量1.25、2.50和5.00 mg人参茎叶总皂苷及1.25、2.50和5.00 mg人参茎叶药性菌质,加入DMSO助溶后用培养液稀释定容至250 mL,得到质量浓度分别为5、10和20 mg·L-1的人参茎叶总皂苷和人参茎叶药性菌质药液,0.22 μm微孔滤膜过滤除菌后备用。
1.4.2 MTT法检测SMMC-7721细胞株生长抑制率(IR)将SMMC-7721细胞株接种于DMEM培养液中,置于37℃、5%CO2、饱和湿度的培养箱中传代培养。取对数生长期细胞,经EDTA溶液打开细胞间隙,0.25%胰蛋白酶消化后,以5×104mL-1的密度接种于96孔细胞培养板中,每孔200 μL,细胞贴壁后,倾去培养液,每孔分别加入低、中和高浓度(5、10的20 mg·L-1)人参茎叶总皂苷(人参茎叶总皂苷组)及低、中和高浓度(5、10的20 mg·L-1)人参茎叶药性菌(人参茎叶药性菌质组)药液各100 μL,100 μL培养液组设为空白对照组,每组均设5个复孔,相同培养条件下继续培养48 h。48 h后每孔加入MTT(5 g·L-1)溶液20 μL,培养4 h后,弃去上清液,加入150 μL DMSO终止反应,震荡10 min,用酶标仪在490 nm处测定A值,并计算细胞的IR[16-18]。IR=(1-实验组A值/空白对照组A值)×100%。
1.4.3 细胞株生长曲线的测定将SMMC-7721细胞株接种于24孔细胞培养板上,每孔1 mL。置于37℃、5%CO2、饱和湿度条件下培养,培养12 h后,分别加入人参茎叶总皂苷及人参茎叶药性菌使最终质量浓度为5、10和20 mg·L-1,空白对照组加入DMEM培养液,在相同条件下继续培养。从接种时间算起,每隔12 h计数各组孔内细胞密度,计算平均值。每孔细胞计数2次,绘制细胞生长曲线,实验重复3次。
1.5 统计学分析采用SPSS17.0统计软件进行统计学分析。各组SMMC-7721细胞株的IR以x±s表示,组间比较采用t检验。以α=0.05为检验水准。
2 结果 2.1 人参茎叶药材、人参药材、人参茎叶药性菌质和对照品的薄层色谱鉴别人参茎叶药材、人参药材的色谱与对照品色谱相应的位置上,日光下显现相同颜色的斑点,紫外光下显现相同颜色的荧光斑点。人参茎叶药性菌质和对照品色谱相应的位置上,紫外光下斑点的颜色发生了变化。见图 1和2(插页二)。
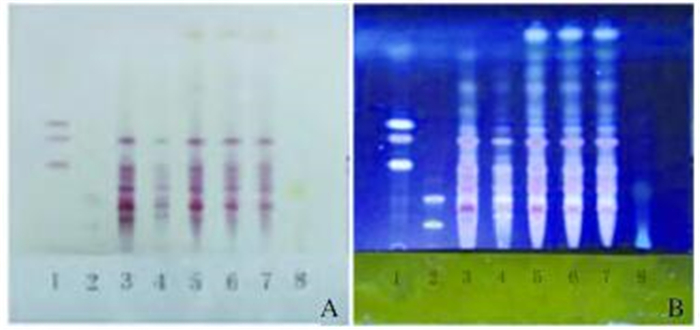
|
| Lane 1: Ginsenoside C K, Rhi and Rg: Lane 2 : Ginsenoside Rd and R o; Lane 3 : Ginseng stems and leaves; Lane 4 : Total ginsenosides from ginseng stems and leaves; Lane 5 — 7: Batch 20160420, 20160520, and 20140620; Lane 8 : Negative control. 图 1 日光下(A)和紫外灯下(B)人参茎叶药材、人参茎叶药性菌质和对照品色谱 Figure 1 Ginseng stems and leaves, medicinal fungus of ginseng stems and leaves and reference materials under daylight detection (A)an d U V lamp (B) |
|
|
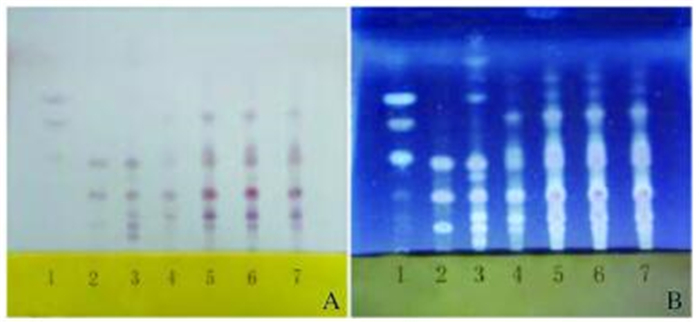
|
| Lane 1: Ginsenoside CK, Rhi and R gs; Lane 2: Ginsenoside R g i, Re and Rbi; Lane 3 : Ginseng; Lane 4 : Total ginsenosides from ginseng stems and leaves; Lane 5 —7 : Batch 20160420, 20160520, and 20140620. 图 2 日光下(A)紫外灯下(B)人参药材、人参茎叶药性菌质和对照品色谱 Figure 2 Ginseng, medicinal fungus of ginseng stems and leaves and reference materials under daylight detection (A) and U V lamp(B) |
|
|
人参茎叶总皂苷水平为749.98 mg·g-1,3批人参茎叶药性菌质样品中人参总皂苷的平均水平为602.26 mg·g-1,人参茎叶总皂苷经发酵后总皂苷水平降低了19.70%。将该水平下浮20%作为人参茎叶药性菌质的最低水平,即每克本品中人参总皂苷不得少于481.81 mg。
2.3 人参皂苷Rg1、Re、Rb1、Rd、CK、Rg3和Rh1的水平对3批人参茎叶药性菌质样品中的7种指标性成分进行测定,每份样品平行测定2份,7种成分水平见表 1。
| [wB/(mg·g-1)] | |||||||
| Sample | Rg3 | CK | Rb1 | Rd | Rg1 | Re | Rh1 |
| Total ginsenosides from ginseng stems and leaves | 2.21 | - | 24.54 | 87.22 | 77.02 | 151.34 | 3.06 |
| Fermentation product(20160601) | 7.59 | 2.67 | 9.32 | 117.19 | 27.30 | 54.78 | 15.39 |
| Fermentation product(20160602) | 7.59 | 2.69 | 9.15 | 117.28 | 27.53 | 54.91 | 15.64 |
| Fermentation product(20160603) | 7.30 | 2.68 | 9.91 | 117.25 | 27.40 | 54.89 | 15.71 |
| Average level of fermentation products | 7.49 | 2.68 | 9.46 | 117.24 | 27.41 | 54.86 | 15.58 |
| “-”:No data. | |||||||
发酵后人参二醇组皂苷中的人参皂苷Rb1水平降低了61.45%,Rg3水平增加了238.91%,Rd水平增加了34.43%,CK水平增加了268.00%;人参三醇组皂苷中的人参皂苷Re水平降低了63.75%,Rg1水平降低了64.41%,Rh1水平增加了408.88%。
2.4 SMMC-7721细胞株的IRSMMC-7721细胞作用48 h后,人参茎叶总皂苷和人参茎叶药性菌质均对细胞的增殖表现出不同程度的抑制作用。中剂量人参茎叶药性菌质组SMMC-7721细胞株的IR高于中剂量人参茎叶总皂苷组(P < 0.05), 高剂量人参茎叶药性菌质组SMMC-7721细胞株IR高于高剂量人参茎叶总皂苷组(P < 0.01)。与空白对照组比较,中剂量人参茎叶总皂苷组细胞IR升高(P < 0.05),高剂量人参茎叶总皂苷、中和高剂量人参茎叶药性菌质组细胞IR明显升高(P < 0.01);空白对照组细胞呈典型的指数增长,增殖速度较快;人参茎叶总皂苷对SMMC-7721细胞株增殖有抑制作用,人参茎叶药性菌质对SMMC-7721细胞株增殖抑制作用明显,两者均呈一定的时间和剂量依赖性。人参茎叶总皂苷发酵前后SMMC-7721细胞株的IR见表 2,SMMC-7721细胞株的生长曲线见图 3。
| (n=6, x±s) | |||
| Group | Drug concentration [ρB/(mg·L-1)] | A value | IR(η/%) |
| Blank control | 0 | 0.873±0.027 | 0 |
| Total ginsenosides from ginseng stems and leaves Low |
5 | 0.651±0.078 | 25.430±2.396 |
| Medium | 10 | 0.506±0.023* | 42.039±6.964* |
| High | 20 | 0.421±0.011** | 51.775±3.021** |
| Medicinal fungus of ginseng stems and leaves | |||
| Low | 5 | 0.606±0.062 | 30.584±4.318 |
| Medium | 10 | 0.372±0.065** | 57.388±2.683**△ |
| High | 20 | 0.239±0.043** | 72.623±3.132**# |
| *P < 0.05, **P < 0.01 compared with blank control group ; △P < 0.05 compared with medium dose of total ginsenosides from ginseng stems and leaves; #P < 0.01 compared with high dose of total ginsenosides from ginseng stems and leaves. | |||
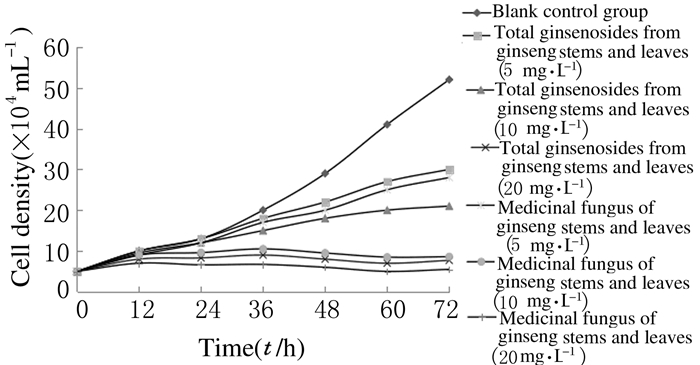
|
| 图 3 发酵前后各组SMMC-7721细胞株的生长曲线 Figure 3 Growth curves of SMMC-7721 cells in various groups before and after fermentation |
|
|
本研究采用灵芝菌种对人参茎叶总皂苷进行液体发酵,较人参茎叶药材发酵,节省了药材提取、分离和纯化等步骤,针对性更强,目的更明确。该发酵方法相当于药物化学的结构修饰过程,主要是为了在最短的时间内得到活性更强、更具有临床治疗功效的药效成分;与传统固体发酵方法比较,液体发酵技术生产周期短、产率高、生产过程容易控制,得到的发酵产物人参茎叶药性菌质质量稳定且提取分离更容易。
本研究采用薄层鉴别、紫外可见分光光度法和高效液相色谱法进行相关定性和定量鉴别研究显示:发酵后的人参茎叶总皂苷中人参总皂苷水平降低,人参皂苷中Rg1、Re和Rb1的水平呈总体降低趋势,而人参皂苷Rh1、Rd、Rg3和CK水平呈总体上升趋势,其中人参皂苷Rh1水平增幅最大,增加了408.88%。在发酵过程中,人参茎叶总皂苷中的皂苷类成分之间发生转化,稀有皂苷水平升高。采用MTT法以细胞IR为指标进行体外抗肿瘤活性实验,同时绘制人参茎叶总皂苷发酵前后的细胞生长曲线,人参茎叶总皂苷和人参茎叶药性菌质均对SMMC-7721细胞的增殖有不同程度的抑制作用,具有时间和剂量依赖性;与空白对照组比较,中剂量人参茎叶总皂苷组细胞IR升高,高剂量人参茎叶总皂苷、中和高剂量人参药性菌质细胞IR明显升高;中剂量人参茎叶药性菌质组SMMC-7721细胞株的IR高于中剂量人参茎叶总皂苷组, 高剂量人参茎叶药性菌质组SMMC-7721细胞株IR高于高剂量人参茎叶总皂苷组。发酵后产物的抗SMMC-7721细胞株活性增强,说明人参茎叶药性菌质中人参皂苷Rd、CK、Rg3和Rh1水平升高,可能具有较强的抗肿瘤活性,与其他皂苷成分可能具有良好的协同作用。
综上所述,以灵芝菌液体发酵人参茎叶总皂苷可明显改变其化学成分,得到抗肿瘤活性更佳的药效物质,人参茎叶药性菌质可作为新药研发的原料药,对进一步开发利用人参资源具有重要意义。
| [1] | 国家药典委员会. 中华人民共和国药典一部[S]. 北京: 中国医药科技出版社, 2015. |
| [2] | 沈映君. 中药药理学[M]. 北京: 人民卫生出版社,2000: 861-874. |
| [3] | Qiu S, Yang WZ, Shi XJ, et al. A green protocol for efficient discovery of novel natural compounds:Characterization of new ginsenosides from the stems and leaves of Panax ginseng as a case study[J]. Anal Chim Acta, 2015, 893: 65–76. DOI:10.1016/j.aca.2015.08.048 |
| [4] | Chen QJ, Zhang MZ, Wang LX. Gensenoside Rg3 inhibits hypoxia-induced VEGF expression in human cancer[J]. Cell Physiol Biochem, 2011, 26(6): 849–858. |
| [5] | Yoon JH, Choi YJ, Lee SG. Ginsenoside Rh1 suppresses matrix metalloproteinase-1 expression through inhibition of activator protein-1 and mitogen-activated protein kinase signaling pathway in human hepatocellular carcinoma cells[J]. Eur J Pharmacol, 2012, 679(1-3): 24–33. DOI:10.1016/j.ejphar.2012.01.020 |
| [6] | Oh SH, Lee BH. A ginseng saponin metabolite-induced apoptosis in HepG2 cells involves a mitochondria-mediated pathway and its downstream caspase-8 activation and Bid cleavage[J]. Toxicol Appl Pharm, 2004, 194(3): 221–229. DOI:10.1016/j.taap.2003.09.011 |
| [7] | Amdekar S. Ganoderma lucidum (Reishi):source of pharmacologically active compounds[J]. Curr Sci, 2016, 111(6): 976–978. |
| [8] | Zhang XQ, Pang GL, Cheng Y, et al. Chemical constituents of the spores of Ganoderma lucidum[J]. Zhong Yao Cai, 2008, 31(1): 41–44. |
| [9] | Masuko K, Mitsuru Y, Mayumi OK, et al. 5α, 8α-epidioxy-22E-ergosta-6, 9(11), 22-trien-3β-ol from an edible mushroom suppresses growth of HL60 leukemia and HT29 colon adenocarcinoma cells[J]. Biol Pharm Bull, 2006, 29(4): 755–759. DOI:10.1248/bpb.29.755 |
| [10] | Cheung WM, Hui WS, Chu PW, et al. Ganoderma extract activates map kinases and induces the neuronal differentiation of rat pheochromocytoma PC12 cells[J]. FEBS Lett, 2000, 486(3): 291–296. DOI:10.1016/S0014-5793(00)02317-6 |
| [11] | 王洪峰, 朱凯, 田健, 等. 人参双向固体发酵过程中化学成分的变化[J]. 吉林农业大学学报, 2013, 35(3): 312–316. |
| [12] | 朱凯, 贾艾玲, 徐瑶, 等. 人参药性菌质对小鼠Lewis肺癌的作用[J]. 中国老年学杂志, 2013, 33(23): 5882–5883. |
| [13] | 高丽萍, 刘华, 封云芳, 等. 人参总皂苷的含量测定[J]. 浙江工程学院学报, 2002, 19(3): 171–174. |
| [14] | 孙晓慧. 中药学人参药性菌质指纹图谱的研究[D]. 长春: 长春中医药大学, 2013. |
| [15] | 胡杰, 秦雪梅, 郭小青, 等. HPLC-ELSD法测定人参茎叶中人参皂苷Rg1、Re、Rd的含量[J]. 山西医科大学学报, 2008, 39(12): 1095–1098. DOI:10.3969/j.issn.1007-6611.2008.12.013 |
| [16] | Hwa YJ, Yona K, Hyung WP, et al. The unreliability of MTT assay in the cytotoxic test of primary cultured clioblastoma cells[J]. Exp Neurol, 2015, 24(3): 235–245. |
| [17] | Chang HC, Huang YC, Wen CH. Antiproliferative and chemopreventive effects of adlay seed on lung cancer in vitro and in vivo[J]. J Agr Food Chem, 2003, 51(12): 2656–3660. |
| [18] | Benoit GG, Naud CF, Simard MA, et al. Noninterference of cytochrome P4501A2 in the cytotoxicity of tacrine using genetically engineered V79 Chinese hamster cells for stable expression of the human or rat isoform and two human hepatocyte cell linese[J]. Biochem Pharmacol, 1997, 53(3): 423–427. DOI:10.1016/S0006-2952(96)00713-7 |
 2017, Vol. 43
2017, Vol. 43

