扩展功能
文章信息
- 朱文赫, 钟秀宏, 张巍, 徐俊杰, 李妍, 沈楠, 张红, 吕士杰
- ZHU Wenhe, ZHONG Xiuhong, ZHANG Wei, XU Junjie, LI Yan, SHEN Nan, ZHAN Hong, LYU Shijie
- 鹿茸多肽-胶原蛋白/壳聚糖复合材料对家兔下颌骨缺损愈合的促进作用及其机制
- Promotive effect of velvet antler polypeptide-collagen/chitosan composite materials on fracture healing of mandibular defect of rabbits and its mechanism
- 吉林大学学报(医学版), 2017, 43(03): 527-531
- Journal of Jilin University (Medicine Edition), 2017, 43(03): 527-531
- 10.13481/j.1671-587x.20170313
-
文章历史
- 收稿日期: 2016-08-25
骨缺损和骨不连的修复一直是骨科临床上的难题之一, 自体或异体骨移植由于来源有限等问题难以满足临床需要。近年来骨组织工程研究不断深入,为解决这一难题带来了希望[1-2]。目前将生物活性成分加载至骨组织工程支架材料上以促进骨修复逐渐成为研究新型骨修复材料的趋势,为最终实现无损伤修复骨缺损和真正意义上的骨功能重建开辟了一条新途径。鹿茸是我国传统的名贵中药材,具有多种药理作用。鹿茸多肽是从鹿茸中提取的一种多肽类生物活性成分,具有抗炎、抗氧化、增强免疫并促进细胞分化、伤口愈合、促进神经系统和周围神经系统组织再生等药理作用,是鹿茸的主要药效成分[3-5]。本课题组前期将生物活性鹿茸多肽与胶原蛋白/壳聚糖复合制备成为具有骨修复作用的新型材料,并观察该复合材料的稳定性及其对成骨细胞增殖的影响[6]。在此基础上,本研究进一步评价鹿茸多肽-胶原蛋白/壳聚糖复合材料对家兔下颌骨缺损愈合的促进作用及其可能机制,为鹿茸多肽在骨缺损修复领域中的临床应用提供实验依据。
1 材料与方法 1.1 实验动物、主要试剂和仪器选取36只健康家兔,雌雄不限,体质量1.7~2.0 kg,由吉林大学白求恩医学部实验动物中心提供,动物合格证号:SCXK (吉)2008-0005。梅花鹿鹿茸由中国农业科学院左家特产研究所提供,Ⅰ型胶原蛋白和壳聚糖为美国Sigma公司产品,戊二醛为北京化工厂产品,其他试剂均为国产分析纯。Quanta200扫描电镜(荷兰FHI公司),Emotion 6 CT(西门子有限公司),TGL-16G台式高速离心机(上海安亭科学仪器厂)。
1.2 鹿茸多肽-胶原蛋白/壳聚糖复合材料的制备参照文献[6]的方法,将胶原溶液和壳聚糖溶液按照体积比9:1充分混匀,0.25%戊二醛溶液4℃交联24h,真空冷冻干燥,脱醛基后再次冷冻干燥。将1.0 mg·L-1鹿茸多肽涂于复合材料上,真空冷冻干燥,最后制成厚度约1 mm的鹿茸多肽-胶原蛋白/壳聚糖复合材料多孔支架,扫描电镜下观察支架材料表面及内部的微观结构。
1.3 兔下颌骨缺损模型建立麻醉动物,将兔仰卧固定于支架上,头偏右侧,脱毛,用强力碘消毒术区2次,铺无菌巾。于左下颌骨下缘上5 mm处,平行于下缘做长为3~4 cm的切口、分离皮下组织、肌肉和骨膜,切除周围骨膜,分离附着在下颌骨体的咬肌,充分暴露下颌骨,勿损伤兔颌下区动脉、静脉和神经;用齿科打磨机在左侧下颌骨体上造成15 mm×10 mm的全层骨缺损。36只下颌骨缺损家兔随机分为实验组(4、8和12周亚组)和对照组(4、8和12亚组),每亚组各6只。实验组家兔骨缺损处放置鹿茸多肽-胶原蛋白/壳聚糖缓释释放材料,对照组家兔不植入任何材料。严密分层缝合肌肉皮肤,包扎伤口。常规条件下饲养观察,术后3 d内每日肌注青霉素20万U。
1.4 CT扫描观察兔组织缺损部位和周围部分重建情况分别于术后4、8和12周时,将各实验组和对照组家兔下颌骨缺损处组织标本进行CT(SIEMENS Emotion 6) 扫描,并进行兔下颌骨缺损部位图像的三维重建。扫描分辨率21 μm,扫描层厚度为50 μm × 50 μm × 50 μm,旋转角度360°,旋转角度增量0.4°,电压120 kV,电流300 mA,曝光时间3000 ms。观察家兔组织缺损部位及其周围部分重建情况。
1.5 光镜下观察家兔骨缺损处组织病理形态表现分别于术后4、8和12周时处死各组家兔各6只,于骨缺损部位取材,在骨缺损以外4 mm范围内截取整块骨标本,尽量去除颌骨表面的软组织,生理盐水冲洗。固定于10%甲醛溶液中,采用甲酸脱钙液脱钙1周,脱水,石蜡包埋、切片、HE染色,在光镜下观察家兔骨缺损处组织病理形态表现。
1.6 免疫组织化学法检测骨缺损部位血管内皮生长因子(VEGF)表达水平术后4、8和12周骨缺损部位取材,4 %多聚甲醛溶液固定、硝酸脱钙,石蜡切片常规脱蜡至水。采用免疫组织化学试剂盒(武汉博士德生物工程有限公司)检测VEGF表达水平,DAB显色,显微镜下观察。VEGF阳性物定位于细胞质,细胞质被染成棕黄色为表达阳性,未显棕色者为阴性。以颗粒细胞中出现棕黄色颗粒为阳性结果,每个样本做5张免疫组织化学切片,对每张切片随机选取10个视野,采用Image Pro Plus 6.0专业图像分析软件,计算阳性细胞染色的平均吸光度(A)值,以A值表示VEGF表达水平。
1.7 扫描电镜下观察材料与组织交界处的超微结构取鹿茸多肽-胶原蛋白/壳聚糖复合材料和缺损壁交界的标本,用生理盐水冲净放入2.5%戊二醛磷酸缓冲固定液中保存。梯度酒精脱水、干燥、喷金处理,扫描电子显微镜下观察材料与组织交界处的超微结构。
1.8 统计学分析采用SPSS13.0统计软件进行统计学分析。实验组和对照组大鼠骨缺损部位组织中VEGF表达水平以x±s表示,经F检验显示方差齐性,组间比较采用单因素分差分析。以α= 0.05为检验水准。
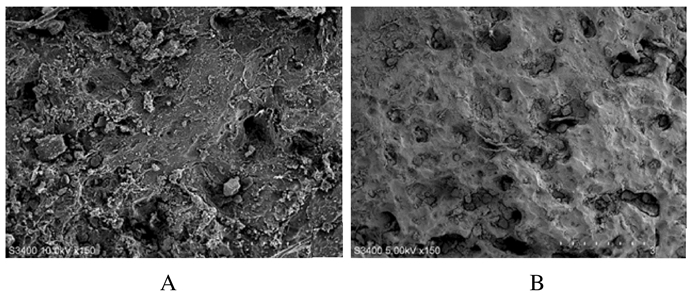
2 结果 2.1 鹿茸多肽-胶原蛋白/壳聚糖复合材料的微观结构冻干后的鹿茸多肽-胶原蛋白/壳聚糖材料呈白色海绵状,表面粗糙多孔,材料内部呈海绵状多孔隙结构。未交联胶原样品为典型的多孔疏松结构,其超微结构较为杂乱,孔径大小分布极不均匀(图 1A)。与未交联胶原样品比较,戊二醛交联样品呈现规则的层状皱褶结构,支架内部孔径变大,且以片状结构为主,是生物材料理想的微观结构形式(图 1B)。

|
| A: Polypeptide-collagen/chitosan composite materials; B: Glutaraldehyde cross linked materials. 图 1 扫描电镜下鹿茸多肽-胶原蛋白/壳聚糖复合材料的超微结构(bar=300 μm) Figure 1 Ultrastrucures of velvet antler polypeptide-collagen/chitosan composite materials under scanning electron microscope(bar=300 μm) |
|
|
术后4周,实验组材料周围组织可见明显放射显影;对照组偶见骨小梁生成。术后8周,实验组家兔的成骨量明显增多,可见牙槽骨生长,骨小梁交织成网状,排列致密,材料残留少;对照组家兔仅在缺损边缘处有少量骨小梁出现。术后12周,实验组家兔骨缺损区边缘模糊,不易分辨,新骨形成且密度基本与正常组织一致;对照组家兔有少量新骨形成,缺损未完全愈合。见图 2。
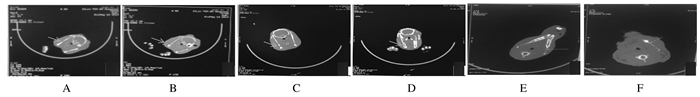
|
| A, B: 4 weeks after operation; C, D: 8 weeks after operation; E, F: 12 weeks after operation; A, C, E:Control group; B, D, F: Experiment group. 图 2 术后2组家兔颌骨骨折愈合的CT影像 Figure 2 CT images of mandibular fracture healing of rabbits after operationin two groups |
|
|
术后4周,实验组家兔骨缺损部位由纤维骨痂填充,周围有新骨生成,成骨细胞聚集在骨基质周围,材料周围可见成骨细胞环绕;对照组家兔骨缺损处主要为纤维组织填充。术后8周,实验组家兔骨缺损部位骨小梁明显增多,可见较为成熟的新生骨组织与编织骨共存,小血管增生明显,缺损区内出现骨髓组织;对照组家兔骨缺损仍为大量纤维组织填充。术后12周,实验组家兔骨缺损部位新生骨小梁改建成为更致密的板层骨,大量成骨细胞位于骨陷窝中,可见哈佛管系统,髓腔再通;对照组家兔缺损周边部位可见骨岛生成,中心部位仍由纤维组织填充。见图 3(插页一)。

|
| A, B: 4 weeks after operation; C, D: 8 weeks after operation; E, F: 12 weeks after operation; A, C, E: Contol group; B, D, F: Experiment group. 图 3 术后各组家兔骨缺损处病理形态表现(HE, ×100) Figure 3 Pathomorphology of bone defect in rabbits in various groups after operation(HE, ×100) |
|
|
VEGF免疫组织化学染色切片的观察结果显示:术后4周,实验组和对照组家兔骨缺损处VEGF表达水平最高,且实验组VEGF表达水平高于对照组(P < 0.05)。术后第8周和第12周末,实验组和对照组家兔骨组织中VEGF的表达水平呈降低趋势。见表 1和图 4(插页二)。
| (n=6, x±s) | |||
| Group | VEGF(A value) | ||
| 4 weeks after operation | 8 weeks after operation | 12 weeks after operation | |
| Control | 0.589±0.027 | 0.276±0.0189 | 0.021±0.008 |
| Experiment | 0.749±0.056* | 0.317±0.089* | 0.019±0.010 |
| *P < 0.05 vs control group. | |||
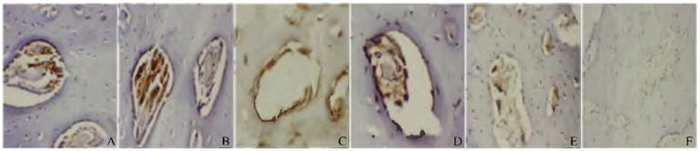
|
| A, B: 4 weeks after operation; C, D: 8 weeks after operation: E, F: 12 weeks after operation; A, C, E: Control group; B, D, F: Experiment group. 图 4 各组家兔骨组织中VEGF表达情况(HE,×200) Figure 4 Expressions of VEGF in bone tissue of rabbits in various groups (HE, ×200) |
|
|
术后4周,2组家兔材料与骨缺损交界的病理学改变结果显示:实验组家兔新生骨样组织致密,与骨组织相互融合成整体,材料大部分降解;对照组家兔大量钙盐沉积,胶原纤维数量减少。见图 5。
|
| A: Control group; B: Experiment group. 图 5 扫描电镜下观察2组家兔术后4周骨折愈合情况(bar=300 μm) Figure 5 Fracture healing of rabbitsin two groups 4 weeks after operation detected by scanning electron microscope(bar=300 μm) |
|
|
我国每年因创伤和疾病所致骨缺损、骨折不愈合和骨坏死等患者达数百万,自体骨移植是骨修复技术的理想策略,效果最好,但是来源有限[7-8]。骨组织工程技术是治疗骨缺损的理想模式,骨组织工程材料不断的研制和发展,为今后骨缺损的修复开辟了广阔的发展前景[9-10]。本研究将生物活性鹿茸多肽与胶原蛋白/壳聚糖复合制备具有骨修复作用的新型材料,探讨其对家兔下颌骨缺损的修复作用及其机制,为鹿茸多肽在骨缺损修复领域中的临床应用提供实验依据。
本研究结果表明:本研究制备的复合材料冻干后呈白色海绵状,表面粗糙多孔,材料内部呈海绵状多孔隙结构。扫描电镜观察显示:未交联胶原样品为典型的多孔疏松结构,其超微结构较为杂乱,孔径大小分布极不均匀;而戊二醛交联样品呈现规则的层状皱褶结构,支架内部孔径变大,且以片状结构为主。此结构能够提高该材料的稳定和抗拉伸性,可以解决胶原所具有的降解速度过快、易收缩变形以及机械性能不足等缺点。
为评价鹿茸多肽-胶原蛋白/壳聚糖复合材料对骨折愈合的促进作用,本课题组建立了家兔下颌骨缺损模型评价其作用。CT观察显示:术后4周实验组材料周围组织可见明显放射显影;术后8周,实验组的成骨量明显增多;术后12周,实验组兔骨缺损区边缘模糊,不易分辨,新骨形成且密度基本与正常组织一致。组织学观察结果显示:术后实验组家兔在骨缺损处已形成结构较为良好的新生骨组织并填充缺损处,随着治疗时间的延长,骨折愈合愈发明显。对照组家兔新骨生长缓慢。上述结果表明鹿茸多肽-胶原蛋白/壳聚糖复合材料能够缓释药物,加速骨折愈合。
血管形成和血供重建是骨修复过程中骨替代及骨改建得以顺利进行的关键环节,骨折的修复离不开血管的形成,血管生成在骨的新生、再生和修复过程中均起重要作用[11-14]。VEGF是目前作用最强、特异性最高的促血管生成因子,是新生血管形成定量分析的较可靠指标[15-18]。免疫组织化学分析结果显示:术后4周,实验组和对照组家兔骨组织中VEGF表达水平最高,且实验组家兔骨组织中VEGF表达量高于对照组;术后8和12周实验组和对照组骨组织中家兔VEGF的表达呈减弱趋势,表明材料通过促进VEGF表达,从而促进骨缺损处微血管新生,加快骨折愈合,缩短骨折愈合时间,达到促进骨折愈合和修复骨缺损的目的。
综上所述,本研究制备的鹿茸多肽-胶原蛋白/壳聚糖复合材料对骨缺损愈合均有明显的促进作用,其机制可能与促进VEGF表达有关,但具体机制仍需要进一步研究。本实验结果为新型骨组织材料的研究提供了新的思路,也为鹿茸多肽在骨缺损修复领域中的临床应用提供了实验依据。
| [1] | Rowshan HH, Parham MA, Baur DA, et al. Effect of intermittent systemic administration of recombinant parathyroid hormone (1-34) on mandibular fracture healing in rats[J]. J Oral Maxillofac Surg, 2010, 68(2): 260–267. DOI:10.1016/j.joms.2009.09.045 |
| [2] | Borys J, Grabowska SZ, Antonowicz B, et al. Collagen type Ⅰ and Ⅲ metabolism in assessment of mandible fractures healing[J]. Rocz Akad Med Bialymst, 2004, 49(1995): 237–245. |
| [3] | 王丰, 梅子青, 周秋丽, 等. 鹿茸多肽的分离纯化及药理活性[J]. 吉林大学学报:理学版, 2004, 41(1): 111–114. |
| [4] | 王丽娟. 鹿茸多肽对实验性骨折的治疗作用及机理研究[J]. 吉林大学学报:医学版, 1999, 25(5): 586–588. |
| [5] | 柯蕾芬, 白海英. 鹿茸多肽药理作用的研究进展[J]. 吉林医药学院学报, 2013, 34(2): 138–140. |
| [6] | 朱文赫, 李亚巍, 沈楠, 等. 不同交联方法制备的鹿茸多肽-胶原蛋白/壳聚糖复合材料对成骨细胞增殖的影响[J]. 中国实验方剂学杂志, 2014, 20(14): 5–8. |
| [7] | 王昌俊, 郑欣, 邱旭升, 等. 影响骨折愈合的生物物理学因素研究进展[J]. 中国矫形外科杂志, 2014, 22(10): 898–901. |
| [8] | Einhorn TA, Gerstenfeld LC. Fracture healing:mechanisms and interventions[J]. Nat Rev Rheumatol, 2015, 11(1): 45–54. |
| [9] | Xavier JR, Thakur T, Desai P, et al. Bioactive nanoengineered hydrogels for bone tissue engineering:a growth-factor-free approach[J]. Acs Nano, 2015, 9(3): 3109–3118. DOI:10.1021/nn507488s |
| [10] | Yan LP, Silvacorreia J, Correia C, et al. Bioactive macro/micro porous silk fibroin/nano-sized calcium phosphate scaffolds with potential for bone-tissue-engineering applications[J]. Nanomedicine, 2016, 8(3): 359–378. |
| [11] | 初同伟, 王正国, 朱佩芳, 等. 骨折愈合过程中血管内皮生长因子及其受体的表达[J]. 中华创伤杂志, 2001, 17(6): 344–346. |
| [12] | 丁志山. 参麦注射液对血管生成影响的研究[J]. 中国中西医结合杂志, 2002, 10(10): 761–763. DOI:10.3321/j.issn:1003-5370.2002.10.012 |
| [13] | 乔连铭, 冯敢生, 李欣, 等. 化疗栓塞对大鼠Walker-256肝肿瘤移植模型微血管密度、VEGF和bFGF表达的影响[J]. 吉林大学学报:医学版, 2004, 30(1): 32–34. |
| [14] | 向伟楚, 李欢欢, 李国栋, 等. "双血管三维影像融合"对脑血管病诊治评估的价值[J]. 中国临床神经外科杂志, 2015, 20(1): 1–4. |
| [15] | Zelzer E, Glotzer DJ, Hartmann C, et al. Tissue specific regulation of VEGF expression during bone development requires Cbfa1/Runx2[J]. Mech Dev, 2001, 106(1/2): 97–106. |
| [16] | Nakagawa M, Kaneda T, Arakawa T, et al. Vascular endothelial growth factor (VEGF) directly enhances osteoclastic bone resorption and survival of mature osteoclasts[J]. FEBS Lett, 2000, 473(2): 161–164. DOI:10.1016/S0014-5793(00)01520-9 |
| [17] | Ciamporcero E, Miles KM, Adelaiye R, et al. Combination strategy targeting VEGF and HGF/c-met in human renal cell carcinoma models[J]. Mol Can Ther, 2015, 14(1): 101–110. DOI:10.1158/1535-7163.MCT-14-0094 |
| [18] | Agostino NM, Saraceni C, Kincaid H, et al. A prospective evaluation of the role of vascular endothelial growth factor (VEGF) and the immune system in stage Ⅲ/Ⅳ melanoma[J]. SpringerPlus, 2015, 4(1): 1–9. DOI:10.1186/2193-1801-4-1 |
 2017, Vol. 43
2017, Vol. 43


