扩展功能
文章信息
- 张晶, 王志成, 赵大力, 卢晓倩, 沈智渊, 齐亚莉
- ZHANG Jing, WANG Zhicheng, ZHAO Dali, LU Xiaoqian, SHEN Zhiyuan, QI Yali
- 电离辐射对肺癌H460细胞凋亡的影响及其机制
- Effect of ionizing radiation on apoptosis of lung cancer H460 cells and its mechansim
- 吉林大学学报(医学版), 2017, 43(03): 522-526
- Journal of Jilin University (Medicine Edition), 2017, 43(03): 522-526
- 10.13481/j.1671-587x.20170312
-
文章历史
- 收稿日期: 2016-09-02
2. 吉林大学公共卫生学院卫生部放射生物学 重点实验室, 吉林 长春 130021;
3. 美国罗格斯新泽西州立大学肿瘤研究所, 新泽西州 皮斯卡塔韦 08903-2681;
4. 吉林省出入境检验检疫局, 吉林 长春 130013
2. Key Laboratory of Radiobiology, Ministry of Health, School of Public Health, Jilin University, Changchun 130021, China;
3. Cancer Institute, State University of New Jersey, New Jersey 08903-2681, USA;
4. Jilin Province Entry and Exit Inspection and Quarantine Bureau, Changchun 130013, China
肿瘤基因放射治疗靶点的选择一直是肿瘤临床和基础科学研究的重要环节。研究者[1-4]发现:可以将DNA损伤继而造成细胞死亡的关键节点作为肿瘤放射治疗靶点选择的依据。ATRX蛋白属于SWI2/SNF2蛋白家族成员,具有广泛的生物学功能,可参与DNA损伤修复、转录调节和染色质的重组等,而且是肿瘤细胞端粒不正常延长(alternative lengthening of telomeres,ALT)的重要调节因子[5-6]。多聚腺苷酸二磷酸核糖基聚合酶[poly(ADP-ribose)polymerase,PARP]是DNA损伤修复的一个重要因子,是凋亡执行者caspase-3的靶点,二者协同作用可以调控细胞凋亡[7]。随着肿瘤基因放射治疗相关研究的开展,靶点的选择日益重要。本研究以ATRX为靶点进行RNA干扰(RNAi),致肺癌H460细胞中ATRX低表达后,通过给予电离辐射,观察肺癌H460细胞凋亡的变化,分析PARP1和caspase-3是否参与相关表型改变的分子调控,为肿瘤基因放射治疗靶点的选择提供新的参考。
1 材料与方法 1.1 细胞和主要试剂人肺癌H460细胞购自中国科学院上海细胞生物学研究所;人胚肾HEK293细胞由吉林大学公共卫生学院卫生部放射生物学重点实验室保存,采用MEM培养基培养,培养基含10%胎牛血清、100 U·mL-1青霉素和链霉素,置于5%CO2培养箱中培养。MEM培养基和胎牛血清为美国Gibco产品,青霉素和链霉素为美国Sigma公司产品,ATRX、β-actin、GAPDH、PARP1、caspase-3一抗和ECL发光试剂盒为美国Santa Cruz公司产品,辣根过氧化物酶标记的二抗为美国Pierce公司产品,Annexin Ⅴ-FITC/PI试剂盒购自南京凯基生物,其他试剂为国产分析纯。
1.2 ATRX沉默的H460细胞模型的获得和分组靶向ATRX的慢病毒载体骨架为pGIPz,带有puro筛选标记和氨苄抗性,并带有绿色荧光标记。靶向ATRX的shRNA片段序列分别为:sh-ATRX1(ATCCTCAAGAGGTTGAATC)、sh-ATRX2(TTTCTTATGTTCACCACCG)和sh-ATRX3(TTATCTTGTGGAACTTCCT)。pSPAX2和pMD2G质粒均由美国罗格斯新泽西州立大学肿瘤研究所沈智渊博士惠赠。采用RU50试剂将pGIPz-control、pGIPz-shATRX1、pGIPz-shATRX2和pGIPz-shATRX3质粒与pSPAX2和pMD2G分别共转染293T细胞,RU50:shRNA:pSPAX2:pMD2G=300 μL:3 μg:1.5 μg:1.5 μg。48和72 h后收集上清液,并采用2 μm滤膜过滤后加入培养于6孔板的H460细胞中,共感染2次。通过观察绿色荧光的状态判定感染效率,并加入10 μL的puromycin进行阳性筛选,筛选后命名为sh-ATRX1-H460、sh-ATRX2-H460和sh-ATRX3-H460细胞,以sh-control-H460作为对照,逐渐将阳性细胞扩增并冻存液氮中备用。根据沉默实验结果分为sh-control-H460组和sh-ATRX3-H460组。
1.3 Western blotting法检测沉默效率分别将sh-control-H460、sh-ATRX1-H460、sh-ATRX2-H460和sh-ATRX3-H460细胞接种于6孔板,每孔1×107个细胞,24 h后收集细胞,并加入裂解液RIPA 100 μL,超声后加入5×Loading buffer,100℃变性10 min后,冷却样品直接上样,3%浓缩胶80 V,6%分离胶120 V,SDS-PAGE电泳后转膜缓冲液4℃中过夜湿转,5%脱脂奶粉封闭1 h后,ATRX一抗(TBST配置,1:1 000)37℃孵育2 h,TBST洗涤3次,每次10 min,加入辣根过氧化物酶标记的二抗(TBST配置,1:3 000) 后37℃孵育1 h,TBST洗涤3次,加入ECL液A和B,暗室中曝光,并拍照分析。
1.4 流式细胞术检测细胞凋亡率采用Annexin Ⅴ/FITC试剂盒检测细胞凋亡率。sh-control-H460组和sh-ATRX3-H460组细胞按照每孔3 × 105密度接种于24孔板,每孔2 mL,12 h后给予0、2和8 Gy X射线照射,照射后24 h收集细胞,PBS洗涤2次后弃上清,每个流式管中需要加入500 μL缓冲液,轻微震荡重悬细胞,加入Annexin Ⅴ/FITC和PI各5 μL,轻微震荡摇匀后室温避光15 min,采用流式细胞仪CellQuest软件收集细胞,并分析细胞凋亡率。
1.5 Western blotting法检测细胞中PARP1和caspase-3蛋白表达分别将sh-control-H460组和sh-ATRX3-H460组细胞接种于6孔板,每孔1×107个细胞,12 h后给予0、2和8 Gy X射线照射,24 h后收集细胞,提取总蛋白,进行Western blotting实验,方法同1.3,通过条带灰度变化判定实验结果。
1.6 统计学分析采用SPSS 17.0统计软件进行统计学分析。各组细胞凋亡率以x±s表示,组间比较采用Student’s t检验。以α=0.05为检验水准。
2 结果 2.1 ATRX沉默效率正常肺癌细胞H460和sh-control细胞中ATRX蛋白灰度较高,而sh-ATRX1-H460、sh-ATRX2-H460和sh-ATRX3-H460细胞中ATRX蛋白灰度降低,表明低表达或无表达(图 1)。根据GAPDH表达的情况可判定sh-ATRX2-H460和sh-ATRX3-H460细胞中ATRX蛋白沉默效率更高。
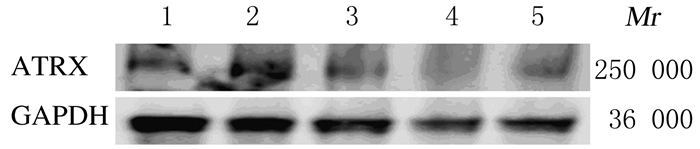
|
| Lane1: H460cells; Lane 2: sh-control-H460 cells; Lane 3: sh-ATRX1-H460 cells; Lane 4: sh-ATRX2-H460 cells; Lane 5: sh-ATRX3-H460 cells. 图 1 Western blotting法检测细胞中ATRX蛋白表达电泳图 Figure 1 Electrophoregram of expressions of ATRX protein in cells detected by Western blotting method |
|
|
2和8 Gy X射线照射后1、6和24 h,sh-control-H460细胞组细胞中ATRX蛋白表达量增加,在6 h时表达量最大,而24 h时略有降低;sh-ATRX3-H460细胞组中则无ATRX蛋白表达。见图 2。
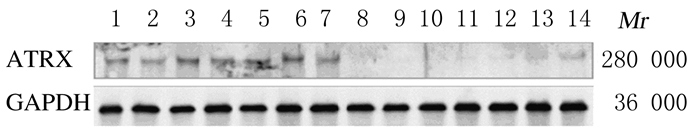
|
| Lane 1-7:sh-control-H460 group; Lane 8-14: sh-ARTX3-H460 group; Lane 1-4, 8-11:2 Gy X-ray; Lane 5-6, 12-14:8 Gy X-ray; Lane 1, 8:0 h; Lane 2, 5, 9, 12:1 h; Lane 3, 6, 10, 13:6 h; Lane 4, 7, 11, 14:24 h. 图 2 Western blotting法检测照射后不同时间细胞中ATRX蛋白表达电泳图 Figure 2 Electrophoregram of expressions of ATRX protein in cells at different time points after irradiation detected by Western blotting method |
|
|
2和8 Gy X射线照射后24 h,sh-control-H460组和sh-ATRX3-H460组细胞凋亡率均较0 Gy时明显增加(P < 0.05或P < 0.01);而且8 Gy X射线照射后,sh-ATRX3-H460组细胞凋亡率较sh-control-H460组明显升高(P < 0.01)。见表 1和图 3。
| (n=3, x±s) | |||
| Group | Apoptotic rate(η/%) | ||
| 0 Gy X-ray irradiation | 2 Gy X-ray irradiation | 8 Gy X-ray irradiation | |
| Sh-control-H460 | 8.34±1.01 | 14.79±2.12△ | 16.47±2.51△ |
| Sh-ATRX3-H460 | 8.99±1.22 | 15.88±2.31△ | 31.33±4.21*△△ |
| *P < 0.01 vs sh-control-H460 cells group; △P < 0.05,△△P < 0.01 vs 0 Gy X-ray irradiation. | |||
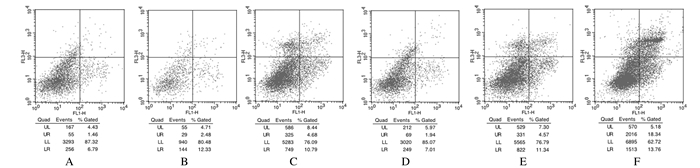
|
| A-C: sh-control-H460 group; D-F: sh-ATRX3-H460 group; A, D: 0 Gy X-ray; B, E:2 Gy X-ray; C, F: 8 Gy X-ray. 图 3 流式细胞术检测照射后sh-control-H460组和sh-ATRX3-H460组细胞凋亡流式图 Figure 3 Diagram of apoptosis in sh-control-H460 cells and sh-ATRX3-H460 groups after irradiation detected by flow cytometry |
|
|
sh-control-H460组细胞在2和8 Gy X射线照射后,1、6和24 h均出现cleaved PARP1蛋白表达量增加,以24 h时表达量最多;sh-ATRX3-H460细胞与sh-control-H460细胞中表达规律相似,只是表达量更高,尤其是8 Gy X射线照射后24 h最高。sh-control-H460细胞中procaspase-3蛋白表达量无明显变化,8 GyX射线照射后6和24 h, sh-ATRX3-H460细胞中procaspase-3蛋白表达量明显增加。见图 4。
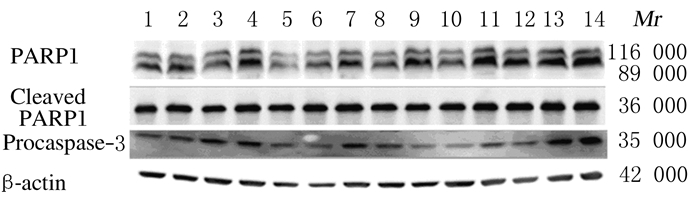
|
| Lane 1-7: Control group; Lane 8-14: Experiment group; Lane 1-4, 8-11: 2 Gy X-ray; Lane 5-6, 12-14: 8 Gy X-ray; Lane 1, 8: 0 h; Lane 2, 5, 9, 12: 1 h; Lane 3, 6, 10, 13: 6 h; Lane 4, 7, 11, 14: 24 h. 图 4 Western blotting法检测照射后sh-control-H460和sh-ATRX3-H460组细胞中PARP1和procaspase-3蛋白表达电泳图 Figure 4 Electrophoregram of expressions of PARP1 and procaspase-3 protein in cells in sh-control-H460 and sh-ATRX3-H460 groups after irradiation detected by Western blotting method |
|
|
肺癌是常见的肺部原发肿瘤,近50年来其发病率和死亡率逐年升高,肺癌的主要临床治疗方式包括化学治疗、放射治疗和外科手术治疗等。小细胞肺癌对射线具有高度敏感性,因此放射治疗是其最佳治疗方式。不同病理分型的肺癌具有不同的放射敏感性,增强辐射耐受肺癌的放射敏感性,增加其辐射细胞凋亡对于肺癌临床治疗具有重要意义。因此,本研究选取肺癌H460细胞进行辐射细胞凋亡实验。
染色体是遗传信息的主要载体,其稳定性决定着生物遗传稳定性。电离辐射时,细胞中双链断裂(double strand breaks,DSB)情况与染色体结构和辐射相关因素有关联。放射治疗杀伤肿瘤细胞的基本原理是基因组DNA的DSB,导致细胞DNA损伤后得不到正确的修复,进而导致细胞死亡,如细胞凋亡等使细胞丧失增殖能力[8]。电离辐射引起的DSB最为严重[9]。DNA损伤修复的基本方式有多种[10],其中同源重组修复(HR)和非同源末端连接(NHEJ)是DSB修复的主要通路,共同维护基因组的稳定性。DNA损伤修复涉及许多基因,其中ATRX基因是DNA损伤修复基因,其主要功能包括维持端粒的稳定、染色体黏附、维持DNA结构和直接连接到DSB位点等[11-14]。本研究采用靶向ATRX基因的慢病毒表达载体,转染293T细胞后,慢病毒2次感染肺癌细胞H460,并通过puromycin阳性筛选获得稳定ATRX沉默的细胞模型。Western blotting结果显示:2条RNAi序列具有较好的干扰效果,可以作为候选细胞进行后续研究。电离辐射可以诱导ATRX蛋白的表达量增加,其表达量在6和24 h时达到相对高值。
PARP存在于多数真核细胞中,是一种多功能蛋白质翻译后修饰酶,通过识别结构损伤的DNA片段而被激活,被认为是DNA损伤的感受器,通过组蛋白的ADP-核糖基化使组蛋白脱离下来,有助于修复蛋白的结合而进行DNA的损伤修复。HR和NHEJ损伤修复时,涉及到多种信号通路,PARP除了具有核定位的功能外,还是caspase-3的酶切位点;DNA损伤时,激活了PARP1和PARP2,使其以二聚体的形式参与聚ADP-核糖基化过程,协同修复DNA损伤[15]。当发生高损伤时,PARP可以过度激活导致ATP/NAD删除和坏死,还可以通过caspase-3激活和PARP断裂而介导细胞凋亡;当发生低损伤时,PARP募集其他修复酶而修复DNA损伤[7]。研究[16-17]表明:线粒体通路和死亡受体通路等凋亡信号传导通路均能激活caspase-3,导致细胞质、细胞核以及细胞骨架的重要蛋白酶失活,从而促使细胞凋亡。
本研究结果显示:2 Gy X射线照射能够诱导2种细胞的凋亡率升高,但组间比较差异无统计学意义;2种细胞中PARP1和procaspase-3蛋白表达量有增加趋势,但组间比较差异无统计学意义,提示2 Gy X射线照射时可能使细胞DNA受到较低的损伤,PARP1参与ATRX缺乏细胞的DNA损伤修作用不明显;8 Gy X射线照射诱导sh-ATRX3-H460组细胞凋亡率明显升高,高于sh-control-H460组,断裂的PARP1和procaspase-3表达量也明显增加,提示8 Gy X射线照射使DNA受到较高的损伤,PARP1可能参与ATRX缺乏细胞的辐射诱导细胞凋亡。由于本研究采用的caspase-3抗体只能检测到procaspase-3表达量明显增加,未能检测到断裂的caspase-3,而procaspase-3是caspase-3的前体,因此本实验无法准确判定caspase-3是否参与ATRX缺乏细胞的辐射诱导细胞凋亡,但由于procaspase-3表达量明显增加,结合相关研究,本文作者认为:caspase-3参与了ATRX缺乏细胞的辐射诱导细胞凋亡。
综上所述,采用RNAi降低H460细胞中ATRX表达后,电离辐射能够增加细胞凋亡率,该过程可能涉及PARP1-caspase-3通路。本研究结果表明:以ATRX为靶点的肿瘤基因-放射治疗具有一定的效果,为临床放疗提供了一个新的治疗靶点。
| [1] | Sultana R, Abdel-Fatah T, Abbotts R, et al. Targeting XRCC1deficiency in breast cancer for personalized therapy[J]. Cancer Res, 2013, 73(5): 1621–1634. DOI:10.1158/0008-5472.CAN-12-2929 |
| [2] | Cun Y, Dai N, Xiong C, et al. Silencing of APE1 enhancessensitivity of human hepatocellular carcinoma cells to radiotherapy invitro and in a xenograft model[J]. PLoS One, 2013, 8(2): e55313. DOI:10.1371/journal.pone.0055313 |
| [3] | Ledermann JA, Drew Y, Kristeleit RS. Homologous recombination deficiency and ovarian cancer[J]. Eur J Cancer, 2016, 60(1): 49–58. |
| [4] | Saha S, Mandal P, Ganguly S, et al. Decreased expression of BRCA2 accelerates sporadic breast cancer progression[J]. Indian J Surg Oncol, 2015, 6(4): 378–383. DOI:10.1007/s13193-015-0449-1 |
| [5] | Ramamoorthy M, Smith S. Loss of ATRX suppresses resolution of telomere cohesion to control recombination in ALT cancer cells[J]. Cancer Cell, 2015, 28(3): 357–369. DOI:10.1016/j.ccell.2015.08.003 |
| [6] | Lovejoy CA, Li W, Reisenweber S, et al. Loss of ATRX, genome instability, and an altered DNA damage response are hallmarks of the alternative lengthening of telomeres pathway[J]. PLoS Genet, 2012, 8(7): e1002772. DOI:10.1371/journal.pgen.1002772 |
| [7] | Agarwal A, Mahfouz RZ, Sharma RK, et al. Potential biological role of poly (ADP-ribose) polymerase (PARP) inmale gametes[J]. Reprod Biol Endocrinol, 2009, 7(2): 143. |
| [8] | Jorgensen TJ. Enhancing radiosensitivity:targeting the DNA repair pathways[J]. Cancer Biol Ther, 2009, 8(8): 665–670. DOI:10.4161/cbt.8.8.8304 |
| [9] | 龚守良. 医学放射生物学[M]. 4版. 北京: 中国原子能出版社,2015. |
| [10] | Sharova NP. How does a cell repair damaged DNA?[J]. Biochemistry(Mosc), 2005, 70(3): 275–291. |
| [11] | Voon HP, Hughes JR, Rode C, et al. ATRX plays a key role in maintaining silencing at interstitial heterochromatic loci and imprinted genes[J]. Cell Rep, 2015, 11(3): 405–418. DOI:10.1016/j.celrep.2015.03.036 |
| [12] | Noh KM, Maze I, Zhao D, et al. ATRX tolerates activity-dependent histone H3 methyl/phos switching to maintain repetitive element silencing inneurons[J]. Proc Natl Acad Sci USA, 2015, 112(22): 6820–6827. DOI:10.1073/pnas.1411258112 |
| [13] | De La Fuente R, Baumann C, Viveiros MM. Chromatin structure and ATRX function in mouse oocytes[J]. Results Probl Cell Differ, 2012, 55(1): 45–68. |
| [14] | Ratnakumar K, Bernstein E. ATRX:the case of a peculiar chromatin remodeler[J]. Epigenetics, 2013, 8(1): 3–9. DOI:10.4161/epi.23271 |
| [15] | Mortusewicz O, Ame JC, Schreiber V, et al. Feedback-regulatedpoly (ADP-ribosyl)ation by PARP-1 is required for rapid response toDNA damage in living cells[J]. Nucleic Acids Res, 2007, 35(22): 7665–7675. DOI:10.1093/nar/gkm933 |
| [16] | Hail N Jr, Carter BZ, Konopleva M, et al. Apoptosis effector mechanisms:a requiem performed in different keys[J]. Apoptosis, 2006, 11(6): 889–904. DOI:10.1007/s10495-006-6712-8 |
| [17] | Ji BC, Hsu WH, Yang JS, et al. Gallic acid induces apoptosis via caspase-3 and mitochondrion-dependent pathways in vitro and suppresses lung xenograft tumor growth in vivo[J]. J Agric Food Chem, 2009, 57(16): 7596–7604. DOI:10.1021/jf901308p |
 2017, Vol. 43
2017, Vol. 43


