扩展功能
文章信息
- 王月华, 鞠晓红, 钟秀宏, 李强, 孙艳美, 姜晓明
- WANG Yuehua, JU Xiaohong, ZHONG Xiuhong, LI Qiang, SUN Yanmei, JIANG Xiaoming
- 伏立康唑对体外培养棘阿米巴增殖和形态表现的影响
- Effects of voriconazole on proliferation and morphology of Acanthamoeba cultivated in vitro
- 吉林大学学报(医学版), 2017, 43(03): 518-521
- Journal of Jilin University (Medicine Edition), 2017, 43(03): 518-521
- 10.13481/j.1671-587x.20170311
-
文章历史
- 收稿日期: 2016-09-05
2. 吉林医药学院基础医学院病理学教研室, 吉林 吉林 132013
2. Department of Pathology, School of Basic Medical Sciences, Jilin Medical University, Jilin 132013, China
棘阿米巴(Acanthamoeba)是一种在自然界分布广泛的机会致病性原虫,某些致病性虫株可引起严重损害视力的致盲性眼病—棘阿米巴性角膜炎(Acanthamoeba keratitis,AK) [1]。目前,临床上治疗AK的一线药物首选为双胍类和联脒类[2],但其代表药物聚六亚甲基双胍(polyhexamethyl biguanide,PHMB)和氯己定大剂量应用产生耐药的临床病例已有报道[3],而且使用0.02% PHMB和氯己定可对角膜上皮细胞产生毒性,因此研发新型抗棘阿米巴药物成为迫切需要。研究[4-5]表明:伏立康唑是一种有效的抗真菌药物,其主要通过干扰真菌细胞膜麦角甾醇的合成而发挥抑制作用,而麦角甾醇也是棘阿米巴细胞膜上的主要甾醇。虽然国内尚未见伏立康唑对棘阿米巴作用的相关报道,但国外已有少量关于洗必泰联合伏立康唑对棘阿米巴杀伤和诱导其程序性死亡的实验研究[6-8],而关于伏立康唑单独作用于棘阿米巴后对其形态的影响尚未见报道。本研究选用伏立康唑作为抗棘阿米巴的药物,探讨其对体外培养的棘阿米巴滋养体和包囊的抑制及杀伤作用。
1 材料与方法 1.1 棘阿米巴虫株、主要试剂和仪器赫氏棘阿米巴(Acanthamoeba healyi)由延边大学医学院免疫学与病原生物学教研室惠赠,于本校检验学院病原技术教研室液氮中保存。实验前将虫体复苏,采用蛋白胨酵母浸膏葡萄糖(peptone-yeast extract-glucose,PYG)培养基培养、传代。伏立康唑(美国Sigma公司)。37℃恒温箱(北京六一仪器厂),倒置显微镜(德国莱卡公司)。
1.2 棘阿米巴培养参照文献[9]方法进行原虫培养。
1.3 细胞计数法检测棘阿米巴虫体的数量采用定量培养法观察棘阿米巴虫体的数量。收集对数期生长的棘阿米巴并调整浓度为1.0×105 mL-1,加入24孔细胞培养板中,每孔1 mL。随机分为对照组和实验组(2.5和25.0mg·L-1),每组均设5个平行孔,实验组分别加入浓度为5和50 mg·L-1伏立康唑,每孔1mL,至终浓度分别为2.5和25.0 mg·L-1;对照组加入等量的PYG,30℃恒温培养。于给药后24、48、72和96 h进行虫体计数并绘制棘阿米巴增殖曲线。
1.4 光镜下观察棘阿米巴的形态表现收集对数生长期的棘阿米巴,调整其浓度为3.0×105 mL-1,加入24孔细胞培养板中,每孔1 mL。实验组分别加入浓度为5和50 mg·L-1伏立康唑,每孔1 mL,使其终浓度分别为2.5和25.0 mg·L-1;对照组加入等量PYG,每组设3个平行孔,30℃培养。24 h后于倒置显微镜下观察棘阿米巴的形态表现、贴壁和活力情况。
1.5 电镜下观察棘阿米巴的超微结构取对数生长期的棘阿米巴原虫悬液5 mL,分别加入6个含有45 mL PYG培养液的培养瓶中,培养2~3 d,观察对数生长期的棘阿米巴,实验组加入伏立康唑,并使其终浓度分别为2.5和25.0 mg·L-1,对照组不加伏立康唑。30℃培养48 h,300 g离心10 min,PBS洗涤2次,将棘阿米巴移入1 mL试管。戊二醛固定标本,丙酮行梯度脱水,环氧树脂和石蜡分别进行浸透和包埋聚合,制备超薄切片并染色。透射电子显微镜观察棘阿米巴的超微结构。
1.6 统计学分析采用SPSS16.0统计软件进行统计学分析。各组棘阿米巴虫体数量以x±s表示,组间比较采用方差分析。以α=0.05为检验水准。
2 结果 2.1 各组棘阿米巴虫体的数量对照组棘阿米巴虫体数量在72 h内明显增加,实验组棘阿米巴虫体数量在72 h内均出现生长抑制。培养48 h时对照组棘阿米巴虫体浓度达(3.70±0.10)×105 mL-1, 72 h生长达到峰值(5.20±0.08)×105 mL-1。与对照组比较,实验组各时段棘阿米巴虫体生长均受到明显抑制,药物作用时24 h时,2.5和25.0mg·L-1实验组棘阿米巴虫体浓度分别下降至(0.51±0.13) 和(0.41±0.05)× 105 mL-1。48 h时25.0 mg·L-1实验组棘阿米巴虫体死亡近4/5,96 h时未见活体。药物作用后24、48、72和96 h时实验组棘阿米巴虫体数量均少于对照组(P < 0.01)。见图 1和表 1。
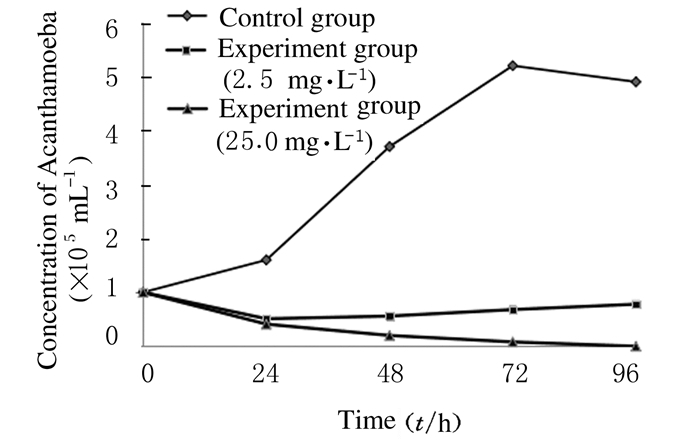
|
| 图 1 各组棘阿米巴的增殖曲线 Figure 1 Proliferation curves of Acanthamoeba in various groups |
|
|
| (x±s, ×105 mL-1) | |||||
| Group | Number of Acanthamoeba insect body | ||||
| (t/h) 0 | 24 | 48 | 72 | 96 | |
| Control | 1.00±0.05 | 1.60±0.11 | 3.70±0.10 | 5.20±0.08 | 4.90±0.11 |
| Experiment | |||||
| 2.5 mg·L-1 | 1.00±0.05 | 0.51±0.13* | 0.56±0.09* | 0.68±0.09* | 0.78±0.06* |
| 25.0 mg·L-1 | 1.00±0.05 | 0.41±0.10* | 0.20±0.07* | 0.08±0.05* | 0 |
| *P < 0.01 vs control group. | |||||
伏立康唑作用24 h时,对照组棘阿米巴生长状况良好;实验组棘阿米巴形态变化显著,几乎均由不规则长圆形变成圆形或椭圆形,棘刺状伪足消失,形成包囊;虫体运动明显迟缓、无力,活力下降,贴壁虫体数量明显减少,尤其是25.0 mg·L-1实验组棘阿米巴数量减少极为明显,不仅观察到细胞碎片,而且完整的棘阿米巴包囊少见。见图 2(插页一)。

|
| A:Control group; B: Experiment group (2.5 mg·L-1); C: Experiment group (25.0mg·L-1). 图 2 光镜下各组棘阿米巴的形态表现(×250) Figure 2 Morphology of Acanthamoeba in various groups under light microscope(×250) |
|
|
对照组棘阿米巴的胞膜完整,可清楚观察到双层核膜;细胞核中央大而圆的核仁清晰可见,染色质均匀分布;线粒体丰富并聚集于胞质内,嵴清晰,紧密排列呈板状;在棘阿米巴胞质中还有大小不一的不规则食物泡(图 3A)。2.5 mg·L-1实验组棘阿米巴明显肿胀,虽胞膜完整,但部分线粒体外膜、核膜和食物泡膜肿胀(图 3B);25.0 mg·L-1实验组棘阿米巴胞膜皱缩,胞质疏松,细胞器严重损伤,线粒体肿胀变性,相互融合形成空泡,嵴断裂或消失,膜结构不清,核膜双层结构模糊,甚至出现调亡小体(图 3C)。
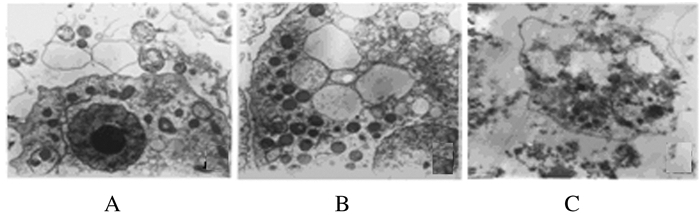
|
| A:Control group;B:Experiment group(2.5 mg·L-1); C: Experiment group (25.0mg·L-1);A,B:Bar=1 μm;C:Bar=2 μm). 图 3 电镜下各组棘阿米巴的超微结构 Figure 3 Ultrastructures of Acanthamoeba in various groups under electron microscope |
|
|
棘阿米巴是一种单细胞真核生物,生活史包括活动期的滋养体和静止期的包囊。滋养体呈不规则长圆形,长度为15~45 μm,体表有多个细小的棘状伪足,可做无定向缓慢运动,胞核呈泡状,胞质内可见多个食物泡;包囊是具有双层囊壁的类圆形球体,直径为9~27 μm,内壁光滑呈多形性,外壁有皱纹。当受药物作用时滋养体会快速转化为包囊,包囊具有双层囊壁结构,在体内和体外能抵抗多种化学药物而长期存活。研究[10-11]显示:大部分实验药物仅对棘阿米巴的滋养体有杀灭作用,但对包囊的作用效果不理想,因此残余包囊常导致感染复发。本研究选用伏立康唑作为抗棘阿米巴的药物,与对照组比较,实验组棘阿米巴虫体数量减少;光镜下实验组棘阿米巴形态变化明显,由不规则带棘状伪足的滋养体转化为圆形包囊,甚至观察到大量细胞碎片;电镜下实验组棘阿米巴的超微结构出现了不同程度的破坏,甚至坏死。重复3次,结果基本一致。本研究结果表明:伏立康唑具有抑制棘阿米巴体外生长作用,并可导致滋养体破环和囊化,而包囊在一定时间和药物剂量作用下其形态可被破坏。伏立康唑是一种新型的三唑类抗真菌药物,具有广谱、高效和低毒的特点,可通过抑制真菌中14α-甾醇去甲基化,干扰细胞膜麦角甾醇生物合成,导致真菌细胞膜的结构和功能受损,同时过氧化物在细胞内大量堆积,引起真菌死亡。研究[5, 12-14]显示:麦角甾醇是棘阿米巴滋养体和包囊阶段细胞膜的主要甾醇,因此伏立康唑可能通过抑制细胞膜麦角甾醇的生物合成,导致棘阿米巴细胞膜合成障碍或通透性发生改变,虫体渗透平衡被打破,致使虫体形态改变进而死亡。研究[15]显示:采用1%伏立康唑滴眼治疗,眼部能耐受且无毒性, 在房水和血清中均未检出该药。
综上所述,伏立康唑作为抗AK药物具有一定的应用前景,值得进一步研究。
| [1] | Tawfeek GM, Bishara SA, Sarhan RM, et al. Genotypic, physiological, and biochemical characterization of potentially pathogenic Acanthamoeba isolated from the environment in Cairo, Egypt[J]. Parasitol Res, 2016, 115(5): 1871–1881. DOI:10.1007/s00436-016-4927-3 |
| [2] | 刘斐, 玄英花, 郑善子. 棘阿米巴性角膜炎治疗的研究[J]. 中国药学杂志, 2012, 47(22): 1864–1866. |
| [3] | Kilvington S, Hughes R, Byas J, et al. Activities of therapeutic agents and myristamidopropyl dimethylamine against Acanthamoeba isolates[J]. Antimicrob Agents Chemother, 2002, 46(6): 2007–2009. DOI:10.1128/AAC.46.6.2007-2009.2002 |
| [4] | 李方方, 徐燕丽, 张秀群, 等. 伏立康唑预防侵袭性真菌感染有效性及安全性的荟萃分析[J]. 中国感染与化疗杂志, 2012, 12(6): 453–458. |
| [5] | Raederstorff D, Rohmer M. Sterol biosynthesis de nova via cycloartenol by the soil ameba Acanthamoeba polyphaga[J]. BiochemJ, 1985, 231(3): 609–615. DOI:10.1042/bj2310609 |
| [6] | Kowalski RP, Abdel-Aziz S, Romanowski EG, et al. Development of a practical complete-kill assay to evaluate anti-Acanthamoeba drugs[J]. JAMA Ophthalmol, 2013, 131(11): 1459–1462. DOI:10.1001/jamaophthalmol.2013.5062 |
| [7] | Martín-Navarro CM, López-Arencibia A, Sifaoui I, et al. Statins and voriconazole induce programmed cell death in Acanthamoeba castellanii[J]. Antimicrob Agents Chemother, 2015, 59(5): 2817–2824. DOI:10.1128/AAC.00066-15 |
| [8] | Iovieno A, Miller D, Ledee DR, et al. Cysticidal activity of antifungals against different genotypes of Acanthamoeba[J]. Antimicrob Agents Chemother, 2014, 58(9): 5626–5628. DOI:10.1128/AAC.02635-14 |
| [9] | 郑善子, 申成华, 王铁, 等. 棘阿米巴的分离及实验室培养[J]. 延边大学医学学报, 2003, 26(3): 168–170. |
| [10] | Visvesvara GS. Amebic meningoencephalitides and keratitis:challenges in diagnosis and treatment[J]. Curr Opin Infecr Dis, 2010, 23(6): 590–594. DOI:10.1097/QCO.0b013e32833ed78b |
| [11] | 刘斐. 抗真菌药在体外对棘阿米巴杀伤作用的实验研究[D]. 延吉: 延边大学, 2012: 1-39. |
| [12] | Smith FR, Korn ED. 7-Dehydrostigmasterol and ergosterol:major sterols of an amoeba[J]. Lipid Res, 1968, 9(4): 405–408. |
| [13] | Mehdi H, Garg NK. Changes in the lipid composition and activities of isocitrate dehydrogenase and isocitrate lyase during encystation of Acanthamoeba culbertsoni strain A-1[J]. Trans R Soc Trop Med Hyg, 1987, 81(4): 633–636. DOI:10.1016/0035-9203(87)90437-8 |
| [14] | Mehdi H, Garg HS, Garg NK, et al. Sterols of Acanthamoeba culbertsoni strain A-1[J]. Steroids, 1988, 51(5/6): 551–558. |
| [15] | 陈祖基. 实用眼科药理学[M]. 北京: 中国科学技术出版社,1993: 148-149. |
 2017, Vol. 43
2017, Vol. 43


