扩展功能
文章信息
- 杨江辉, 孙成博, 耿嘉男, 李秋杰, 朱尧, 陈兴兴, 陈安天, 于晓艳
- YANG Jianghui, SUN Chengbo, GENG Jianan, LI Jiujie, ZHU Yao, CHEN Xingxing, CHEN Antian, YU Xiaoyan
- 五味子提取物对糖尿病大鼠肾脏组织中基质金属蛋白酶表达的影响及其肾脏保护作用
- Effect of extract of Schisandra chinensis on expression of matrix metalloproteinase in kidney tissue of diabetic rats and its protective effect on kidney tissue
- 吉林大学学报(医学版), 2017, 43(03): 512-517
- Journal of Jilin University (Medicine Edition), 2017, 43(03): 512-517
- 10.13481/j.1671-587x.20170310
-
文章历史
- 收稿日期: 2016-09-09
2. 北京清华长庚医院病理科 清华大学医学中心, 北京 102218
2. Department of Pathology, Beijing Tsinghua Changgeng Hospital, Medical Center, Tsinghua University, Beijing 102218, China
糖尿病肾病(diabetic nephropathy,DN)是糖尿病危害性最大的一种并发症,DN的病理改变为肾小球细胞外基质(extracellular matrix,ECM)积聚(基底膜增厚、系膜区扩大)。作为肾脏主要的ECM降解酶,基质金属蛋白酶(matrix metalloproteinases,MMPs)及其组织型抑制剂(tissue inhibitor of matrix metalloproteinases,TIMPs)在DN的发病中起重要作用,ECM合成和降解失衡导致ECM积聚[1-2]。五味子是木兰科植物五味子或华中五味子的干燥成熟果实,其性温,味酸、甘,归肺、心、肾经,主要有益气滋肾、生津敛汗、涩精止泻、滋补强壮和宁心安神等药理作用[3]。虽然五味子对DN的作用及其机制尚未见明确报道,但研究[4-6]显示五味子对DN小鼠的肾脏炎症、蛋白尿及小管间质纤维化等均有一定程度的影响,提示五味子可能改善糖尿病大鼠肾脏功能及组织学病变。本研究探讨五味子提取物对肾小球ECM代谢的影响,为五味子提取物治疗和改善DN提供理论基础。
1 材料与方法 1.1 实验动物、主要试剂和仪器60只雄性Wistar大鼠,体质量180~220 g,购于吉林大学实验动物中心,动物合格证号:SCXK(辽)2015-0006。五味子提取物(含2%~10%五味子总素)(湖南诺泽生物科技有限公司,批号NZ140217),链脲佐菌素(STZ,美国Sigma公司,批号15215),贝那普利(北京诺华制药厂提供,批号15116),小鼠抗大鼠纤维连接蛋白(fibronectin, FN)和Ⅳ型胶原蛋白(type Ⅳ collagen, Col Ⅳ)单克隆抗体(美国Santa Cruze公司),TIMP-2单克隆抗体(武汉三鹰生物技术有限公司),PV-6000免疫组织化学试剂盒及DAB显色试剂盒(北京中杉金桥生物技术有限公司),谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-Px)、过氧化氢酶(catalase, CAT)、超氧化物歧化酶(superoxide dismutase, SOD)和丙二醛(malondialdehyde, MDA)试剂盒(南京建成生物技术有限公司),其他试剂均为国产分析纯。LEICA-2455石蜡切片机(德国LEICA公司),病理显微照相系统(日本尼康公司),JEDA801凝胶图像处理系统(中国南京),日立7150全自动生化分析仪(日本日立公司),电泳装置(美国Bio-bad公司)。
1.2 DN模型的制备和分组大鼠适应性饲养1周,禁食12 h,单次腹腔注射2%STZ(55 mg·kg-1),1周后选择血糖水平≥ 16.67 mmol·L-1,尿糖≥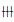
采用日立7150全自动生化分析仪检测大鼠血清中BG、血尿素氮(blood urea nitrogen, BUN)、血肌酐(serum creatinine, Scr)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol, HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein cholesterin, LDL-C)、总胆固醇(total cholesterol, T-CHO)和甘油三酯(triglyceride, TG)水平和尿白蛋白(albuminuria)及尿总蛋白(proteinuria)的排泄率。
1.4 氧化应激指标检测依照试剂盒说明书分别处理并检测大鼠血清和肾脏组织匀浆中GSH-Px、CAT、SOD活性和MDA水平。
1.5 HE和PAS染色石蜡标本切片后进行常规HE染色和PAS染色。
1.6 免疫组织化学法检测大鼠肾组织中FN、Col Ⅳ和TIMP-2表达量按照PV-6000免疫组织化学试剂盒说明书进行操作。Col Ⅳ、FN和TIMP-2一抗稀释浓度分别为1:200、1:200和1:150。封片后镜下观察。
1.7 酶谱法检测大鼠肾组织中MMP-2活性[7]取约15 mg肾皮质,于1 mL预冷样品缓冲液(1 mmol·L-1 CaCl2,100 mmol·L-1 Tris-Cl,pH 7.4) 中充分匀浆,室温1000 r·min-1离心10 min后收集上清并加入1 % TritonX-100,冻存备用。样品与4×加样缓冲液(0.5 mmol·L-1 Tris, 0.03%溴酚蓝,10% SDS, pH 6.8),按3:1的比例混合,不加热处理直接上样,经10%SDS-PAGE(分离胶中含l g·L-1底物明胶)电泳。取出底物胶, 在漂洗缓冲液中漂洗60 min,中间换液3次。漂洗后孵育缓冲液中37℃作用16 h。孵育后经考马斯亮蓝染色液染色2 h,梯度脱色直至在蓝色背景上显示透亮带,采用凝胶图像分析系统分析并读取条带的面积、宽度及灰度值,进行统计学分析。酶解量=条带面积×(背景灰度—条带灰度)。每个样品设3个平行样本,并重复实验,每次实验均设同一正常大鼠标本为参照(设酶解量为1)。
1.8 统计学分析采用SPSS 19.0统计软件进行统计学分析。各组大鼠血清中BG、BUN、Scr、HDL-C、LDL-C、T-CHO和TG水平,尿白蛋白和尿总蛋白排泄率,肾组织匀浆中GSH-Px、CAT、SOD活性和MDA水平及肾组织中MMP-2活性以x±s表示,组间比较采用单因素方差分析。以α=0.05为检验水准。
2 结果 2.1 各组大鼠一般状态、血清和尿生化指标一般状态:正常对照组大鼠皮毛浓密且光亮顺滑;模型组大鼠毛发混乱,颜色发黄,具有明显的“三多一少”症状,即多饮、多尿、多食及消瘦;五味子组和贝那普利组大鼠状态明显改善。与正常对照组比较,其他3组大鼠BG水平升高(P<0.05或P<0.01);与模型组比较,五味子组和贝那普利组大鼠BG水平略有降低,但组间比较差异无统计学意义(P>0.05)。与正常对照组比较,模型组、五味子组和贝那普利组大鼠尿白蛋白排泄率明显升高(P<0.05);与模型组比较,五味子组和贝那普利组大鼠尿白蛋白排泄率明显降低(P<0.05);五味子组与贝那普利组大鼠尿白蛋白排泄率比较差异无统计学意义(P>0.05)。尿总蛋白排泄率、BUN和Scr水平组间比较差异无统计学意义(P>0.05)。见表 1。
| (n=15, x±s) | |||||
| Group | BG [cB/(mmol·L-1)] |
BUN [cB/(mmol·L-1)] |
Scr [cB/(mmol·L-1)] |
Excretion rate | |
| Albuminuria (mg·24h-1) |
Proteinuria (mg·24h-1) |
||||
| Normal control | 8.20±1.35 | 4.10±0.46 | 36.60±2.73 | 0.20±0.11 | 30.64±21.78 |
| Model | 24.07±11.93** | 9.50±4.18 | 31.30±10.60 | 0.50±0.15* | 24.42±14.42 |
| Extract of Schisandra chinensis | 20.86±8.25** | 6.04±1.54 | 36.57±1.22 | 0.34±0.09*△ | 35.10±12.69 |
| Benazepril | 19.67±8.43* | 11.43±6.76*# | 38.15±4.52 | 0.34±0.13*△ | 16.07±8.74△ |
| *P < 0.05,** P < 0.01 compared with normal control group;△P < 0.05 compared with model group;#P < 0.05 compared with extract of Schiandra chinensis group. | |||||
与正常对照组比较,模型组大鼠血清中LDL-C和T-CHO水平明显升高(P<0.05或P<0.01);与模型组比较,五味子组大鼠血清中LDL-C水平降低(P<0.05),贝那普利组大鼠血清中T-CHO水平降低(P<0.01)。血清HDL-C和TG水平组间比较差异无统计学意义(P<0.05)。见表 2。
| [n=15, x±s, cB/(mmol·L-1)] | ||||
| Group | HDL-C | LDL-C | T-CHO | TG |
| Normal control | 1.18±0.18 | 0.36±0.55 | 1.84±0.18 | 1.09±0.34 |
| Model | 1.15±0.31 | 0.62±0.22** | 2.20±0.48* | 0.99±0.59 |
| Extract of Schisandra chinensis | 1.09±0.11 | 0.46±0.11△ | 1.99±1.83 | 0.96±0.39 |
| Bena zepril | 0.94±0.17 | 0.48±0.12 | 1.66±0.15△# | 0.87±0.74 |
| *P < 0.05,** P < 0.01 compared with normal control group;△ P < 0.05 compared with model group;#P < 0.05 compared with extract of Schisandra chinensis group. | ||||
与正常对照组比较,模型组大鼠肾组织中CAT活性明显降低(P<0.05);与模型组比较,五味子组和贝那普利组大鼠肾组织中CAT活性均升高,其中五味子组大鼠CAT活性升高的较为明显(P<0.01)。与正常对照组比较,模型组大鼠血清和肾组织中SOD活性均有降低的趋势,但差异无统计学意义(P>0.05);与模型组比较,五味子组和贝那普利组大鼠肾组织中SOD活性明显升高(P<0.01)。与正常对照组比较,模型组大鼠血清和肾组织中GSH-Px活性均明显降低(P<0.05);与模型组比较,五味子组和贝那普利组大鼠肾组织中GSH-Px活性皆升高,其中贝那普利组升高更明显(P<0.01)。与正常对照组比较,模型组大鼠血清和肾组织中MDA水平明显升高(P<0.05);与模型组比较,五味子组大鼠血清和肾组织中MDA水平明显降低(P<0.05),而贝那普利组大鼠血清MDA水平明显降低(P<0.01),肾组织中MDA水平有降低的趋势,但组间比较差异无统计学意义(P>0.05)。见表 3。
| (n=15, x±s) | |||||
| Group | CAT | SOD | |||
| Serum [λB/(U·mL-1)] |
Kidney tissue [λB/(U·g-1)] |
Serum [λB/(U·mL-1)] |
Kidney tissue [λB/(U·g-1)] |
||
| Normal control | 16.97±1.17 | 23.86±6.35 | 72.29±1.06 | 62.68±12.04 | |
| Model | 17.66±0.49 | 15.91±5.93* | 68.70±4.60 | 52.27±9.96 | |
| Extract of Schisandra chinensis | 15.70±2.33 | 33.89±3.32**△△ | 80.01±7.65△ | 86.96±25.03△△ | |
| Benazepril | 17.36±0.74 | 21.78±8.95△△ | 77.88±6.08 | 95.29±13.69**△△# | |
| Group | GSH-Px | MDA | |||
| Serum [λB/(U·mL-1)] |
Kidney tissue [λB/(U·g-1)] |
Serum [cB/(mmol·L-1)] |
Kidney tissue [mB/(mmol·g-1)] |
||
| Normal control | 890.73±48.28 | 213.53±49.78 | 11.18±1.81 | 0.85±0.14 | |
| Model | 741.23±84.54* | 153.47±27.15* | 19.18±11.27* | 1.56±1.05* | |
| Extract of Schisandra chinensis | 635.83±42.05** | 179.75±14.95** | 10.30±1.17△ | 0.79±0.15△ | |
| Benazepril | 763.94±232.49 | 311.52±144.55**△△ | 7.34±4.51△△ | 0.90±0.47 | |
| *P < 0.05,** P < 0.01 compared with normal control group;;△P < 0.05,△△P < 0.01 compared with model group;# P < 0.05 compared with extract of Schisandra chinensis group. | |||||
与正常对照组比较,模型组大鼠部分肾小球系膜细胞增生,肾小球血管壁不均匀增厚,局部肾小球系膜区PAS阳性染色物质有集聚现象;五味子组大鼠肾小球血管壁不均匀增厚、肾小球系膜聚集等现象明显减轻;贝那普利组大鼠肾小球血管壁不均匀增厚、肾小球系膜聚集等现象明显减轻。见图 1(插页一)。
|
| 图 1 各组大鼠肾小球形态表现(PAS,×400) Figure 1 Morphology of glomenli of rats in various groups(PAS, ×400) |
|
|
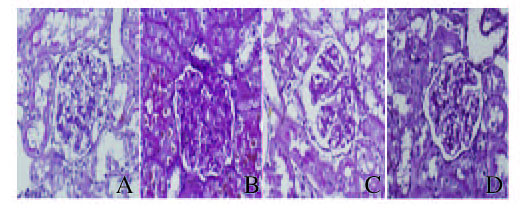
正常大鼠肾小球中有一定程度的Col Ⅳ和FN表达,多分布于毛细血管壁和系膜区。模型组大鼠二者表达量均明显增加,主要位于增厚的毛细血管管壁及增大的系膜区。与模型组比较,五味子组和贝那普利组大鼠肾组织中FN和Col Ⅳ的表达量均有一定程度的降低。见图 2和3(插页一)。
|
| A: Normal control group; B: Model group; C: Extract of Schisadra chinensis group; D: Benazepril group. 图 2 免疫组织化学染色观察各组大鼠肾组织中FN表达(×400) Figure 2 Expressions of FN in kidney tissue of rats in various groups observed with immunohistochemistry staining(×400) |
|
|
|
| A: Normal control group; B: Model group; C: Extract of Schisandra chinensis group; D: Benazepril group. 图 3 免疫组织化学染色观察各组大鼠肾组织中Col Ⅳ表达(×400) Figure 3 Expressions of Collagen Ⅳ in kidney tissue of rats in various groups observed with immunohistochemistry staining(×400) |
|
|
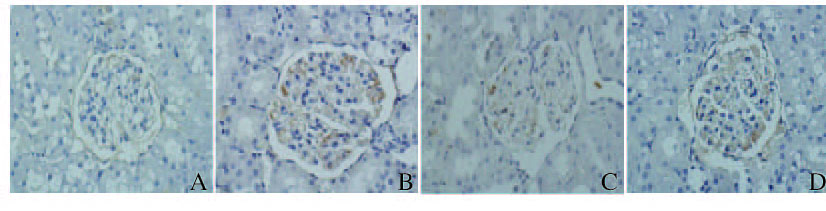
TIMP-2阳性表达颗粒主要在胞浆,正常大鼠肾小球中TIMP-2表达较少,阳性颗粒主要分布在肾小管。与正常对照组比较,模型组大鼠肾小球中TIMP-2表达量明显增多,肾小管中的表达量也有所增强;五味子组大鼠TIMP-2阳性颗粒表达量减少,而贝那普利组大鼠肾小球阳性颗粒表达量减少至趋于正常。见图 4(插页一)。
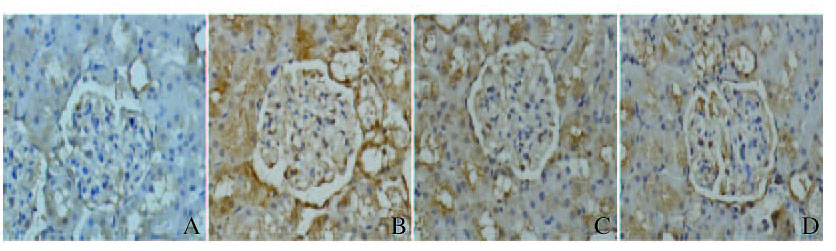
|
| A: Normal control group; B: Model group; C: Extract of Schisandra chinensis group; D: Benazepril group. 图 4 免疫组织化学染色观察各组大鼠肾组织中TIMP-2表达(×400) Figure 4 Expressions of TIMP-2 in kidney tissue of rats in various groups observed with immunohistochemistry staining(×400) |
|
|
采用酶谱法检测MMPs活性,阳性结果为蓝色背景上出现明显的透明条带。根据底物(明胶)特异性及相对分子质量标记,相对分子质量为62000的透明条带为MMP-2的活性形式,相对分子质量为72000的透明条带为MMP-2的酶原形式。采用图像分析软件计算条带酶解量。与正常对照组(活性形式:0.87±0.09;酶原形式:1.01±0.06) 比较,模型组大鼠肾组织中MMP-2的活性形式(0.09±0.03) 和酶原形式(0.31±0.05) 均明显降低(P<0.01)。与模型组比较,五味子组大鼠肾组织中MMP-2的活性形式(0.17±0.06) 升高(P<0.05),酶原形式(0.38±0.08) 差异无统计学意义(P>0.05)。与模型组比较,贝那普利组大鼠肾组织中MMP-2的活性形式(0.382±0.03) 和酶原形式(0.56±0.16) 均明显升高(P<0.01)。见图 5。

|
| Lane 1: Normal control group; Lane 2: Model group; Lane 3: Extract of Schisandra chinensis group; Lane 4: Benazepril group. 图 5 酶谱法检测各组大鼠肾组织中MMPs活性电泳图 Figure 5 MMPs activities in kidney tissue of rats in various groups |
|
|
本研究结果显示:糖尿病大鼠给予五味子提取物后,肾脏组织学病变和肾功能均有不同程度改善,与贝那普利组相近,证明五味子在一定程度上可以改善糖尿病大鼠肾脏功能及组织学病变;大鼠BG水平、血脂代谢、氧化应激水平和MMP-2/TIMP-2也都有一定程度的改善,提示五味子提取物对DN大鼠的肾脏保护作用是多方面的。
本研究未观察到五味子明显的降糖作用。与模型组比较,五味子组大鼠BG水平虽有降低趋势但组间比较差异无统计学意义。五味子中降糖效果比较明确的是五味子油[8-9],不同的研究结果关于五味子的降血糖作用并不相同,可能是不同的提取方法造成提取物中有效降糖成分如五味子油的含量或活性有所差异。本实验中五味子提取物略有降血糖趋势,但仍远高于正常水平。五味子提取物有较好的降血脂作用,既往研究者[10-11]建立了大鼠高脂血症模型,给予五味子提取物治疗,观察其对小鼠高脂血症影响的结果表明:给药组大鼠TG和LDL-C水平明显降低,接近于阳性对照组,且剂量效应关系明显,而HDL-C水平则明显升高。糖尿病患者及动物常伴有脂质代谢的紊乱,血脂升高导致肾小球血流动力学发生改变,肾小球滤过率增加,从而加重糖尿病肾脏病变。本研究证实五味子提取物对糖尿病大鼠有一定的降血脂作用。
氧化应激是导致糖尿病发生慢性并发症的最根本原因之一,由氧化应激反应产生的活性氧在DN的进展过程中有不可替代的作用,而多项研究[12-14]表明五味子具有明确的抗氧化、清除氧自由基的药理作用。刘忠民等[12]发现:五味子提取液中的五味子甲素、酯甲和五味子酚可以明显提高机体自身抗氧化酶活性和增强抗氧化能力,抑制MDA的生成。五味子可提高D-半乳糖所致衰老大鼠的血清和心肌组织的总抗氧化能力、GSH-Px和SOD活性,降低MDA水平[13]。此外,给予小鼠一定量五味子乙素和五味子酚,给药3d后其肝脏胞浆中CAT及SOD活性均明显升高[14]。本课题组检测各组大鼠血清和肾组织中CAT、GSH-Px、SOD活性和MDA水平的结果显示:五味子提取物对糖尿病大鼠多个氧化应激指标均表现出抑制氧化的保护作用,特别是肾脏组织的指标,其保护作用更为明显。
DN的特征性病变为ECM积聚,MMPs /TIMPs作为肾脏中的主要降解酶系统,是ECM积聚的重要原因之一。肾脏中含量最多的MMPs /TIMPs成分为MMP-2及其抑制剂TIMP-2。研究[15]证明:五味子乙素对二氧化硅所致大鼠矽肺中不同时间点肺组织中MMP-2和TIMP-1的表达均有一定程度的抑制作用,能在一定程度上调整MMP-2和TIMP-1的比值使其趋于平衡,具有减轻二氧化硅致矽肺大鼠肺纤维化的作用。胡杰[16]发现:五味子乙素可以降低紫外线损伤模型中凋亡基因及炎症基因的表达,同时降低MMP-1的表达量。实验[17-18]证明:五味子乙素对胃癌细胞的增殖抑制呈剂量和浓度依赖性,并可降低胃癌细胞迁移能力,这可能与下调MMP-9基因的表达有关。本研究中造模成功的DN大鼠表现出ECM积聚的各种症状,如系膜区增大、部分系膜细胞增生和基底膜增厚等,给予五味子治疗后上述症状有所缓解,其效果与贝那普利相近。酶谱法观察结果显示:与正常对照组比较,模型组大鼠肾组织中MMP-2活性明显降低;与模型组比较,五味子组大鼠肾组织中MMP-2活性明显升高。免疫组织化学检测结果表明:大鼠肾组织中有TIMP-2表达,可见糖尿病大鼠肾小球及肾小管中TIMP-2表达量明显增多,而正常肾小球中几乎不表达;给予五味子后,随给药剂量增加,TIMP-2表达量降低,提示五味子提取物可通过影响肾脏中含量最多的MMP-2 /TIMP-2降解酶系统缓解糖尿病大鼠肾脏ECM的集聚情况。
综上所述,五味子在一定程度上可以改善糖尿病大鼠肾脏功能和组织学病变,其机制是多方面的,可能与五味子的降脂和抗氧化应激作用有关,还可能与增强MMP-2活性、促进ECM降解和减少ECM积聚有关。
| [1] | Thrailkill KM, Clay Bunn R, Fowlkes JL. Matrix metalloproteinases:their potential role in the pathogenesis of diabetic nephropathy[J]. Endocrine, 2009, 35(1): 1–10. DOI:10.1007/s12020-008-9114-6 |
| [2] | Xu X, Xiao L, Xiao P, et al. A glimpse of matrix metalloproteinases in diabetic nephropathy[J]. Curr Med Chem, 2014, 21(28): 3244–3260. DOI:10.2174/0929867321666140716092052 |
| [3] | 谭圣琰. 浅谈五味子的配伍与临床应用[J]. 山西中医, 2010, 26(10): 52–53. DOI:10.3969/j.issn.1000-7156.2010.10.036 |
| [4] | 皮子凤, 门丽慧, 张静, 等. 五味子治疗大鼠糖尿病肾病作用机制的血清代谢组学研究[J]. 分析化学, 2015, 43(2): 169–175. |
| [5] | 赵君. 五味子合剂对糖尿病肾病小鼠肾脏炎症抑制作用的实验研究[D]. 天津: 天津医科大学, 2012. |
| [6] | Zhang M, Liu M, Xiong M, et al. Schisandra chinensis fruit extract attenuates albuminuria and protects podocyte integrity in a mouse model of streptozotocin-induced diabetic nephropathy[J]. J Ethnopharmacol, 2012, 141(1): 111–118. DOI:10.1016/j.jep.2012.02.007 |
| [7] | 于晓艳, 李才, 何泽, 等. 糖基化终末产物对大鼠肾皮质基质金属蛋白酶2活性和表达的影响[J]. 中华内分泌代谢杂志, 2003, 19(5): 402–405. |
| [8] | 安丽萍, 王英平, 刘晓梅, 等. 五味子油对链脲佐菌素诱导的2型糖尿病大鼠的影响[J]. 中草药, 2012, 43(3): 552–556. |
| [9] | 刘馨, 刘学政. 五味子油对2型糖尿病胰岛素抵抗大鼠的作用及机制[J]. 中国生化药物杂志, 2012, 33(6): 31. |
| [10] | 王会堂, 侯影, 叶立娜, 等. 五味子多糖提取物的降血脂功能试验[J]. 长春理工大学学报:自然科学版, 2009, 32(4): 622–624. |
| [11] | 谢明亮, 王位萍. 五味子降脂功能研究[J]. 临床合理用药杂志, 2012, 5(16): 9–10. DOI:10.3969/j.issn.1674-3296.2012.16.007 |
| [12] | 刘忠民, 陈练, 董加喜, 等. 兔脑缺氧-复氧性损伤与五味子提取液的保护作用[J]. 中草药, 1996, 27(6): 355–357. |
| [13] | 李屹, 马越娇, 张晔, 等. 五味子对衰老大鼠心肌抗氧化能力及形态学改变的影响[J]. 中国老年学杂志, 2015, 35(11). DOI:10.3969/j.issn.1005-9202.2015.11.079 |
| [14] | 刘耕陶. 氧自由基与抗氧化剂[J]. 中国药理学通报, 1988, 4(6): 324–327. |
| [15] | 郭民, 樊林花, 刘田福. 五味子乙素对实验性矽肺大鼠肺组织MMP-2和TIMP-1蛋白含量的影响[J]. 中国新药杂志, 2012, 21(9): 1059–1066. |
| [16] | 胡杰. 五味子乙素抑制UVB对HaCaT、FB细胞的损伤及机制研究[D]. 石家庄: 河北医科大学, 2011. |
| [17] | 李月珍, 武庚, 张际绯, 等. 五味子乙素B对人胃癌细胞MGC-803增殖和迁移能力的影响[J]. 牡丹江医学院学报, 2014, 35(6): 1–4. |
| [18] | Cheung K, Lu G, Sharma R, et al. BETN-terminal bromodomain inhibition selectively blocks Th17 cell differentiation and ameliorates colitis in mice[J]. Proc Natl Acad Sci USA, 2017, 114(1): 2952–2957. |
 2017, Vol. 43
2017, Vol. 43


