扩展功能
文章信息
- 孙敏英, 刘果木, 接晶, 谢飞, 翟瑞萍, 陈潭秀, 袁红艳, 台桂香
- SUN Minying, LIU Guomu, JIE Jing, XIE Fei, ZHAI Ruiping, CHEN Tanxiu, YUAN Hongyan, TAI Guixiang
- 重组MUC1-MBP融合蛋白联合R848对小鼠T细胞免疫活性的诱导作用
- Inductive effect of recombinant MUC1-MBP fusion protein combined with R848 on immune activity of T cells in mice
- 吉林大学学报(医学版), 2017, 43(03): 507-511
- Journal of Jilin University (Medicine Edition), 2017, 43(03): 507-511
- 10.13481/j.1671-587x.20170309
-
文章历史
- 收稿日期: 2016-09-19
2. 吉林大学基础医学院免疫学教研室, 吉林 长春 130021
2. Department of Immunology, School of Basic Medical Sciences, Jilin University, Changchun 130021, China
MUC1是Mucins黏蛋白家族成员, 存在于正常腺管上皮细胞及其来源的肿瘤细胞表面, 由多肽核芯(核芯肽)和侧枝糖链构成,其核芯肽胞外段为20个氨基酸(SAPD TRPAP GSTAPPA HGVT)的串联重复序列(vriable numbers tandem repeats, VNTRs)。正常组织的MUC1与肿瘤组织不同, 前者分布于腺管上皮细胞分泌极, 与免疫细胞相对隔离, 糖基化丰富; 而后者广泛分布并异常丰富地表达于癌细胞表面, 糖基化不完全, 因此暴露出正常情况下隐蔽的表位, 成为免疫细胞攻击的靶点[1-2],是制备肿瘤疫苗的理想分子。目前研制的以MUC1为靶点的疫苗包括糖疫苗、蛋白或多肽疫苗和DNA疫苗[3-5], 其中蛋白疫苗具有一定的临床应用前景。本课题组前期研究[6-7]成功构建、表达并纯化了MUC1-MBP融合蛋白,联合卡介苗(BCG)佐剂后,MUC1-MBP+BCG疫苗在药效学方面取得良好效果。BCG是减毒活疫苗,活菌对于诱导Th1应答非常重要,但是活菌数较难控制,导致疫苗稳定性较差,且高剂量BCG的不良反应较大。因此,寻找更加安全、质量可控的佐剂十分必要。随着肿瘤疫苗的深入研究,疫苗佐剂的研究也得到了发展,在众多的佐剂中,Toll样受体(Toll like receptors, TLRs)激动剂备受关注。R848是TLR7/8激动剂,能识别单链RNA(ssRNA)序列,具有抗病毒活性。研究[8]证实:TLR7/8激动剂与人类免疫缺陷病毒(human immunodeficiency virus, HIV-1) 的Gag抗原能诱导抗原特异的IgG和细胞毒性T细胞(cytotoxic lymphocyte, CTL)反应。R848和NY-ESO-1蛋白抗原对于恶性黑色素瘤作用的研究处于Ⅰ期临床阶段,作为前列腺特异性肿瘤抗原的佐剂治疗前列腺癌的研究处于Ⅰ~Ⅱ期临床阶段[9],作为HPV16 E6E7L2融合蛋白的佐剂治疗外阴癌的研究处于Ⅱ期临床阶段[10]。本研究通过MUC1-MBP联合R848免疫小鼠,探讨其在诱导MUC1特异的T细胞应答中的作用,为重组MUC1-MBP肿瘤疫苗研究提供依据。
1 材料与方法 1.1 实验动物、主要试剂和仪器21只雌性C57BL/6小鼠, 18~20 g,6~8周龄, 动物合格证号为SCXK(京)2014-0004,购自北京阜康生物科技股份有限公司。B16-MUC1由吉林大学基础医学院医学生物学实验中心建立并保存,重组MUC1-MBP由吉林大学基础医学院医学生物学实验中心重组构建及纯化[6]。BCG购自石家庄开创生化公司,R848购自上海浩然生物技术有限公司。伊思柯夫改良培养液(Iscove’s modified Dubecco’s medium,IMDM)和G418购自美国Gibco公司, FBS和小鼠淋巴细胞分层液购自天津市灏洋生物制品有限公司,白细胞介素2(IL-2) 购自美国Peprotech公司,刀豆蛋白(ConA)购自美国Sigma公司,小鼠抗人MUC1购自美国Abcam公司,FITC-山羊抗小鼠IgG购自北京中杉金桥生物技术有限公司,APC-CD3、PECy-7-CD4和PE-CD8荧光抗体均购自天津三箭生物技术有限公司,小鼠肿瘤坏死因子γ(TNF-γ)和白细胞介素4 (IL-4) ELISA检测试剂盒购自美国eBioscience公司。低温冰箱和二氧化碳孵箱购自日本SANYO公司,酶标仪购自美国BIOTEK公司,紫外分光光度计购自日本岛津公司,Accuri C6流式细胞仪购自美国BD公司。
1.2 动物分组和免疫方案将21只C57BL/6小鼠随机分为3组,每组7只,分别为对照组(注射生理盐水)、MUC1-MBP+ R848组(注射MUC1-MBP+R848) 和MUC1-MBP+BCG组(注射MUC1-MBP+BCG),其中MUC1-MBP+ BCG组作为阳性对照组。免疫方案:小鼠颈背部皮下多点注射MUC1-MBP 50 μg,BCG作为佐剂1 mg/只, R848剂量为20 μg/只,隔周1次,共注射2次。
1.3 各组小鼠脾指数测定第2次免疫后第4~7天,先称每只小鼠体质量,杀鼠,无菌取脾脏,称脾脏质量。脾指数=小鼠脾质量/体质量。
1.4 各组小鼠的刺激指数(stimulus index,SI)测定在第2次免疫后第4~7天杀鼠,无菌取脾脏、研磨、细胞计数, 制备脾细胞悬液,采用小鼠淋巴细胞分层液分离小鼠脾脏单个核细胞,采用IMDM调整细胞浓度至1×107 mL-1,每孔100μL,加入96孔板中。非特异性淋巴细胞增殖反应:实验分为阴性对照组和ConA刺激组(终浓度5mg·L-1),每组设3复孔,37 ℃、CO2培养箱中培养48 h后,加入WST-1检测试剂,每孔10 μL,继续反应1 h,通过酶标仪检测450 nm处吸光度(A)值。MUC1特异淋巴细胞增殖反应:实验分为阴性对照组、IL-2单独刺激组(终浓度100 U·mL-1)和MUC1多肽刺激组(20mg·L-1MUC1多肽+100 U·mL-1IL-2)。置于37 ℃、CO2培养箱培养3 d,半量换液,继续培养5 d后,吸取每孔细胞培养上清100μL用于细胞因子的检测,加入WST-1检测试剂(每孔10 μL),继续反应1 h,通过酶标仪检测450 nm波长处A值,SI=实验孔A值/对照孔A值。
1.5 ELISA法检测各组小鼠脾细胞培养上清中细胞因子TNF-γ和IL-4水平收集ConA刺激2 d和MUC1刺激5 d的淋巴细胞培养上清,按照TNF-γ和IL-4检测试剂盒说明书操作。以包被抗体(抗TNF-γ和IL-4的抗体)包被96孔酶标板,每个样本设双复孔,4 ℃过夜。采用PBS-0.05%Tween-20洗板5次,加入封闭液封闭1 h后,洗涤2次,加入标准品(TNF-γ:2000.000、1000.000、500.000、250.000、125.000、62.500、32.500和15.625 ng·L-1;IL-4标准品配制:500.0、250.0、125.0、62.5、32.5、15.6、7.8和3.9 ng·L-1)和样品,每孔100μL,4 ℃过夜。洗涤5次,加入检测抗体室温孵育1 h,洗涤5次,加入酶标抗体Avindin-HRP, 室温孵育30 min。洗涤7次,加入TMB,室温15 min。加入硫酸终止后,采用酶标仪于450nm波长处测定A值。
1.6 流式细胞术检测各组小鼠脾细胞中T淋巴细胞亚群比例取脾淋巴细胞1×106个加入1.5 mLEP管中,加入1 mL PBS,1500 r·min-1离心5 min,4 ℃离心,弃上清,以1:100的稀释度在各管中加入CD3-APC、CD4-PECy7和CD8-PE,并设抗体单独补偿管,冰上避光孵育,每隔15 min轻弹几次,30 min后加入1 mL PBS,1500 r·min-1离心5 min,4 ℃离心,洗涤2次后,各管加入200 μL PBS, 将细胞团吹打开成单细胞悬液,300目滤网过滤后,采用流式细胞术检测T淋巴细胞亚群的比例。
1.7 统计学分析采用Graphpad Prism 5统计软件进行统计学分析。各组小鼠脾指数,SI,脾细胞培养上清中TNF-γ、IL-4水平和脾细胞中T淋巴细胞亚群比例以x±s表示;组间样本均数比较采用t检验。以α=0.05为检验水准。
2 结果 2.1 各组小鼠脾指数和SIMUC1-MBP+R848组和MUC1-MBP+BCG组小鼠脾指数明显高于对照组(P<0.01)。非特异性淋巴细胞增殖反应:MUC1-MBP+R848组和MUC1-MBP+BCG组小鼠SI高于对照组(P<0.05),以MUC1-MBP+BCG组升高更为明显。MUC1特异淋巴增殖反应:MUC1-MBP+R848组SI接近MUC1-MBP+BCG组,且均高于对照组(P<0.05)。见表 1。
| (n=7, x±s) | |||
| Group | Spleen index | Stimulus index | Specific spleen index |
| Control | 0.0033±0.0010 | 1.4000±0.1630 | 31.5000±0.0816 |
| MUC1-MBP+BCG | 0.0052±0.0009** | 2.2000±0.3266* | 1.9860±0.3761* |
| MUC1-MBP+R848 | 0.0056±0.0065** | 1.6400±0.3593* | 1.9710±0.7521* |
| * P < 0.05, ** P < 0.01 vs control group. | |||
MUC1-MBP+R848组和MUC1-MBP+BCG组小鼠脾细胞培养上清中TNF-γ水平高于对照组(P<0.01);IL-4水平组间比较差异均无统计学意义(P>0.05)。见表 2。
| [n=7, x±s, ρB/(ng·L-1)] | ||
| Group | IFN-γ | IL-4 |
| Control | 245.00±36.74 | 56.29±10.03 |
| MUC1-MBP+ BCG | 447.90±40.91* | 65.00±12.25 |
| MUC1-MBP+ R848 | 776.40±126.00** | 81.00±8.98 |
| * P < 0.05, ** P < 0.01 vs control group. | ||
与对照组(31.8%)比较,其他2组小鼠脾脏总CD3+T淋巴细胞在脾细胞中的比例升高(P<0.05或P<0.01);MUC1-MBP+R848组为37.3%,MUC1-MBP+BCG组为42.8%。与对照组比较,其他2组小鼠脾脏总CD3+CD4+T细胞、CD3+CD8+T细胞比例有所升高(P<0.05)。CD4+T细胞:对照组为18.7%,MUC1-MBP+R848组为23.8%,MUC1-MBP+BCG组为26.7%;CD8+T细胞:对照组为12.9%,MUC1-MBP+R848组为14.4%,MUC1-MBP+BCG组为17.5%。见图 1和2。
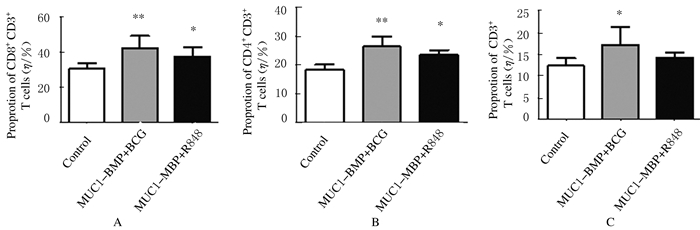
|
| A: CD3+cells; B:CD4+CD3+cells; C:CD8+CD3+cells; * P < 0.05; ** P < 0.01 vs control group. 图 1 各组小鼠脾细胞中T淋巴细胞亚群比例 Figure 1 Proprotions of T lymphocyte subsets in spleen cells of mice in various groups |
|
|
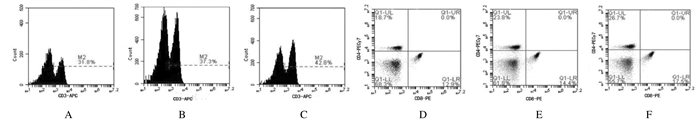
|
| A, B:Control group; C, D:MUC1-MBP+R848 group; E, F:MUC1-MBP+BCG group; A, C, E:CD3-APC; B, D, F:CD4-PECy7, CD8-PE. 图 2 流式细胞术检测各组小鼠脾细胞中T淋巴细胞亚群比例流式图 Figure 2 Flow diagram of proprotions of T lymphocyte subsets in spleen cells of mice in various groups detected by flow cytometry |
|
|
为了研究重组MUC1-MBP融合蛋白联合R848诱导小鼠T细胞免疫活性,本课题组采用重组MUC1-MBP+R848和MUC1-MBP+BCG分别免疫C57BL/6小鼠,本研究结果显示:MUC1-MBP+R848组和MUC1-MBP+BCG组小鼠的脾指数和SI升高,说明MUC1-MBP联合R848和联合BCG均可诱导非特异性淋巴细胞增殖和特异性淋巴细胞增殖。
ELISA法检测细胞培养上清中TNF-γ和IL-4水平的结果显示:MUC1-MBP+R848组和MUC1-MBP+BCG组小鼠脾细胞培养上清中TNF-γ水平高于对照组,而且以MUC1-MBP+R848组小鼠脾细胞培养上清中IFN-γ水平升高更加明显,IL-4水平变化不大,提示MUC1-MBP联合R848后强烈诱导MUC1特异性Th1型细胞活化,且效果略优于联合BCG组, 即二者不同程度诱导低水平Th2活化。为进一步分析MUC1-MBP联合R848免疫小鼠对T淋巴细胞亚群的影响,本研究采用流式细胞术检测T淋巴细胞亚群比例变化的结果显示:MUC1-MBP联合R848免疫小鼠可提高T淋巴细胞亚群的比例,其程度与MUC1-MBP联合BCG相当。
本课题组前期研究[11-12]结果显示:BCG并非是联合MUC1-MBP的最佳佐剂,其活性不易控制。随着BCG使用剂量的增加,其在动物体内产生的细胞毒性也增大,表现为体质量下降和注射部位出现坏死结节等[7]。R848是一种相对分子质量较小的咪唑喹啉类化合物,可通过TLR7/8发挥作用,目前在临床上主要用于治疗病毒感染性疾病和肿瘤[13-15]。研究[16-17]显示:R848能够促进人CD56 bright NK细胞亚群TNF-γ的产生, 并且经过R848活化的NK细胞具有杀伤功能,因此R848具有抗感染、抗肿瘤和调节免疫应答等作用。本研究结果也提示:R848诱导MUC1特异性Th1的免疫活性明显优于BCG,提示R848可作为MUC1-MBP佐剂来替代BCG。后续研究可利用荷瘤鼠模型来研究MUC1-MBP联合R848的抗肿瘤作用。
综上所述,R848能够增强抗原特异性的Th1型免疫活性。本研究结果为进一步研究人用抗肿瘤疫苗提供了实验依据,R848作为抗肿瘤疫苗佐剂具有更广阔的临床研究价值。
| [1] | Acres B, Limacher JM. MUC1 as a target antigen for cancer immunotherapy[J]. Expert Rev Vaccines, 2005, 4(4): 493–502. DOI:10.1586/14760584.4.4.493 |
| [2] | Nath S, Mukherjee P. MUC1:a multifaceted oncoprotein with a key role in cancer progression[J]. Trends Mol Med, 2014, 20(6): 332–342. DOI:10.1016/j.molmed.2014.02.007 |
| [3] | Vassilaros S, Tsibanis A, Tsikkinis A, et al. Up to 15-year clinical follow-up of a pilot phase Ⅲ immunotherapy study in stage Ⅱ breast cancer patients using oxidized mannan-MUC1[J]. Immunotherapy, 2013, 5(11): 1177–1182. DOI:10.2217/imt.13.126 |
| [4] | Quoix E, Ramlau R, Westeel V, et al. Therapeutic vaccination with TG4010 and first-line chemotherapy in advanced non-small-cell lung cancer:a controlled phase 2B trial[J]. Lancet Oncol, 2011, 12(12): 1125–1133. DOI:10.1016/S1470-2045(11)70259-5 |
| [5] | Wurz GT, Kao CJ, Wolf M, et al. Tecemotide:An antigen-specific human vaccines &immunotherapeutics[J]. Cancer Immunother, 2014, 10(11): 3383–3393. |
| [6] | Fang F, Ma J, Ni W, et al. MUC1 and maltose-binding protein recombinant fusion protein combined with Bacillus Calmette-Guerin induces MUC1-specific and nonspecific anti-tumor immunity in mice[J]. Mol Med Rep, 2014, 7(10): 1056–1064. |
| [7] | Hu B, Wang J, Guo Y, et al. Pre-clinical toxicity and immunogenicity evaluation of a MUC1-MBP/BCG anti-tumor vaccine[J]. Int Immunopharmacol, 2016, 33: 108–118. DOI:10.1016/j.intimp.2016.02.006 |
| [8] | Wille-Reece U, Flynn BJ, Loré K, et al. Toll-like receptor agonists influence the magnitude and quality of memory T cell responses after prime-boost immunization in nonhuman primates[J]. J Exp Med, 2006, 203(5): 1249–1258. DOI:10.1084/jem.20052433 |
| [9] | Steinhagen F, Kinjo T, Bode C, et al. TLR-based immune adjuvants[J]. Vaccine, 2011, 29(17): 3341–3355. DOI:10.1016/j.vaccine.2010.08.002 |
| [10] | Girart MV, Fuertes MB, Domaica CI, et al. Engagement of TLR3, TLR7, and NKG2D regulate IFN-gamma secretion but not NKG2D-mediated cytotoxicity by human NK cells stimulated with suboptimal doses of IL-12[J]. J Immunol, 2007, 179(6): 3472–3479. DOI:10.4049/jimmunol.179.6.3472 |
| [11] | 方芳. 重组MUC1-MBP融合蛋白疫苗抗肿瘤作用机制研究[D]. 长春: 吉林大学, 2010. |
| [12] | 孙霞霞. 不同佐剂对重组MUC1-MBP融合蛋白诱导的免疫活性的影响[D]. 长春: 吉林大学, 2013. |
| [13] | Fujita Y, Hirai K, Nishida K, et al. 6-(4-Amino-2-butyl-imidazoquinolyl)-norleucine:Toll-like receptor 7 and 8 agonist amino acid for self-adjuvanting peptide vaccine[J]. Amino Acids, 2016, 48(5): 1319–1329. DOI:10.1007/s00726-016-2190-7 |
| [14] | Smith AJ, Li Y, Bazin HG, et al. Evaluation of novel synthetic TLR7/8 agonists as vaccine adjuvants[J]. Vaccine, 2016, 34(36): 4304–4312. DOI:10.1016/j.vaccine.2016.06.080 |
| [15] | Wang Y, Chen K, Wu Z, et al. Immunizations with hepatitis B viral antigens and a TLR7/8 agonist adjuvant induce antigen-specific immune responses in HBV-transgenic mice[J]. Int J Infect Dis, 2014, 12(29): 31–36. |
| [16] | 尹凌凡, 范艳莹, 李丽, 等. Toll样配体(R-848) 与IL-12对人NK细胞亚群IFN-γ产生的作用[J]. 细胞与分子免疫学杂志, 2007, 23(7): 623–626. |
| [17] | 范艳莹, 付笑迎, 尹凌凡, 等. TLR7/8配体(R848) 对人NK细胞杀伤功能的作用及其机制的探讨[J]. 免疫学杂志, 2010, 26(8): 657–660. |
 2017, Vol. 43
2017, Vol. 43


