扩展功能
文章信息
- 王维, 刘聪, 蒋岩, 王松萍, 于慧, 敬舒, 庄文越, 王春梅, 陈建光, 李贺
- WANG Wei, LIU Cong, JIANG Yan, WANG Songping, YU Hui, JING Shu, ZHUANG Wenyue, WANG Chunmei, CHEN Jianguang, LI He
- 复方五味子提取物的抗疲劳作用及其机制
- Anti-fatigue effect of compound schisandra extracts in miceand its mechanism
- 吉林大学学报(医学版), 2017, 43(03): 502-506
- Journal of Jilin University (Medicine Edition), 2017, 43(03): 502-506
- 10.13481/j.1671-587x.20170308
-
文章历史
- 收稿日期: 2016-09-28
2. 北华大学附属医院普通外科, 吉林 吉林 132001
2. Department of General Surgery, Affiliated Hospital, Beihua University, Jilin 130021, China
随着社会生活节奏加快,疲劳已成为影响人类健康的重要原因。当机体在较长时间内处于疲劳状态而未得到及时缓解时,体内就会发生一系列的生理生化变化,自由基增加会使细胞损伤甚至死亡,加重疲劳状态[1],导致各种机能下降,严重时还会伤及脏腑,出现各种疾病[2],因此研发具有抗疲劳功效的保健食品意义重大。中医古方及现代药理学研究[3-6]显示:五味子(Schisandra chinensis Baill)、黄芪(Astragalus mongholicus)、刺五加(Acanthopanax senticosus)和红景天(Rhodiola rosea L.)均具有抗疲劳的功效。但目前未见关于这4味中药材混合提取物抗疲劳功效的相关报道。本研究依据中医学理论,将五味子、黄芪、刺五加和红景天4味中药组方并进行混合提取,得到五味子混合提取物(Compound Schisandra Extract, CSE),通过力竭实验观察CSE对ICR小鼠抗疲劳能力的影响,检测小鼠体内的血尿素氮(BUN)、血清乳酸(LD)、肝糖原、肌糖原、丙二醛(MDA)水平及超氧化物歧化酶(SOD)活性,探讨该中药组方提取物对小鼠疲劳的改善作用,并从抗氧化作用角度探讨其抗疲劳的作用机制。
1 材料与方法 1.1 动物、药材、主要试剂和仪器80只雄性ICR小鼠,体质量18~22 g,购自吉林大学实验动物中心,实验动物生产许可证号:SCXK(吉)2015-0005,室温(21℃±5℃)标准饲料喂养。黄芪和红景天购自河北祁新中药饮片公司,刺五加购自山东嘉泰中药饮片有限公司,五味子购自吉林省集安市五味子种植基地,五味子、黄芪、刺五加和红景天的CSE由北华大学五味子开发及产业化工程研究中心提供。无水乙醇(分析纯)购自天津永大试剂公司,硫氰酸铵(分析纯)、亚氯化铁(分析纯)、亚油酸(分析纯)、磷酸二氢钾(分析纯)和磷酸氢二钾(分析纯)等购自国药化学试剂公司,BUN、LD、肝糖原、肌糖原、SOD及MDA检测试剂盒购自南京建成生物研究所。全自动酶标仪(Infinite M 200) 购自瑞士TECAN集团公司,可调温电加热套(KDM)购自江苏省金坛市金祥龙电子有限公司。
1.2 动物分组和给药方法将80只健康雄性ICR小鼠随机分为空白对照组、50 mg·kg-1 CSE组、100 mg·kg-1 CSE组和200 mg·kg-1 CSE组,每组各20只。给药量参照《中国药典》2015年修订版,按规定成人1 d服用的生药量进行换算,折算成小鼠服用剂量分别为50、100和200 mg·kg-1,灌胃给药;空白对照组小鼠以蒸馏水灌胃。连续给药30 d。
1.3 小鼠力竭游泳时间的测定在小鼠末次灌胃30 min后,每组随机选取10只小鼠,在小鼠尾部负荷相对于体质量5%的铅块,置于水深30 cm、于(25±5)℃的游泳箱中负重游泳。以小鼠游泳至头部深入水中10 s不再浮起结束,记录小鼠力竭游泳时间。
1.4 小鼠BUN和LD水平测定参照《保健食品功能学评价程序和方法》中《抗疲劳作用检验方法》进行实验。连续给药30 d,于末次给药后30 min,分别将每组另外10只小鼠置于水温为25℃、水深为30 cm的游泳箱中游泳90 min。再经过60 min的休息后,摘取小鼠眼球取血,置于肝素钠处理过的离心管,4 000 r·min-1离心10 min,分离血清,采用血清BUN和LD试剂盒分别检测各组小鼠血清BUN和LD水平。
1.5 小鼠肝糖原与肌糖原水平的测定将1.4中取血后的小鼠去肝脏与大腿肌肉组织,置于冰冷生理盐水中,剔除脂肪与结缔组织,采用滤纸吸干水分,分别用肝糖原测定试剂盒与肌糖原测定试剂盒测定小鼠肝糖原和肌糖原水平。
1.6 小鼠血清SOD活性和MDA水平测定应用SOD及MDA试剂盒分别检测各组小鼠血清SOD活性和MDA水平。
1.7 总氧化抑制率的测定按照亚油酸-硫氰酸铁法[7-8],对CSE进行抗氧化活性研究。分别将200 μL维生素C、蒸馏水和不同浓度CSE加入2.5 mL磷酸盐缓冲液中,充分混合后加入2.5 mL亚油酸乳状液,置于37℃培养箱中培养24 h即为供试液。分别取各组供试液200 μL,加入4.5 mL乙醇中(75%),加入200 μL硫氰酸铵(30%),充分混匀后,加入300 μL氯化亚铁溶液,10 min中内测量500 nm处其吸光度(A)值。氧化抑制率=(空白试样A值-样品试样A值)/空白试样A值×100%。
1.8 统计学分析采用SPSS 19.0统计软件进行统计学分析。各组小鼠力竭游泳时间,血清BUN、LD、肝糖原和肌糖原水平,血清SOD活性和MDA水平以x±s表示; 组间均数比较采用t检验。以α=0.05为检验水准。
2 结果 2.1 各组小鼠力竭游泳时间与空白对照组[(180.6±35.1) min]比较,50、100和200 mg·kg-1 CSE组小鼠力竭游泳时间[(236.3±44.1)、(252.9±61.4) 和(297.9±64.7) min]均明显延长(P < 0.01)。
2.2 各组小鼠血清BUN和LD水平与空白对照组比较,100和200 mg·kg-1 CSE组小鼠血清LD水平明显降低(P < 0.01);50、100和200 mg·kg-1 CSE组小鼠血清BUN水平均明显降低(P < 0.05或P < 0.01);50 mg·kg-1 CSE组小鼠血清BUN和LD水平高于100及200 mg·kg-1 CSE组(P < 0.05或P < 0.01);100 mg·kg-1 CSE组小鼠血清BUN和LD水平高于200 mg·kg-1 CSE组(P < 0.05或P < 0.01)。见表 1。
| [n=10, x±s, cB/(mmol·L-1)] | ||
| Group | BUN | LD |
| Blank control | 9.03±0.46 | 7.52±0.38 |
| CSE(mg·kg-1) | ||
| 50 | 7.48±1.05* | 7.20±0.65 |
| 100 | 5.50±1.10**△△ | 6.57±0.59**△ |
| 200 | 4.43±1.15**△△# | 6.00±0.30**△△## |
| *P < 0.05, ** P < 0.01 compared with blank control group; △P < 0.05, △△P < 0.01 compared with 50 mg·kg-1 CSE group; #P < 0.05, ##P < 0.01 compared with 100mg·kg-1 CSE group. | ||
与空白对照组比较,100和200 mg·kg-1 CSE组小鼠肝糖原水平明显升高(P < 0.01), 50、100和200 mg·kg-1 CSE组小鼠肌糖原水平均明显升高(P < 0.05或P < 0.01);100和200mg·kg-1 CSE组小鼠肝糖原和肌糖元水平高于50 mg·kg-1 CSE组(P < 0.05);200mg·kg-1 CSE组小鼠肝糖原和肌糖元水平高于100 mg·kg-1 CSE组(P < 0.05)。见表 2。
| [n=10, x±s, wB/(mg·L-1)] | |||
| Group | Liver glycogen | Muscle glycogen | |
| Blank control | 6.58±0.52 | 2.26±0.14 | |
| GSE(mg·kg-1) | |||
| 50 | 6.72±0.48 | 2.52±0.31* | |
| 100 | 7.16±0.40**△ | 2.75±0.16**△ | |
| 200 | 8.39±1.35**△# | 3.11±0.37**△# | |
| *P < 0.05, ** P < 0.01 compared with blank control group;△P < 0.05 compared with 50 mg·kg-1 CSE group;#P < 0.05 compared with 100 mg·kg-1 CSE group. | |||
与空白对照组比较,100和200 mg·kg-1 CSE组小鼠血清SOD活性明显升高(P < 0.01),MDA水平明显降低(P < 0.05或P < 0.01)。见表 3。
| [n=10, x±s] | ||
| Group | SOD [λB/(U·mL-1)] |
MDA [cB/(mmol·L-1)] |
| Blank control | 181.17±10.69 | 3.19 ±0.15 |
| CSE(mg·kg-1) | ||
| 50 | 190.16±19.23 | 2.67±0.12 |
| 100 | 211.98±11.13** | 2.41±0.15* |
| 200 | 219.67±15.22** | 2.39±0.21** |
| * P < 0.05, ** P < 0.01 compared with blank control group. | ||
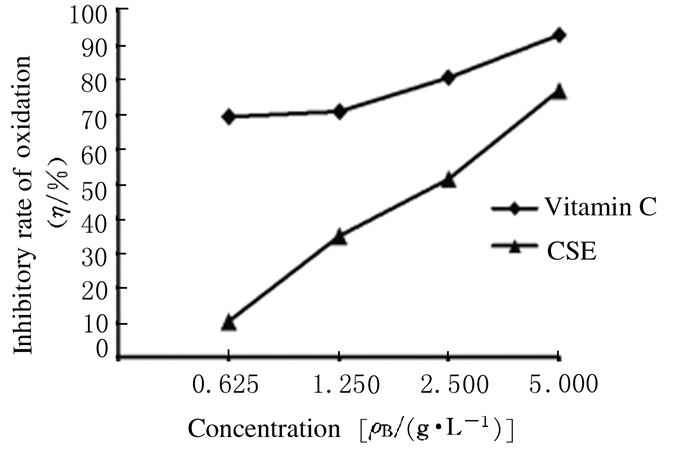
在CSE浓度为5 g·L-1时, CSE的氧化抑制率可达76.94%,与同等剂量维生素C的氧化抑制率只相差约16%。而随着CSE浓度的降低,CSE的氧化抑制率也随之降低,CSE浓度为0.625 g·L-1时, CSE的氧化抑制率只有10.19%,与同等剂量的维生素C相差约59%。见图 1。
|
| 图 1 CSE与维生素C的氧化抑制率 Figure 1 Inhibitory rates of oxidation of CSE and vitamin C |
|
|
我国传统医学对疲劳早有认识。根据病因、病机和临床表现,慢性疲劳综合征可归属于中医学“虚劳”范畴。汉代张仲景《金匮要略·血痹虚劳病脉证并治》首次将“虚劳”作为病名提出,后世医家在古籍文献中常将其描述为“劳倦”、“倦怠”、“乏力”、“神疲”、“困倦”和“懈怠”等[9]。明代张景岳认为虚劳是一个渐进的过程,《景岳全书》指出:“凡虚损不愈,则日甚成劳矣”。吴谦所著《医宗金鉴》认为:“虚者,阴阳、气血、营卫、精神、骨髓、津液不足是也;损者,外而皮、脉、筋、骨,内而肺、心、脾、肝、肾消损也”,提出虚劳与气血阴阳、五脏六腑有关。疲劳的产生与机体中的BUN、LD及糖原等物质有着十分密切的关系:运动时糖代谢供给肌肉组织的大部分能量。肌糖原的储量是决定耐力的重要因素,运动时随着肌糖原消耗的不断增加,机体将动用肝糖原以维持血糖水平而导致肝糖原水平降低,因此肝糖原和肌糖原水平是反映疲劳程度的敏感指标。在剧烈运动时,机体无氧酵解速度加快,将产生大量LD,导致血液的pH值降低,进而影响体内各种酶活力,并降低Ca2+的转移及肌钙蛋白对Ca2+的结合能力,从而降低肌肉功能,产生疲劳。血清BUN水平是反映蛋白质分解代谢的重要指标,机体血清BUN水平随着运动负荷的增加而升高,血清BUN的水平越高,代表机体对运动负荷的适应能力越差[10-13]。
本研究选用五味子、黄芪、刺五加和红景天混合水提物,其主要成分为多糖及皂苷类化合物。现代药理学研究[14]显示:五味子中的多糖类通过增加机体乳酸脱氢酶的活性,减少机体乳酸的积累,并且提高机体的耐缺氧能力,从而起到延缓机体疲劳的功效;黄芪中的黄芪皂苷类和多糖类成分具有清除自由基的能力和抗氧化活性,可以明显降低血清中乳酸水平,改善机体有氧供能的能力,因此该类成分可能通过减少氧自由基对机体的损害[15],延缓疲劳发生;刺五加茎中的皂苷类成分可以使机体的摄氧量增加,并降低CO2的生成量,从而使脂肪对运动供能上升,从而降低了对机体糖原的分解[16];红景天中的皂苷成分可以减少蛋白质功能比例,从而减少BUN的生成[17]。本研究结果显示:CSE能够增加小鼠力竭游泳时间,能够降低90 min游泳后小鼠肝糖原及肌糖原水平,降低其血清LD及BUN水平,且CSE对肝糖原、肌糖原、血清LD及BUN水平影响存在剂量依赖性,提示CSE确实具有抗疲劳作用,且该作用可能存在剂量依赖性。
研究[18-19]显示:机体疲劳的产生与机体的脂质过氧化作用有关联,SOD和MDA作为机体内的抗氧化指标,可以反映机体的抗氧化能力与氧化损伤程度。本研究结果显示:CSE能够明显增加小鼠血清SOD活性,并且减少MDA水平,提示CSE可能通过抗氧化作用发挥抗疲劳功能。为了进一步验证CSE的抗氧化功能,本研究采用亚油酸-硫氰酸铁法对其抗氧化作用的体外实验结果显示:在CSE浓度为5 g·L-1时,CSE的氧化抑制率可以达到76.94%,具有较强的抗氧化作用,提示CSE的抗氧化作用可能是其发挥抗疲劳作用的重要机制之一,其具体机制将在后续的工作中进行深入研究。综上所述,CSE具有抗疲劳作用,且该作用可能与其抗氧化功能有关。本研究结果为开发具有抗疲劳功能的药物和保健食品提供了理论依据。
| [1] | 张颖捷, 杜万红. 国内外抗疲劳研究进展[J]. 实用预防医学, 2012, 19(7): 1112–1116. |
| [2] | 张陵, 万宁. 氧自由基脂质过氧化反应所致运动性疲劳产生机制研究进展[J]. 中国实验诊断学, 2006, 10(6): 1104–1108. |
| [3] | 李妍, 刘玉莲, 纪朋艳, 等. 五味子提取物对微波辐射引起大鼠肝细胞氧化应激损伤的预防作用[J]. 吉林大学学报:医学版, 2013, 39(6): 1173–1176. |
| [4] | 李姗姗, 袁婧, 吴剑平, 等. 黄芪多糖抗小鼠疲劳的作用机制研究[J]. 现代医学生物进展, 2014, 36(14): 7052–7055. |
| [5] | 丛登立, 王浩天, 高笑一, 等. 刺五加果的抗疲劳作用[J]. 吉林大学学报:医学版, 2010, 36(5): 891–894. |
| [6] | 袁林, 吴军林, 吴清平. 红景天提高缺氧耐受力研究及应用进展[J]. 食品工业科技, 2015, 36(23): 376–385. |
| [7] | 王会, 郭立, 谢文磊. 抗氧化剂抗氧化活性的测定方法(一)[J]. 食品与发酵工业, 2006(3): 92–98. |
| [8] | 王会, 郭立, 谢文磊. 抗氧化剂抗氧化活性的测定方法(二)[J]. 食品与发酵工业, 2006(4): 98–102. |
| [9] | 周宝宽, 李德新. 中医疲劳术语整理研究[J]. 中国中医基础医学杂志, 2003, 9(3): 8–11. |
| [10] | 石娟, 赵煜, 雷杨, 等. 黄精粗多糖抗疲劳抗氧化作用的研究[J]. 时珍国医国药, 2011, 22(6): 1409–1410. |
| [11] | 侯潇, 高健, 李春雨, 等. 马鹿角蛋白酶解物的抗氧化、抗疲劳和免疫活性[J]. 食品科学, 2013, 34(9): 305–309. DOI:10.7506/spkx1002-6630-201309062 |
| [12] | 孟庆焕. 牡丹种皮黄酮提取分离与抗氧化及抗疲劳作用研究[D]. 哈尔滨: 东北林业大学, 2013. |
| [13] | 鲍蕾蕾, 陈海飞, 卞俊, 等. 复方灵芝孢子精油软胶囊抗疲劳耐缺氧能力研究[J]. 中国实验方剂学杂志, 2014, 20(14): 130–133. |
| [14] | 张占英, 许书琦. 北五味子多糖对小鼠抗疲劳和耐缺氧的作用[J]. 东北林业大学学报, 2011, 39(12): 98–103. DOI:10.3969/j.issn.1000-5382.2011.12.030 |
| [15] | 武云, 吴大正, 胡之璧. 黄芪提取物对大鼠负重力竭游泳的抗疲劳作用[J]. 上海中医药大学学报, 2008, 22(1): 36–39. |
| [16] | 徐峰, 赵江燕, 刘天硕. 刺五加提取物抗疲劳作用的研究[J]. 食品科学, 2005, 26(9): 453–456. |
| [17] | 李彬, 彭亮, 张洁宏, 等. 红景天提高小鼠抗疲劳和耐缺氧能力的研究[J]. 食品科技, 2014, 39(8): 67–70. |
| [18] | Liu Y, Zhang HG, Li XH. A Chinese herbal decoction, Danggui Buxue Tang, improves chronic fatigue syndrome induced by food restriction and forced swimming in rats[J]. Phytother Res, 2011, 25(12): 1825–1832. DOI:10.1002/ptr.v25.12 |
| [19] | 刘英伟, 刘忠民, 王浩天, 等. 枸杞多糖和1, 6-二磷酸果糖协同抗运动疲劳作用及其机制[J]. 吉林大学学报; 医学版, 2012, 38(4): 692–695. |
 2017, Vol. 43
2017, Vol. 43


