扩展功能
文章信息
- 郑洋洋, 代东雪, 潘志, 唐成芳, 王颖航
- ZHENG Yangyang, DAI Dongxue, PAN Zhi, TANG Chengfang, WANG Yinghang
- 红景天苷对TNF-α诱导的人类风湿关节炎成纤维样滑膜细胞增殖的抑制作用及其意义
- Inhibitory effect of salidroside on proliferation of HFLS-RA induced by TNF-α and its significance
- 吉林大学学报(医学版), 2017, 43(03): 485-490
- Journal of Jilin University (Medicine Edition), 2017, 43(03): 485-490
- 10.13481/j.1671-587x.20170305
-
文章历史
- 收稿日期: 2016-07-25
2. 长春中医药大学中医药与生物工程研发中心, 吉林 长春 130117;
3. 长春中医药大学附属医院风湿科, 吉林 长春 130021
2. Research and Development Center of Traditional Chinese Medicine and Bioengineering, Changchun University of Chinese Medicine, Changchun 130117, China;
3. Department of Rheumatism, Affiliated Hospital, Changchun University of Chinese Medicine, Changchun 130021, China
类风湿关节炎(rheumatoid arthritis, RA)是一种以关节滑膜炎症为主要特点的慢性系统性自身免疫性疾病[1-2], 临床表现为与慢性微炎症反应直接相关的关节肿胀和疼痛,软骨损伤,关节间隙变窄,关节僵直、畸形和功能障碍[3-4]。发达国家RA年患病率为0.5%~1.0%,在发展中国家为0.05‰~0.50‰[5]。RA的病因尚不清楚,但是目前认为基因因素可能是其发病的主要原因,例如人类白细胞抗原DR4(human leukocyte antigen-DR4,HLA-DR4) 及其他非HLA基因,包括蛋白酪氨酸磷酸酶、非受体型22和肽基精氨酸脱亚胺酶4 [6-7]。Wnt信号通路是细胞增殖分化的关键调控通路之一,与器官和组织的早期发育、肿瘤的发生以及骨代谢等人体多种生理病理过程有密切联系。β-catenin可直接激活Wnt信号通路,此外,β-catenin对基因转录和细胞间黏附有双重调节作用[8], 并作为钙黏蛋白复合体的组成成分之一,参与细胞极性的胞内信号传导,可间接作用于Wnt信号通路[9]。Wnt/β-catenin信号通路是经典的Wnt信号传导通路,也是目前研究的最详细和最重要的Wnt信号通路,其可通过影响成纤维样滑膜细胞(fibroblast-like synoviocytes,FLS)的增殖、调控炎症因子的分泌和调节骨代谢/骨破坏等途径影响RA的病理过程及预后[10]。
红景天是治疗RA的常用中药,临床疗效确切,探讨红景天治疗RA的机制和作用靶点可为进一步开发该药物及缓解RA患者的症状及体征提供依据。红景天苷为红景天的主要成分之一,由于其在红景天中含量较高,常被用来评价红景天的药用价值。红景天应用于RA的治疗缺乏实验研究,因此其作用机制尚不明确。为揭示红景天苷在分子水平上对RA的影响,本实验以Wnt/β-catenin信号通路为契点,观察红景天苷对肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)诱导的人类风湿关节炎成纤维样滑膜细胞(fibroblast-like synoviocytes with rheumatoid arthritis in human,HFLS-RA)的干预效应。
1 材料与方法 1.1 细胞、主要试剂和仪器HFLS-RA(北京北纳创联生物技术研究院)。红景天苷标准品(吉林省食品药品检验所),TNF-α(美国PEPROTECH公司),MTT(北京鼎国昌盛生物有限公司),DMSO(美国Sigma公司),ELISA试剂盒(南京森贝伽生物科技有限公司),BCA蛋白测定试剂盒(中国碧云天生物有限公司),抗β-catenin单克隆抗体(Abcam公司),β-actin抗体(艾美捷科技有限公司)。超净工作台(苏州净化公司),二氧化碳恒温培养箱(日本SANYO公司),倒置显微镜XDS-100C型(上海蔡康光学仪器有限公司),酶标仪RT6000型(美国Rayto公司),微量振荡器ZW-A型(江苏省金坛市荣华仪器制造有限公司),智能高速冷冻离心机(湖南赫西仪器装备有限公司),电泳仪(美国WEALTEC有限公司)。
1.2 细胞培养和分组细胞随机分为6组。正常对照组:无血清培养基培养细胞;模型对照组:10.0μg·L-1TNF-α;12.5μmol·L-1红景天苷组:10.0 μg·L-1 TNF-α+12.5μ mol·L-1红景天苷;25.0 μmol·L-1红景天苷组:10.0 μg·L-1TNF-α+25.0 μmol·L-1红景天苷;50.0 μmol·L-1红景天苷组: 10.0 μg·L-1TNF-α+ 50.0 μmol·L-1红景天苷;100.0 μmol·L-1红景天苷组:10.0 μg·L-1 TNF-α+100.0 μmol·L-1红景天苷。
1.3 MTT法检测HFLS-RA增殖活力取对数生长期细胞,采用2.5 g·L-1胰蛋白酶消化细胞,制成浓度为1×104 mL-1细胞悬液,接种于96孔板,每孔200 μL,置于5% CO2、37℃恒温箱培养中培养24 h,同步化24 h,药物干预后再培养48 h,弃去上清液,每孔加入浓度为5 g·L-1MTT20μL,反应4 h,加入150 μL DMSO,于波长490 nm处测吸光度(A)值。细胞增殖活力=实验组A值/正常对照组的A值×100%。
1.4 ELISA法检测HFLS-RA上清液中β-catenin、基质金属蛋白酶7(matrix metalloproteinase-7,MMP-7) 和Cyclin-D1的表达水平① 收集样品:将HFLS-RA以1×105mL-1密度接种至6孔板中,细胞达到约80%融合后,同步化24 h,再培养48 h,吸取各组上清液,3 000 r·min-1离心10 min,分装到无菌管中,置于-20℃保存,避免反复冻融。② 标准品的稀释与加样:在酶标板上设标准孔10孔,在第1和2孔分别加入标准品100 μL,再加入标准品稀释液50μL,混匀;然后从第1和2孔各取100μL分别加入到第3和4孔,同上操作后,从第3和4孔各取50 μL弃掉,再各取50 μL加入到第5和6孔;在第5和6孔加标准品稀释液50 μL标准品稀释液,混匀;第7~10孔操作同第5和6孔,第9和10孔加毕标准品稀释液混匀后,各取50 μL弃掉。③ 加样:分别设空白孔和待测样品孔。在酶标包被板上待测样品孔先加样品稀释液40 μL,再加待测样品10 μL。将样品加于酶标板底部,尽量不触及孔壁,轻轻晃动混匀。④ 温育和洗涤:用封板膜封板后置37℃温育30 min。将30倍浓缩洗涤液用蒸馏水30倍稀释;小心揭去封板膜,弃掉液体,甩干,每孔加满洗涤液,静置30 s后弃去,如此反复洗涤5次,拍干。⑤ 加酶:每孔加入酶标试剂50 μL,空白孔除外。温育和洗涤:同上述④ 和⑤。⑥ 显色:每孔先加入50 μL显色剂A,再加50 μL显色剂B,轻轻震荡混匀,37℃避光显色15 min。⑦ 终止:每孔加入50 μL终止液,终止反应。⑧ 测定A值:以空白孔调零,450 nm波长处测量各孔的A值。测定应在加终止液15 min内进行。⑨ 计算样品中蛋白表达水平。
1.5 Western blotting法检测细胞中β-catenin蛋白表达水平① 蛋白提取:胰酶消化制成细胞悬液,转移到离心管中,2 000 r·min-1离心5 min收集细胞。然后轻轻吸去液体,加入4℃预冷的PBS,轻轻吹打清洗细胞,再按前法离心。重复以上操作2次,共洗涤细胞3次以洗去培养液。每个离心管加入100 μL含PMSF的裂解液,于4℃冰箱裂解30 min(为使细胞充分裂解培养瓶要经常来回摇动)。裂解完后,于4℃、12 000 r·min-1离心5 min。② 蛋白变性:在每个离心管中加入等体积的5×SDS上样缓冲液(按照上样缓冲液与蛋白提取液1:4的体积比例),小心吹打混匀,沸水中加热5 min使蛋白变性,然后将其分装,保存于-20℃冰箱。③ 蛋白浓度测定:具体方法见BCA蛋白浓度测定试剂盒。④ SDS-PAGE电泳:浓缩胶浓度5%,电压80 V、30 min,分离胶浓度12%,电压120 V、100 min。⑤ 转膜:湿转法将蛋白转移到PVDF膜上,条件为70 V、120 min。⑥ 封闭:5%脱脂奶粉室温封闭2h, 用TBST洗膜3次,每次10 min。⑦ 免疫反应:加入β-actin(1:2 000)、β-catenin(1:2 000) 稀释液,4℃冰箱孵育过夜,TBST洗膜,加入二抗(1:2 000),室温下孵育2 h。⑧ 化学发光、显影、定影:取出膜后洗涤3次,加入超敏ECL发光液并置于暗盒中压片,再将X光片置于显影液和定影液中显色。自来水清洗后晾干,扫描仪扫描成像。⑨ 凝胶图像分析:采用Image J软件对蛋白进行灰度分析。以β-actin作为对照,计算各组β-catenin蛋白的表达水平。蛋白表达水平=待测蛋白灰度值/β-actin灰度值。
1.6 统计学分析采用SPSS19.0统计软件进行统计学分析。各组HFLS-RA的增殖活力、细胞上清液中β-catenin、MMP-7和Cyclin-D1的表达水平和细胞中β-catenin蛋白的表达水平以x±s表示,多组定量资料的比较采用单因素方差分析,组间均数比较采用LSD法。以α=0.05为检验水准。
2 结果 2.1 HFLS-RA增殖活力设正常对照组HFLS-RA增殖活力为100%,模型对照组细胞增殖活力为(111.40±5.12)%;12.5、25.0、50.0和100.0 μmol·L-1红景天苷组细胞增殖活力分别为(108.60±4.65)%、(107.21±8.84)%、(105.58± 7.44)%和(104.65±6.51)%。与正常对照组比较,模型对照组细胞增殖活力明显上升(P<0.05)。与模型对照组比较,12.5和25.0 μmol·L-1红景天苷组细胞增殖活力虽下降,但差异无统计学意义(P>0.05);50.0和100.0 μmol·L-1红景天苷组细胞增殖活力下降(P<0.05)。但50.0 μmol·L-1红景天苷组与100.0μmol·L-1红景天苷组细胞增殖活力比较差异无统计学意义(P>0.05)。
2.2 HFLS-RA上清液中β-catenin、MMP-7和Cyclin-D1表达水平与正常对照组比较,模型对照组细胞上清液中β-catenin、MMP-7和Cyclin-D1表达水平明显升高(P<0.05)。与模型对照组比较,12.5和25.0μmol·L-1红景天苷组细胞上清液中β-catenin、MMP-7和Cyclin-D1表达水平虽降低,但组间比较差异无统计学意义(P>0.05);50.0和100.0μmol·L-1红景天苷组细胞上清液中β-catenin、MMP-7和Cyclin-D1表达水平明显降低(P<0.05)。见表 1。
| (n=5, x±s) | |||
| Group | β-catenin[ρB/(ng·L-1)] | MMP-7[ρB/(μg·L-1)] | Cyclin-D1[ρB/(μg·L-1)] |
| Normal control | 23.979±4.547 | 1.429±0.075 | 1.061±0.062 |
| Model control | 29.204±5.259* | 1.633±0.228* | 1.238±0.111* |
| Salidroside(μmol·L-1) | |||
| 12.5 | 27.413±4.239 | 1.534±0.115 | 1.163±0.104 |
| 25.0 | 27.913±1.151 | 1.528±0.142 | 1.147±0.133 |
| 50.0 | 24.271±4.776△ | 1.414±0.094△ | 1.100±0.131△ |
| 100.0 | 23.287±2.202△ | 1.250±0.069△ | 1.078±0.085△ |
| * P < 0.05 vs normal control group; △P < 0.05 vs model control group. | |||
TNF-α作用于HFLS-RA后,β-catenin蛋白表达水平明显升高,用红景天苷再处理后,随着红景天苷浓度的增加,β-catenin蛋白表达水平呈降低趋势,见图 1A。与正常对照组比较,模型对照组细胞中β-catenin蛋白表达水平明显升高(P<0.01)。与模型对照组比较,12.5和25.0μmol·L-1红景天苷组细胞中β-catenin蛋白表达水平虽降低,但组间比较差异无统计学意义(P>0.05);50.0和100.0μmol·L-1红景天苷组细胞中β-catenin蛋白表达水平明显降低(P<0.05)。见图 1B。
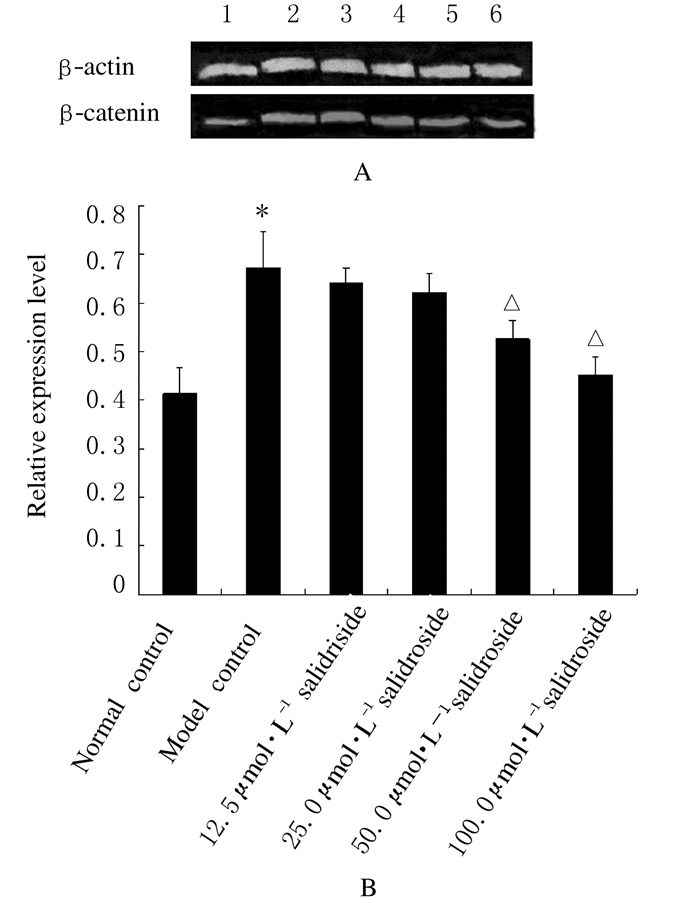
|
| Lane 1:Normal control group; Lane 2:Model control group; Lane 3-6:12.5, 25.0, 50.0, and 100.0 μmol·L-1 salidroside groups.*P < 0.01 vs normal control group; △P < 0.05 vs model control group. 图 1 各组HFLS-RA中β-catenin蛋白表达电泳图(A)和相对表达水平(B) Figure 1 Electrophoregram(A)and relative expression levels(B)of β-catenin protein in HFLS-RA in various groups |
|
|
红景天为景天科红景天属多年生草本植物, 始载于公元8世纪藏文医籍《月王药珍》, 藏医药经典《四部医典》也有记载,具有润肺、补肾、扶正固本、理气养血、健脑益智和滋补强身的功效。现代研究[11]表明:红景天具有抗衰老、抗缺氧、抗疲劳、抗病毒、抗肿瘤、保护心肌、均衡调节中枢神经、抗应激和增强机体免疫功能等作用。红景天苷作为其最重要的成分之一,具有类似的生物活性。此外,药理学研究[12]显示:红景天水和醇提取物属于无毒或低毒制剂。红景天及其制剂为RA的常用药。研究[13]显示:大株红景天联合益赛普治疗老年性RA时其改善关节疼痛数、关节肿胀数、晨僵时间、双手平均握力、血沉、类风湿因子、C-反应蛋白水平等方面均明显优于单纯注射益赛普。
RA的病理发展受以下因素的影响,如环境、细胞通路的激活、病毒感染、基因、激素和心理状态等[14],RA产生的严重并发症、关节破坏甚至功能丧失可导致患者病死率的增加。滑膜组织增生是RA的主要特点之一,尽管滑膜内层组织中出现了炎症细胞的浸润,但是RA患者FLS的增殖和凋亡平衡失调,使FLS不断地“肿瘤样”增生,是造成滑膜组织增生和关节结构破坏的主要原因[15]。本研究采用TNF-α处理HFLS-RA,给予红景天苷干预结果表明:经TNF-α诱导后,HFLS-RA增殖活力明显升高,随着红景天苷浓度的增加,HFLS-RA增殖活力逐渐降低,红景天苷作用浓度与细胞增殖活力之间存在依赖关系。
研究[16]显示:RA患者FLS中β-catenin的表达水平升高,激活Wnt信号通路,从而使FLS激活;此外β-catenin在胞核内大量累积,启动了靶基因MMP-7和Cyclin-D1等转录。Cyclin-D1在许多细胞系中可以作为多种转录因子的辅助因子调节细胞由G1期向S期过渡,进而完成细胞周期及功能。正常细胞中Cyclin-D1受到严格的控制,Cyclin-D1通过与其配体(CDK4) 结合发挥生物学效应,Cyclin-D1过度表达则会缩短G1期间隔,降低细胞对促细胞分裂剂的依赖性,从而促进细胞增殖。基质金属蛋白酶(matrix metalloproteinases,MMPs)广泛存在于各种结缔组织中, 能降解大多数的细胞外基质(excetral cellular matrix,ECM)成分。ECM是维持骨组织结构完整的重要成分,MMPs对ECM的降解是RA患者关节破坏的必要环节。正常情况下, 金属蛋白酶组织抑制剂(tissue inhibitors of MMPs, TIMPs)和MMPs以1:1不可逆结合, 对MMPs起抑制作用, 使ECM始终处于降解速度低于更新速度的状态,调节关节重塑和软骨表型,对骨软骨生长、关节软骨的形成和出生后软骨成熟起着重要调节作用。MMP-7是MMPs家族中重要的成员,缺少其他成员共有的c-末端血红素样结构,对TIMPs几乎不起作用;另外,MMP-7能激活其他成员,有广谱的降解底物作用[17-18]。本研究结果显示:经TNF-α处理后,HFLS-RA中β-catenin、MMP-7和Cyclin-D1的分泌增加,细胞中β-catenin蛋白的表达水平升高,随着红景天苷浓度的增加,β-catenin、MMP-7和Cyclin-D1的分泌减少,β-catenin蛋白表达水平降低。
综上所述,红景天苷可抑制TNF-α诱导的HFLS-RA增殖,通过调控Wnt/β-catenin信号通路,从而明显下调HFLS-RA中Cyclin-D1和MMP-7的表达水平,这可能是其控制RA的机制之一。本研究结果为红景天治疗RA初步提供了理论依据,但其具体作用机制仍需进一步深入和全面的探索。
| [1] | Boissier MC, Semerano L, Challal S, et al. Rheumatoid arthritis:from autoimmunity to synovitis and joint destruction[J]. J Autoimmun, 2012, 39(3): 222–228. DOI:10.1016/j.jaut.2012.05.021 |
| [2] | Tobon GJ, Youinou P, Saraux A. The environment, geo-epidemiology, and autoimmune disease:Rheumatoid arthritis[J]. J Autoimmun, 2010, 35(1): 10–14. DOI:10.1016/j.jaut.2009.12.009 |
| [3] | van de Sande MG, de Hair MJ, van der Leij C, et al. Different stages of rheumatoid arthritis:features of the synovium in the preclinical phase[J]. Ann Rheum Dis, 2011, 70(5): 772–777. DOI:10.1136/ard.2010.139527 |
| [4] | Prete M, Racanelli V, Digiglio L, et al. Extra-articular manifestations of rheumatoid arthritis:An update[J]. Autoimmun Rev, 2011, 11(2): 123–131. DOI:10.1016/j.autrev.2011.09.001 |
| [5] | Covic T, Cumming SR, Pallant JF, et al. Depression and anxiety in patients with rheumatoid arthritis:prevalence rates based on a comparison of the Depression, Anxiety and Stress Scale(DASS) and the hospital, Anxiety and Depression Scale (HADS)[J]. BMC Psychiatry, 2012, 12(6): 1–10. |
| [6] | Snir O, Gomez-Cabrero D, Montes A, et al. Non-HLA genes PTPN22, CDK6 and PADI4 are associated with specific autoantibodies in HLA-defined subgroups of rheumatoid arthritis[J]. Arthritis Res Ther, 2014, 6(4): 414. |
| [7] | Viatte S, Plant D, Raychaudhuri S. Genetics and epigenetics of rheumatoidarthritis[J]. Nat Rev Rheumatol, 2013, 9(3): 141–153. DOI:10.1038/nrrheum.2012.237 |
| [8] | Cruciat CM. Casein kinase 1 and Wnt/beta-catenin signaling[J]. Curr Opin Cell Biol, 2014, 31: 46–55. DOI:10.1016/j.ceb.2014.08.003 |
| [9] | 马喜喜, 徐胜前. Wnt信号通路在类风湿关节炎中的研究进展[J]. 中华临床医师杂志:电子版, 2013, 7(2): 789–792. |
| [10] | Muche S, Kirschnick M, Schwarz M, et al. Synergistic effects of beta-catenin inhibitors and sorafenib in hepatoma cells[J]. Anticancer Res, 2014, 34(9): 4677–4683. |
| [11] | 王爱玲, 曲玮, 梁敬钰. 红景天属植物化学成分及药理作用研究进展[J]. 海峡药学, 2014, 26(1): 1–8. |
| [12] | 李瑾翡, 林飞. 狭叶红景天的毒理学研究[J]. 中药新药与临床药理, 1994, 5(2): 28–29. |
| [13] | 邱联群, 周妍. 大株红景天联合生物制剂治疗老年性类风湿关节炎的临床观察[J]. 临床研究, 2013, 2(3): 9–11. |
| [14] | Avina-Zubieta JA, Thomas J, Sadatsafavi M, et al. Risk of incident cardiova-scular events in patients with rheuatoid arthritis:a meta-analysis of observational studies[J]. Ann Rheum Dis, 2012, 71(9): 1524–1529. DOI:10.1136/annrheumdis-2011-200726 |
| [15] | Pap T, Muller-ladner U, Gay RE, et al. Fibroblast biology:role of synovial fibroblasts in the pathogenesis of rheumatoid arthritis[J]. Arthritis Res, 2000, 2(5): 361–367. DOI:10.1186/ar113 |
| [16] | Xiao CY, Pan YF, Guo XH, et al. Expression of β-catenin in rheumatoid arthritis fibroblastlike synoviocytes[J]. Scand J Rheumatol, 2011, 40(1): 26–33. DOI:10.3109/03009742.2010.486767 |
| [17] | 宋朋飞, 阚卫兵, 袁琴, 等. 基质金属蛋白酶与骨关节炎的关系[J]. 广东医学, 2011, 32(20): 2736–2738. DOI:10.3969/j.issn.1001-9448.2011.20.050 |
| [18] | 党万太, 王婧, 谢文光, 等. sCD14在痛风性关节炎患者炎症反应中的变化及其意义[J]. 西安交通大学学报:医学版, 2015, 36(4): 514–518. |
 2017, Vol. 43
2017, Vol. 43


