扩展功能
文章信息
- 林玉茵, 陈文生, 郭晓兰, 谭茵, 贺小松, 戴建威
- LIN Yuyin, CHEN Wensheng, GUO Xiaolan, TAN Yin, HE Xiaosong, DAI Jianwei
- 人生长激素释放激素受体剪接变异体1型对人肝癌细胞HepG2增殖的影响
- Effect of human growth hormone releasing hormone receptor splice variant type 1 on proliferation of human liver cancer HepG2 cells
- 吉林大学学报(医学版), 2017, 43(03): 474-478
- Journal of Jilin University (Medicine Edition), 2017, 43(03): 474-478
- 10.13481/j.1671-587x.20170303
-
文章历史
- 收稿日期: 2016-08-12
2. 广州医科大学基础学院人体解剖学教研室, 广东 广州 511436
2. Department of Human Anatomy, School of Basic Medical Sciences, Guangzhou Medical University, Guangzhou 511436, China
人生长激素释放激素受体(human growth hormone releasing hormone receptor,GHRHR)是G蛋白偶联受体第二家族成员,少数存在于垂体,极少数存在于垂体外正常组织中。近期研究[1-3]显示:GHRHR的剪接变异体在多种肿瘤组织和癌细胞系中均存在,如人卵巢癌、人黑色素瘤和人胶质母细胞瘤等。肿瘤GHRHR是来源于垂体GHRHR mRNA的可变剪接亚型,介导GHRHR发挥功能及其抗肿瘤作用,其中最主要的可变剪接亚型即剪接复异体1型(splice variant type 1, SV1) 受到广泛关注,与GHRHR比较,GHRHR SV1基因的编码区前3个外显子(334个核苷酸)被3个内含子取代,导致GHRHR SV1蛋白氨基端胞外区的25个氨基酸序列与垂体型GHRHR不同,其在肿瘤细胞中发挥的确切作用少见报道。为探讨GHRHR SV1对人肝癌HepG2细胞增殖的影响,本研究将GHRHR SV1真核表达载体导入HepG2细胞中,建立稳定表达GHRHR SV1的HepG2细胞系(简称HepG2-SV1)。采用CCK-8法、克隆形成实验和细胞划痕实验共同检测干扰后HepG2细胞系与野生型HepG2细胞增殖率的差异。
1 材料与方法 1.1 细胞系、质粒、主要试剂和仪器人肝癌细胞系HepG2为美国ATCC公司产品。pcDNA3.0-GHRHR SV1真核表达载体由雅典大学Hippokratis Kiaris博士馈赠;pcDNA3.0质粒保存于广州医科大学生物技术系。RT-PCR Kit试剂盒、PCR试剂和限制性内切酶等购自日本TaKaRa公司,质粒提取试剂盒购自中国天根公司,Lipofectamine 2000和TRIzol购自美国Invitrogen公司,G418(Geneticin,遗传霉素)购自中国威佳公司,ECL化学发光液购自中国碧云天公司,兔抗人GAPDH单克隆抗体购自美国R&D公司,兔抗人GHRHR SV1抗体为本课题组前期制备获得[6]。ECLIPSE Ti荧光倒置显微镜为日本NiKon公司产品。
1.2 pcDNA3.0-GHRHR SV1质粒的基本原件已构建成功的pcDNA3.0-GHRHR SV1质粒中含有GHRHR SV1基因序列和新霉素抗性基因序列。
1.3 HepG2细胞的G418最适浓度的筛选在24孔板中接种HepG2细胞(每孔3 000个细胞),设置G418浓度梯度范围为0~1 000 mg·L-1,含血清培养14 d,观察细胞生长情况,根据细胞存活率筛选合适的G418处理浓度,最终确定G418最适浓度为750 mg·L-1。
1.4 HepG2-SV1细胞系的构建和鉴定将HepG2细胞接种到6孔板分组转染,分为非转染组(只加转染试剂不加质粒)、空载质粒转染组(转染pcDNA3.0)、重组质粒转染组(转染pcDNA3.0-GHRHR SV1重组质粒)。转染后于含750 mg·L-1 G418和含15%血清的完全培养基中培养,以未转染质粒的HepG2细胞作为阴性对照,筛选14 d后,将成活的阳性细胞用含300 mg·L-1 G418完全培养基继续筛选阳性细胞,收集成活的细胞扩大培养。提取扩大培养后单克隆细胞的总RNA,RT-PCR后获得cDNA,采用PCR方法进行鉴定。PCR的引物序列根据GenBank中GHRHR SV1序列设计,上游引物:5′-GCACCTTTGAAGCCAGAGAAGG-3′;下游引物:5′-CACGTGCCAGTGAAGAGCACGG-3′,该引物可扩增出长度为1 371 bp的基因片段。将PCR产物进行琼脂糖凝胶电泳,在1 371 bp处观察是否有SV1目的条带。提取扩大培养后的单克隆细胞蛋白质,采用Western blotting法检测GHRHR SV1的表达,所使用的特异性抗体为同组成员制备,根据GHRHR SV1胞外区特异性抗原决定簇序列所设计,制备兔多克隆抗体,经检测抗体效价为1:1 600 000[6]。
1.5 CCK-8法检测细胞增殖率实验设立对照组(HepG2野生型)、空载质粒组(稳定转染pcDNA3.0)和干扰组(HepG2-SV1细胞系),以每孔2 000个细胞的密度接种至96孔板中,每组设置3个平行复孔,分别培养24、48和72 h,每孔加入100 μL CCK-8试剂,温箱孵育30 min后用酶标仪检测吸光度(A)值,计算细胞增殖率。细胞增殖率=各实验组A值/对照组A值×100%。
1.6 克隆形成实验检测细胞的单克隆形成率设立对照组(HepG2野生型)、空载质粒组(稳定转染pcDNA 3.0)和干扰组(HepG2-SV1细胞系),在6孔板中以每孔500个细胞分别接种3组细胞,连续培养14 d后对细胞进行结晶紫染色,计算细胞单克隆形成率。单克隆形成率=克隆数/接种细胞数×100%。
1.7 细胞划痕实验检测细胞迁移率在细胞划痕实验中设立对照组(HepG2野生型)、空载质粒组(稳定转染pcDNA3.0)和干扰组(HepG2-SV1细胞系),以每孔5×104个细胞接种至24孔板中,每组设置3个平行复孔,培养12 h后进行划痕实验,划痕后12和24 h分别观察拍照,计算细胞迁移率。细胞迁移率=(1-测量时划痕宽度/初始划痕宽度)×100%。
1.8 统计学分析采用SPSS 17.0统计软件进行统计学分析。各组细胞的增殖率和克隆形成率以x±s表示,组间比较采用单因素方差分析。以α=0.05为检验水准。
2 结果 2.1 HepG2-SV1细胞系的鉴定HepG2-SV1细胞的PCR产物在1 000~2 000 bp有条带;Western bloting检测结果显示:构建的HepG2-SV1细胞系中有GHRHR SV1表达,证明HepG2-SV1细胞系构建成功。HepG2细胞、HepG2-SV1细胞和HepG2-pcDNA3.0细胞中提取总RNA反转录后产物的PCR结果见图 1,3组细胞分别提取的蛋白质的Western blotting检测结果见图 2。
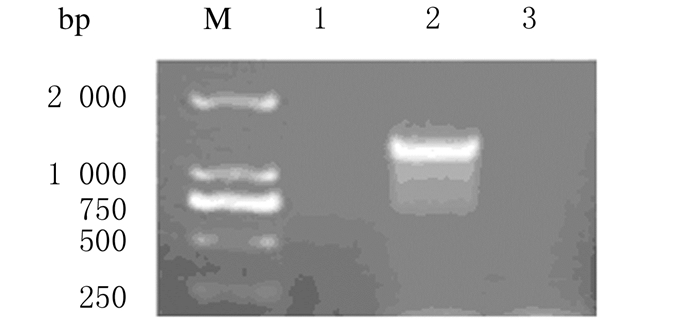
|
| M:DL 2 000 DNA marker; Lane 1:HepG2 cells; Lane 2:HepG2 SV1 cells; Lane 3: HepG2 pcDNA3 0 cells. 图 1 PCR法检测各组细胞中SV1基因表达电泳图 Figure 1 Electrophoregram of expressions of SV1 gene in cells in various groups detected by PCR method |
|
|
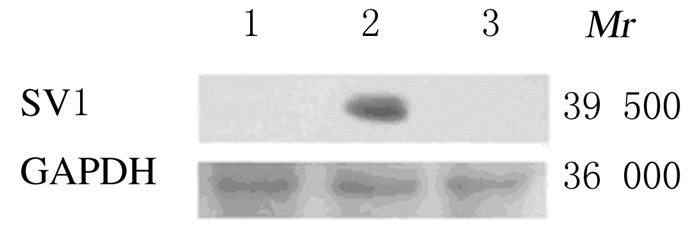
|
| Lane 1: HepG2 cells; Lane 2:HepG2-SV1 cells; Lane 3:HepG2-pcDNA3.0 cells. 图 2 Western blotting法检测各组细胞中GHRH SV1表达电泳图 Figure 2 Electrophoregram of expressions of GHRHRSV1 in cells in various groups detected by Western blotting method |
|
|
空载质粒组细胞系增殖率在24、48和72 h时与对照组比较差异无统计意义(P>0.05);与空载质粒组细胞比较,干扰组细胞在24、48和72 h时的增殖率均升高(P<0.05或P<0.01)。见表 1。
| (x±s) | ||||
| Group | Proliferation rate | |||
| (t/h) | 24 | 48 | 72 | |
| HepG2 | 1.000±0.201 | 1.535±0.530 | 2.366±0.211 | |
| HepG2-emtpy | 0.882±0.102 | 1.495±0.115 | 2.170±0.312 | |
| HepG2-SV1 | 1.443±0.296* | 2.582±0.212** | 2.945±0.512* | |
| *P<0.05,** P<0.01 vs HepG2-empty group. | ||||
空载质粒组细胞和干扰组细胞的克隆形成率分别为97.0%±31.5%和343.0%±20.2%;与空载质粒组细胞比较,干扰组细胞的单克隆形成率明显升高(P<0.05),约为空载质粒组细胞的3.5倍。
2.4 各组细胞的迁移率空载质粒组细胞的迁移率为71.0%±37.9%,干扰组细胞的迁移率为168.0%±21.3%;与质粒空载组细胞比较,干扰组细胞的迁移率明显升高(P < 0.05)。见图 3和4。

|
| A-C:0 h; D-F:24 h; A, D:HepG2 group; B, E:HepG2-empty group; C, F:HepG2-SV1 group.. 图 3 细胞划痕实验检测各组细胞迁移距离 Figure 3 Migration distance of cells in various groups detected by wound healing assay |
|
|
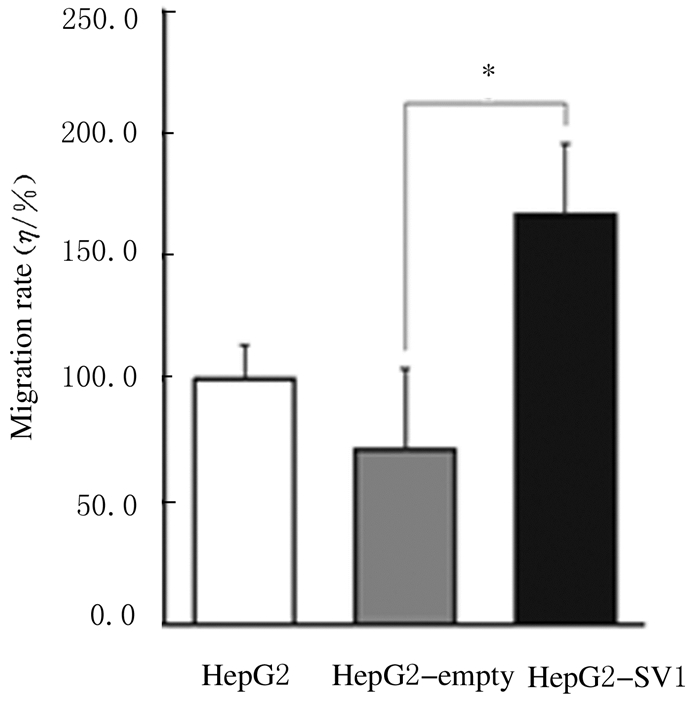
|
| *P < 0.05 vs HepG2-empty group. 图 4 细胞划痕实验检测各组细胞相对迁移率示意图 Figure 4 Diagram of relative migration rate of cells in various groups detected by cell wound healing assay |
|
|
研究者[7]构建能表达GHRHR SV1的鼠成纤维细胞系时发现GHRHR SV1能促进其细胞增殖,但GHRHR SV1是否对人类癌细胞的增殖有影响尚不明确。为探讨GHRHR SV1是否对人类癌细胞有促增殖作用,本实验通过构建稳定表达GHRHR SV1的HepG2细胞系(HepG2-SV1),并对其进行CCK-8细胞增殖率检测、克隆形成实验和划痕实验,各实验结果均表明:在细胞增殖率方面,HepG2-SV1细胞系较HepG2-空载细胞系有明显升高,证实SV1对肝癌细胞有促增殖作用。
汪期明等[8]发现:在子宫内膜异位症中,异位子宫内膜SV1呈高表达率,提示异位内膜对GHRH灵敏度更高,说明对于有SV1表达的肿瘤细胞,GHRH的促增殖作用更明显,以致肿瘤细胞生长速度更快。GHRH与GHRHR结合后,其信号通过细胞中cAMP /PKA途径放大、下传, 活化非选择性离子通道, 细胞膜去极化, 促进钙离子内流和生长激素(GH)分泌,从而促进细胞增殖[9]。本文作者推测:GHRHR SV1与GHRH的结合力可能比GHRHR更强,发挥促增殖的能力增强,从而导致有SV1表达的细胞增殖速度加快,此外SV1的表达可能影响细胞内cAMP/PKA通路而发挥促增殖作用,但具体机制尚未明确。黄勇等[10]推测:在子宫内膜异位症中,SV1的表达水平可能受GHRH刺激诱导而升高,而无SV1表达的肿瘤细胞是否会受GHRH诱导而表达SV1尚待研究。Szalontay等研究[11]表明:GHRHRSV1的生物学效应是通过配体依赖途径以及非配体依赖途径调节细胞的有丝分裂,从异型增生进展为恶性肿瘤的过程伴随着GHRHR SV1的表达,这为肿瘤前期诊断提供了依据,未来可以使用针对GHRHR SV1的标记物进行辅助诊断。
使用GHRH的拮抗剂可对某些肿瘤细胞的增殖起抑制作用,如Munoz-Moreno等[12]新研发的GHRH拮抗剂MIA-602和MIA-690,主要通过识别GHRHR SV1而起到抑制黑色素瘤细胞增殖的作用。Kovacs等[13]发现:GHRH拮抗剂JMR-132和JV-1-38可抑制人前列腺癌PC3细胞的生长和侵袭。上述研究进一步证实GHRHR SV1可作为抗肿瘤药物的有效新靶点。尽管已研发出MIA-602及MIA-690等GHRH拮抗剂,但其对生物体仍然有一定的毒副作用[14],所以针对SV1作用靶点,开发新型抗肿瘤药物将是肿瘤防治研究的一个方向。Rick等[15]发现:GHRH拮抗剂JMR-132在前列腺癌中通过影响ERK和AKT激酶发挥作用。Catanuto等[16]发现:GHRHR SV1抑制剂对甲状腺癌细胞的侵袭有明显的抑制作用,说明SV1的存在可能影响了细胞的侵袭能力。本文作者推测:该合成SV1特异性抗体可对肿瘤细胞表面的GHRHR SV1进行特异性封闭,从而抑制其对肿瘤细胞的促生长作用,这对延缓肿瘤生长有重要的意义。
综上所述,GHRHR SV1可明显促进人类肝癌细胞的增殖。未来本课题组将针对GHRHR SV1对肿瘤细胞的侵袭能力展开进一步的研究。
| [1] | Hohla F, Moder A, Mayrhauser U, et al. Differential expression of GHRH receptor and its splice variant 1 in human normal and malignant mucosa of the oesophagus and colon[J]. Int J Oncol, 2008, 33(1): 137–143. |
| [2] | Papadia A, Schally AV, Halmos G, et al. Growth hormone-releasing hormone antagonists inhibit growth of human ovarian cancer[J]. Horm Metab Res, 2011, 43(11): 816–820. DOI:10.1055/s-0031-1287766 |
| [3] | Dioufa M, Farmaki E, Schally AV, et al. Growth hormone-releasing hormone receptor splice variant 1 is frequently expressed in oral squamous cell carcinomas[J]. Horm Cancer, 2012, 3(4): 172–180. DOI:10.1007/s12672-012-0108-8 |
| [4] | Chatzistamou I, Volakaki A, Schally AV, et al. Expression of growth hormone-releasing hormone receptor splice variant 1 in primary human melanomas[J]. Regul Pept, 2008, 147(1-3): 33–36. DOI:10.1016/j.regpep.2007.12.008 |
| [5] | Mezey G, Treszl A, Schally AV, et al. Prognosis in human glioblastoma based on expression of ligand growth hormone-releasing hormone, pituitary-type growth hormone-releasing hormone receptor, its splicing variant receptors, EGF receptor and PTEN genes[J]. J Cancer Res Clin Oncol, 2014, 140(10): 1641–1649. DOI:10.1007/s00432-014-1716-1 |
| [6] | 郭晓兰, 谭茵, 陈文生, 等. GHRHR-SV1抗体的制备及其蛋白在黑色素瘤细胞中的表达[J]. 吉林大学学报:医学版, 2016, 42(6): 1237–1242. |
| [7] | 田力, 张蕾, 李伟伟, 等. 人生长激素释放激素变异受体1型基因绿色荧光蛋白真核表达载体1的构建及体外表达[J]. 江西医学学报, 2009, 49(3): 15–20. |
| [8] | 汪期明, 黄勇. 生长激素释放激素受体剪接变异体1在子宫内膜异位症中的表达[J]. 中国妇幼保健, 2012, 27(28): 4441–4444. |
| [9] | 沈烨, 胡吉, 张玉林, 等. 生长激素释放激素在垂体生长激素瘤中的作用[J]. 复旦学报:医学版, 2006, 33(4): 463–466. |
| [10] | 黄勇, 汪期明. 生长激素释放激素拮抗剂对人异位子宫内膜抑制增殖作用与cAMP信号通路相关[J]. 医学研究杂志, 2013(5): 103–106. |
| [11] | Szalontay L, Schally AV, Popovics P, et al. Novel GHRH antagonists suppress the growth of human malignant melanoma by restoring nuclear p27 function[J]. Cell Cycle, 2014, 13(17): 2790–2797. DOI:10.4161/15384101.2015.945879 |
| [12] | Munoz-Moreno L, Arenas MI, Schally AV, et al. Inhibitory effects of antagonists of growth hormone-releasing hormone on growth and invasiveness of PC3 human prostate cancer[J]. Int J Cancer, 2013, 132(4): 755–765. DOI:10.1002/ijc.27716 |
| [13] | Kovacs M, Schally AV, Hohla F, et al. A correlation of endocrine and anticancer effects of some antagonists of GHRH[J]. Peptides, 2010, 31(10): 1839–1846. DOI:10.1016/j.peptides.2010.07.006 |
| [14] | Munoz-Moreno L, Arenas MI, Carmena MJ, et al. Growth hormone-releasing hormone antagonists abolish the transactivation of human epidermal growth factor receptors in advanced prostate cancer models[J]. Invest New Drugs, 2014, 32(5): 871–882. DOI:10.1007/s10637-014-0131-4 |
| [15] | Rick FG, Schally AV, Szalontay L, et al. Antagonists of growth hormone-releasing hormone inhibit growth of androgen-independent prostate cancer through inactivation of ERK and Akt kinases[J]. Proc Natl Acad Sci USA, 2012, 109(5): 1655–1660. DOI:10.1073/pnas.1120588109 |
| [16] | Catanuto P, Tashiro J, Rick F, et al. Expression of receptors for pituitary-type growth hormone-releasing hormone (pGHRH-R) in human papillary thyroid cancer cells:effects of GHRH antagonists on matrix metalloproteinase-2[J]. Horm Cancer, 2015, 6(2/3): 100–106. |
 2017, Vol. 43
2017, Vol. 43


