扩展功能
文章信息
- 魏群, 杨萍
- WEI Qun, YANG Ping
- 替米沙坦对心肌梗死后心力衰竭大鼠左心室非梗死区激活素A及其受体表达的影响
- Effects of telmisartan on expressions of activin A and its receptors in non-infarction area of left ventricle in heart failure rats after myocardial infarction
- 吉林大学学报(医学版), 2017, 43(03): 468-473
- Journal of Jilin University (Medicine Edition), 2017, 43(03): 468-473
- 10.13481/j.1671-587x.20170302
-
文章历史
- 收稿日期: 2016-12-04
2. 吉林大学中日联谊医院心内科, 吉林 长春 130033
2. Department of Cardiology, China-Japan Union Hospital, Jilin University, Changchun 130033, China
胶原沉积是心室重构的主要原因,心肌梗死后的胶原沉积不但出现在梗死区,亦可存在于左室非梗死区的心肌组织中[1],非梗死区重塑是心室重塑的重要内容[2]。激活素A属于转化生长因子β(transforming growth factor-β, TGF-β)超家族成员之一,是机体参与急性期应答以及纤维化形成的重要因子。激活素A发挥作用与激活素Ⅱ型A受体(type ⅡAactivin receptor, ActR ⅡA)和Ⅱ型B受体(type ⅡBactivin receptor, ActR ⅡB)有直接关系[3-4]。血管紧张素Ⅱ (AngⅡ)受体阻滞剂(ARB)类代表药物——替米沙坦因能够改善心室重构,已广泛应用于临床。但是以往的研究多集中于替米沙坦对血管紧张素Ⅱ 1型(AT1) 受体水平的影响,其对激活素A及其受体表达水平的影响目前尚未见报道。本实验采用心肌梗死后心力衰竭(心衰)动物模型,观察非梗死区心肌组织中激活素A及其受体表达水平的变化,心肌Ⅰ型(type Ⅰ collagen, ColⅠ)、Ⅲ型胶原蛋白(type Ⅲ collagen, Col Ⅲ)表达水平的改变及替米沙坦对胶原沉积的干预作用,探讨替米沙坦改善心室重构的作用机制,阐明替米沙坦能否通过调节激活素A的表达成为改善心衰的又一治疗靶点。
1 材料与方法 1.1 实验动物、主要药物和仪器Wistar大鼠27只,体质量190~210g,雌性,动物合格证号:SCXK-(吉)2003-0001,由吉林大学实验动物中心提供。替米沙坦由上海勃林殷格翰药业有限公司提供,批号:602328,溶于0.5%羧甲基纤维素钠(CMC)中。凝胶成像仪和紫外分光光度计为瑞士Phamacia Biotech公司产品。
1.2 动物模型的制备大鼠左冠脉结扎参照文献[5]方法,乙醚吸入麻醉后仰卧位固定,剪去胸前鼠毛,以75%酒精消毒,自左侧3~4肋间开胸, 打开心包膜,暴露心脏。27只大鼠分为假手术组(7只)、模型组(10只)和替米沙坦组(10只)。模型组和替米沙坦组大鼠于左冠状动脉前降支,以0号线结扎冠脉;假手术组大鼠仅穿线不结扎,术后将心脏送回胸腔,挤出胸腔内的血液和气体,收拢荷包关闭胸腔,整个开胸时间不超过30 s。冠脉结扎术后48 h,模型组大鼠死亡4只,替米沙坦组大鼠死亡3只;1周内替米沙坦组大鼠死亡1只;假手术组1只大鼠死于麻醉意外。
1.3 动物分组和给药5周后假手术组、模型组和替米沙坦组。每组存活6只大鼠。替米沙坦组大鼠灌胃给予替米沙坦(30 mg·kg-1),假手术组和模型组大鼠均灌胃给予0.5%CMC(10 mL·kg-1)。各组大鼠分别于术后第6周开始给药,连续给药4周,每日1次,灌胃容积均为10 mL·kg-1。
1.4 大鼠全心肥厚指数和左心室肥厚指数的测定给药4周后,称各组大鼠体质量后以3%戊巴比妥(30 mg·kg-1)腹腔注射麻醉,打开胸腔摘取心脏,称全心质量和左心室质量(mg),并分别除以体质量(g),计算全心肥厚指数(全心质量/体质量)及左心室肥厚指数(左心室质量/体质量)。称量完毕后取非梗死区心肌组织置于-70℃保存,待提取RNA。
1.5 RT-PCR法检测大鼠非梗死区心肌组织中激活素A、ActR ⅡA、ActR ⅡB、ColⅠ和ColⅢ mRNA表达水平提取总RNA及逆转录反应:取50 mg心肌组织标本,加入0.5 mL TRIzol,经氯仿和异丙醇提取总RNA。紫外分光光度计分析mRNA表达水平。取2 μg总RNA逆转录合成cDNA,-20℃保存。所有引物均由上海生物工程技术有限公司合成。β-actin(359 bp,NM_03114) 正向引物为5′-GCTCGTCGTCGACAACGGCTC-3′,反向引物为5′-CAAACATGATCTGGGTCATCTTCTC-3′;激活素A(βA)(726 bp,NM_017128) 正向引物为5′-GGATGTGCGGATTGCTTGTGA-3′,反向引物为5′-GACCTTGCCATCACACTCCAA-3′;ActRⅡA(361 bp,NM_ 031571) 正向引物为5′-GACAGAACCAATCAGACTGGTG-3′,反向引物为5′-TGTGTGACTTCCATCACCGGAA-3′;ActRⅡB(704 bp,NM_031554) 正向引物为5′-GCTGCTGGCTAGATGACTTCA-3′,反向引物为5′-GATGTCGGTACATCCAGAAGG;FS(348 bp,NM_012561) 正向引物为5′-GCTGCTGCTACTCTGCCAAT-3′,反向引物为5′-GGACCCTTCCAGGTGATGTT-3′;Col Ⅰ(361 bp,NM_053304.1) 正向引物为5′-AGGGTCATCGTGGCTTCTC-3′,反向引物为5′-ACCTTCGCTTCCATACTCG-3′;Col Ⅲ(704 bp,NM_032085.1) 正向引物为5′-CTCAAGAGCGGAGAATACTGG-3′,反向引物为5′-TGCCACCATCATAGACTAGATTC-3′。PCR反应条件:95℃预变性90 s,94℃变性30 s,退火温度除激活素A为56℃外,其余均为58℃,退火时间均为30 s,72℃延伸50 s,循环32次,最后72℃延伸10 min。取5 μL PCR反应产物行1.5%琼脂糖电泳,计算吸光度(A)值,图片经ImageMaster VDS分析,mRNA表达水平=目的基因灰度值/β-actin灰度值。
1.6 免疫组织化学染色检测大鼠非梗死区心肌组织中激活素A蛋白表达强度取大鼠的左心室非梗死区心肌组织,经4%多聚甲醛固定,常规石蜡切片,切片经二甲苯常规脱蜡(10 min×2次)、梯度酒精水化后,蒸馏水洗涤2次。每张切片加入50 μL 3%H2O2封闭内源性过氧化物酶,室温下孵育10 min。以pH7.4 PBS冲洗(3 min×3次)。每张切片经2%BSA-PBS室温下孵育30 min,PBS洗涤1次,分别滴加50 μL兔抗大鼠激活素A单克隆抗体(1:300稀释,美国R&D公司),室温反应2 h,PBS冲洗3 min×3次。采用Ultrasensitive SP超敏试剂盒,按照说明书操作进行显色。PBS冲洗3 min×3次。苏木精复染,自来水冲洗返蓝,梯度酒精脱水干燥,二甲苯透明,封片,光学显微镜观察。实验以未免疫健康兔IgG作为阴性对照,实验操作同抗体组。
1.7 统计学分析采用SPSS11.0统计软件进行统计学分析。各组大鼠的全心肥厚指数、左心室肥厚指数和大鼠非梗死区心肌组织中激活素A、ActR ⅡA、ActR ⅡB、ColⅠ、ColⅢ mRNA表达水平及ColⅠ/ColⅢ比值以x±s表示,组间比较采用t检验。以α=0.05为检验水准。
2 结果 2.1 各组大鼠全心肥厚指数和左心室肥厚指数与假手术组比较,模型组大鼠全心肥厚指数和左心室肥厚指数均明显升高(P<0.01);与模型组比较,替米沙坦组大鼠全心肥厚指数和左心室肥厚指数降低(P<0.01)。见表 1。
| [n=6, x±s, wB/(mg·g-1)] | ||
| Group | Whole cardiac hypertrophy index | Left ventricular hypertrophy index |
| Sham operation | 3.26±0.14 | 2.29±0.12 |
| Model | 4.56±0.29* | 3.72±0.16* |
| Telmisartan | 3.76±0.25△ | 2.89±0.11△ |
| *P < 0.01 compared with sham operation group;△P < 0.01 compared with model group. | ||
与假手术组比较,模型组大鼠非梗死区心肌组织中激活素A、ActR ⅡA和ActR ⅡB mRNA表达水平明显升高(P<0.01),分别是假手术组的1.63倍、1.59倍和1.35倍;与模型组比较,替米沙坦组大鼠非梗死区心肌组织中激活素A、ActRⅡA和ActRⅡB mRNA表达水平降低(P<0.01)。见表 2。
| (n=6, x±s) | |||
| Group | Activin A mRNA | ActRⅡ A mRNA | ActRⅡ B mRNA |
| Sham operation | 0.689 1±0.11 | 0.753 1±0.03 | 0.767 1±0.05 |
| Model | 1.122 1±0.13* | 1.201 8±0.11* | 1.042 1±0.11* |
| Telmisartan | 0.812 1±0.10△ | 0.821 4±0.14△ | 0.867 1±0.12△ |
| * P<0.01 compared with sham operation group; △P<0.01 compared with model group. | |||
与假手术组比较,模型组大鼠非梗死区心肌组织中ColⅠ和ColⅢmRNA表达水平升高(P<0.01),分别是假手术组的1.55倍和1.26倍,且ColⅠ/ColⅢ比值升高;与模型组比较,替米沙坦组大鼠非梗死区心肌组织中ColⅠ和ColⅢmRAN表达水平降低,ColⅠ/ColⅢ比值降低(P<0.01)。见表 3。
| (n=6, x±s) | |||
| Group | ColⅠ mRNA | ColⅢ mRNA | ColⅠ/ColⅢ |
| Sham operation | 0.7663±0.10 | 0.7821±0.04 | 0.9798±0.01 |
| Model | 1.1879±0.11* | 0.9870±0.05* | 1.2035±0.04* |
| Telmisartan | 0.7963±0.13△ | 0.8071±0.17△ | 0.9866±0.05△ |
| *P<0.01 compared with sham operation group; △P<0.01 compared with model group. | |||
假手术组大鼠非梗死区心肌组织中激活素A蛋白呈低水平表达,模型组大鼠非梗死区心肌组织中激活素A蛋白呈高水平表达,替米沙坦组大鼠非梗死区心肌组织中激活素A蛋白呈低水平表达。见图 1(插页一)。
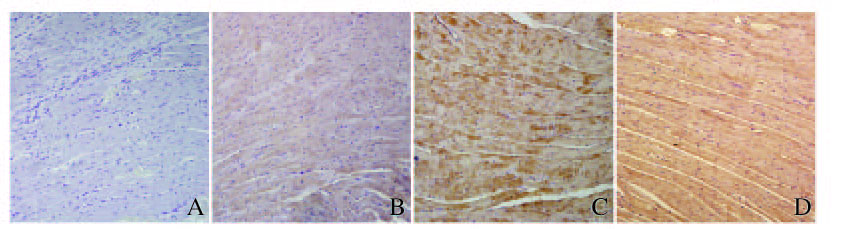
|
| A: Normal control group; B: Model group; C: Extract of Schisadra chinensis group; D: Benazepril group. 图 1 各组大鼠非梗死区心肌组织中Activin A蛋白表达强度(×200) Figure 1 Expression intensities of Activin A protein in myocardium tissue in non-infarction area of rats in various groups(× 200) |
|
|
急性心肌梗死后肾素-血管紧张素-醛固酮系统(renin-angiotensin-aldosteronesystem, RAAS)激活,Ang Ⅱ生成增多,促进心肌间质细胞的胶原重构,导致心肌梗死后心肌纤维化并最终诱发心衰。除Ang Ⅱ外,目前已发现多种细胞因子参与心肌纤维化的发病过程,其中以TGF-β1的作用较为明确。激活素A属于TGF-β超家族成员,具有与TGF-β1相似的诱导纤维化形成的作用,尤其是在产生细胞外基质方面,虽然激活素A最初由卵泡液中提取出来,但不再是以前认为的性调节激素。研究[6-7]显示:激活素A具有广泛的生物学活性,在个体发育的不同阶段均扮演着重要的角色,也是机体多种生理和病理过程的重要调节因子,参与调控细胞生理过程,如增殖、死亡、代谢、内环境的稳定、组织细胞分化、免疫反应及内分泌等。激活素A异常地分泌增高或降低,可以导致组织细胞分化、增殖及代谢异常等。激活素A受体分为Ⅰ型(ActRⅠ)及Ⅱ型受体(ActRⅡ)[8-10],Ⅱ型受体又分为ⅡA和ⅡB 2个亚型。通过干预激活素A与ActRⅡ结合,即可改变激活素A的作用。以往的研究多集中于激活素A参与组织损伤和炎症修复、肝纤维化、肾纤维化、调节卵泡颗粒细胞及神经细胞分化等方面,近年来激活素A与冠心病之间的关系逐渐引起关注。研究[11-12]显示:体外评估心绞痛患者外周血单核细胞中激活素A的蛋白及其mRNA水平时,稳定型心绞痛患者激活素A水平增加,而不稳定型者无变化;与稳定型心绞痛患者比较,不稳定型心绞痛患者ActRⅡ表达水平降低;激活素A可剂量依赖性地抑制外周血单核细胞炎症因子的释放,提示激活素A可阻止炎症因子表达,在心绞痛、尤其是不稳定型心绞痛中有潜在的抗炎作用。Miyoshi等[13]发现:急性心肌梗死患者经皮冠状动脉介入治疗(PCI)前血清激活素A水平较稳定型心绞痛患者和健康人明显升高,PCI治疗成功后,激活素A水平明显降低,2 d后再次升高。激活素A的起始峰值是由于外周血单核细胞和血管内皮细胞的释放,PCI治疗后激活素A水平再次升高。急性心肌梗死患者血清激活素A水平与肌酸激酶(creatine kinase, CK)和肌酸激酶同工酶(creatine kinase-MB, CK-MB)峰值关系密切,可以同CK和CK-MB一样作为心肌标志物来预测心肌梗死的严重程度。2004年Yndestad等[14]发现:在心肌梗死后心衰模型实验动物中,左室缺血区激活素A及其受体水平明显升高,同时其可以诱导与心肌重塑相关的介质心钠素肽(atrial natriuretic peptide, ANP)、脑钠素肽((brain natriuretic peptide, BNP)、转化生长因子α(transforming growth factor-α, TGF-α)、单核细胞趋化蛋白1(monocyte chemotactic protein 1, MCP-1)、基质金属蛋白酶9(matrix metalloproteinase-9, MMP-9)、基质金属蛋白酶组织抑制剂1(tissue inhibitor of metalloproteinase-1, TIMP-1) 等mRNA表达水平升高,而且上述因子在间质纤维化的发展过程中发挥重要作用。在临床试验中,这些因子的血清水平与激活素A水平呈明显相关关系,因此,激活素A可能在心肌梗死的愈合过程中发挥作用[14-15]。国外最近的研究[16]显示:在缺血-再灌注损伤模型中,心肌细胞中激活素A表达水平明显升高。研究[17]显示:激活素A参与心肌缺血/再灌注损伤过程,羟自由基是心肌缺血/再灌注损伤的主要原因,心肌组织中激活素A水平与抑制羟自由基能力和乳酸脱氢酶活性呈负相关关系。因此抑制激活素A可减少心肌梗死的梗死面积、降低心室重塑及发生心衰的可能性。
心室重构是心衰发生发展的主要因素,Dixon等[18]研究表明:非梗死区心肌组织在梗死后3 d表现为ColⅠ和ColⅢmRNA表达水平开始增加,7~14 d时其表达水平增加减弱,28~56 d时其表达水平升至高峰,随后心肌间质纤维逐渐沉积,ColⅠ和ColⅢ表达水平增加,并且ColⅠ/ColⅢ比值升高,心室壁失去弹性变得僵硬,因此改善心室重构中抑制胶原的重构成为重点。本课题组前期研究[19]已经证实:在心肌梗死后心衰动物模型中,非梗死区心肌组织中激活素A蛋白表达水平升高,且其参与了心肌间质的纤维化进程。为了进一步探讨替米沙坦改善心室重构新的可能机制,本研究采用结扎Wistar大鼠左冠状动脉前降支制备心肌梗死后心衰模型,观察替米沙坦对激活素A及其受体表达的影响。本研究结果显示:替米沙坦干预后可下调激活素A mRNA及蛋白表达水平,其相关受体ⅡA、ⅡB及ColⅠ、ColⅢ mRNA表达水平降低,亦降低胶原蛋白分数(ColⅠ/ColⅢ比值),同时全心肥厚指数及左心室肥厚指数明显降低,提示替米沙坦可通过影响激活素A及其相关受体的表达,改善心肌间质的胶原沉积,其进一步机制可能与Ang Ⅱ有关联。Pawlowski等[20]在离体实验中发现:Ang Ⅱ作用于血管平滑肌细胞可使其分泌激活素A,激活素A直接参与了动脉粥样硬化中血管纤维化的形成。本课题组前期实验[19]已证实:心肌梗死后心衰大鼠外周血血清及非梗死心肌组织中激活素A水平与Ang Ⅱ水平同步升高,Ag Ⅱ可能通过激活素A介导了左心室重构。替米沙坦通过阻滞血管紧张素转换酶及非血管紧张素转换酶途径产生的Ag Ⅱ与AT1受体结合,从而影响激活素A及其相关受体的表达。
综上所述,替米沙坦亲脂性较高、体内吸收迅速、分布容积最大,不但可防止心室重构,还具有调节糖脂代谢异常的作用,其作用机制是部分激动过氧化物酶体增殖物激活受体γ(peroxisome proliferator activated receptor-γ, PPAR-γ)干预脂肪细胞的分化和分泌等。替米沙坦除可抑制RASS系统外,还可通过影响激活素A及其相关受体的表达,抑制激活素A诱导的心肌纤维化的形成,从而改善左心室重构,并有望成为改善心衰的又一治疗靶点。
| [1] | Ju H, Zhao S, Jassal DS, et al. Effect of AT1 receptor blockade on cardiac collagen remodeling after myocardial infarction[J]. Cardiovasc Res, 1997, 35(2): 223–232. DOI:10.1016/S0008-6363(97)00130-2 |
| [2] | Beltrami CA, Finato N, Rocco M, et al. Structural basis of end-stage failure in ischemiccardiomyopathy in humans[J]. Circulation, 1994, 89(1): 151–163. DOI:10.1161/01.CIR.89.1.151 |
| [3] | Mathews LS, Vale WW. Expression cloning of an activin receptor, a predicted transmembrane serine kinase[J]. Cell, 1991, 65(6): 973–982. DOI:10.1016/0092-8674(91)90549-E |
| [4] | Mathews LS. Activin receptors and cellular signaling by the receptor serine kinase family[J]. Endocr Rev, 1994, 15(3): 310–325. DOI:10.1210/edrv-15-3-310 |
| [5] | Campbell DJ, Kladis A, Valentijn AJ. Effects of losartan on angiotensin and bradykinin peptides and converting enzyme[J]. J Cardiovasc Pharmacol, 1995, 26(2): 233–240. DOI:10.1097/00005344-199508000-00009 |
| [6] | Massagué J, Blain SW, Lo RS. TGFbeta signaling in growth control, cancer, and heritable disorders[J]. Cell, 2000, 103(2): 295–309. DOI:10.1016/S0092-8674(00)00121-5 |
| [7] | Chen YG, Liu HM, Lin SL, et al. Regulation of cell proliferation, apoptosis, and carcinogenesis by activin[J]. Exp Biol Med, 2002, 227(2): 75–87. |
| [8] | Willis SA, Zimmerman CM, Li LI, et al. Formation and activation by phosphorylation of activin receptor complexes[J]. Mol Endocrinol, 1996, 10(4): 367–379. |
| [9] | Attisano L, Wrana JL, Montalvo E, et al. Activation of signalling by the activin receptor complex[J]. Mol Cell Biol, 1996, 16(3): 1066–1073. DOI:10.1128/MCB.16.3.1066 |
| [10] | Tsuchida K, Vaughan JM, Wiater E, et al. Inactivation of activin-dependent transcription by kinase-deficient activin receptors[J]. Endocrinology, 1995, 136(12): 5493–5503. DOI:10.1210/endo.136.12.7588300 |
| [11] | Smith C, Yndestad A, Halvorsen B, et al. Potential anti-inflammatory role of activin A in acute coronary syndromes[J]. J Am Coll Cardiol, 2004, 44(2): 369–375. DOI:10.1016/j.jacc.2004.03.069 |
| [12] | Trepels T, Zeiher AM, Fichtlscherer S. Acute coronary syndrome and inflammation.Biomarkers for diagnostics and risk stratification[J]. Herz, 2004, 29(8): 769–776. DOI:10.1007/s00059-004-2637-6 |
| [13] | Miyoshi T, Hirohata S, Uesugi T, et al. Relationship between activin A level and infarct size in patients with acute myocardial infarction undergoing successful primary coronary intervention[J]. Clinica Chimica Acta, 2009, 401(1/2): 3–7. |
| [14] | Yndestad A, Ueland T, Øie E, et al. Elevated levels of activin A in heart failure:potential role in myocardial remodeling[J]. Circulation, 2004, 109(11): 1379–1385. DOI:10.1161/01.CIR.0000120704.97934.41 |
| [15] | Li YY, McTiernan CF, Feldman AM. Interplay of matrix metalloproteinases, tissue inhibitors of metalloproteinases and their regulators in cardiac matrix remodeling[J]. Cardiovasc Res, 2000, 46(2): 214–224. DOI:10.1016/S0008-6363(00)00003-1 |
| [16] | Chen Y, Rothnie C, Spring D, et al. Regulation and actions of activin A and follistatin in myocardial ischaemia-reperfusion injury[J]. Cytokine, 2014, 69(2): 255–262. DOI:10.1016/j.cyto.2014.06.017 |
| [17] | 张令军, 黄鹤, 潘平喜, 等. 激活素A在心肌缺血后适应中的表达变化及意义[J]. 四川大学学报:医学版, 2009, 40(1): 97–99. |
| [18] | Dixon IM, Ju H, Jassal DS, et al. Effect of ramipril and iosartan on collegan expression in right and left heart after myocardial infarction[J]. Mol Cell Biochem, 1996, 165(1): 31–45. |
| [19] | Wei Q, Wang YN, Liu HY, et al. The expression and role of activin A and follistatin in heart failure rats aftermyocardial infarction[J]. Int J Cardiol, 2013, 168(3): 2994–2997. DOI:10.1016/j.ijcard.2013.04.012 |
| [20] | Pawlowski JE, Taylor DS, Valentine M, et al. Stimulation of activin A expression in rat aortic smooth muscle cells by thrombin and angiotensin Ⅱ correlates with neointimal formation in vivo[J]. J Clin Invest, 1997, 100(3): 639–648. DOI:10.1172/JCI119575 |
 2017, Vol. 43
2017, Vol. 43


