扩展功能
文章信息
- 赵庆斌, 刘丹丹, 李超
- ZHAO Qingbin, LIU Dandan, LI Chao
- 糖尿病兔心肌缺血早期心肌细胞超微结构和心肌组织中肿瘤坏死因子α表达水平及其意义
- Ultrastructure of mycardial cells and expression levels of tumor necrosis factor α in myocardium tissue of diabetic rabbits during early myocardial ischemia and their significances
- 吉林大学学报(医学版), 2017, 43(03): 463-467
- Journal of Jilin University (Medicine Edition), 2017, 43(03): 463-467
- 10.13481/j.1671-587x.20170301
-
文章历史
- 收稿日期: 2016-09-08
缺血性心脏病是糖尿病患者的主要死亡原因之一[1],高血糖本身可以增加心肌梗死患者发生不良事件的风险[2]。在需要接受冠状动脉血运重建的患者中,糖尿病患者所占比例很高;对于冠状动脉旁路移植手术(coronary artery bypass grafting,CABG)和经皮冠状动脉治疗术(percutaneous transluminal coronary intervention,PCI)而言,糖尿病是一种特殊的挑战。目前经皮血运重建技术得到明显改进,但接受血运重建糖尿病患者的临床预后仍较非糖尿病患者差。在体动物实验[3]结果证实:高血糖可增加心脏对缺血损伤的易感性。目前关于糖尿病并发缺血性心脏病的病理生理机制尚不清楚,其有可能涉及氧化应激、炎症反应和胰岛素抵抗等。肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)是一种具有多种生物学作用的细胞因子,在炎症反应和细胞凋亡过程中发挥重要作用,参与细胞损伤的发生发展,但目前有关TNF-α在糖尿病心肌缺血损伤中的作用机制研究尚少。本研究以糖尿病心肌缺血模型兔作为研究对象,探讨糖尿病心肌缺血早期心肌细胞超微结构和细胞凋亡的变化,阐明其炎症因子的作用机制,为糖尿病心肌缺血的发病机制研究提供理论依据。
1 材料与方法 1.1 动物、主要试剂和仪器健康雄性新西兰大白兔42只,体质量2~3 kg,购于西安交通大学医学部实验动物中心,动物合格证号:SYXK(陕)2014-003。实验前兔均在动物中心适应性喂养1周。四氧嘧啶购于美国Sigma公司,TRIzol购于美国Invitrogen公司,Tunel DeadEndTM检测试剂盒购于美国Promega公司,Revert AidTM First Stand cDNA Synthesis Kit逆转录试剂盒购于美国Fermentas公司,SYBR ExScriptTMRT-PCR Kit(Perfect Real Time)试剂盒购于TaKaRa大连宝生物工程有限公司。荧光显微镜购于日本奥林巴斯公司,透射电子显微镜(JEM-100SX型)购于日本NEC公司,便携式血糖仪和血糖试纸购于德国拜耳公司。
1.2 1型糖尿病兔模型的建立[4]取26只新西兰大白兔,采用四氧嘧啶耳缘静脉注射方法建立1型糖尿病模型。采用生理盐水配制4%四氧嘧啶溶液,采用滤菌器过滤除菌,以100 mg·kg-1经兔耳缘静脉快速注射。给药前禁食4 h,给药后观察兔进食、饮水和排尿情况。给药后5 h静脉注射25%葡萄糖,每只4 mL,将饮用水换为50%葡萄糖液防止发生低血糖,12 h后换为正常水。72 h后测空腹血糖,空腹血糖<16 mmol·L-1的兔继续追加80 mg·kg-1四氧嘧啶溶液,14 d后测兔空腹血糖,以空腹血糖持续>16 mmol·L-1作为糖尿病造模成功标准。糖尿病造模过程中死亡4只兔,考虑为高血糖后的低血糖所致。另外16只兔作为正常对照组,耳缘静脉注射相同剂量的生理盐水,常规饮食并分笼喂养。
1.3 糖尿病兔心肌缺血模型的建立将存活的22只糖尿病兔以30 g·L-1戊巴比妥钠耳缘静脉麻醉,随后经耳缘静脉注射利多卡因(1 mg·kg-1)预防冠状动脉结扎过程中发生室性心律失常。将兔仰卧位固定于手术台上,备皮,沿胸骨左缘剪断左侧第3~4肋软骨,暴露纵隔和心脏,保持两侧胸膜完整,距左冠状动脉冠状窦开口4~5 mm处,用5/0无损伤带针缝合线穿过左前降支下方,将直径分别为0.8和0.1 mm的粗、细丝线各1根置于左前降支前缘,将丝线与左前降支一起结扎,随后迅速抽出细丝线,相当于血管90%狭窄。如左前降支远端血管充盈不明显,左心室前壁和心尖部心肌颜色稍变暗,表明结扎成功。正常对照组的16只兔行假手术过程,仅将缝合线穿过左前降支下方,但不结扎。术后常规饲养,肌肉注射青霉素(40万U/只)3 d预防感染。术中及术后2 d内共死亡6只兔,均为经冠状动脉结扎兔,原因为气胸和失血过多。
1.4 实验分组将存活的16只糖尿病兔分为糖尿病心肌缺血7 d组和28 d组(n=8),按照相对应时间点将正常对照组16只大鼠分为假手术对照7d组和28d组(n=8)。
1.5 TUNEL染色观察各组兔缺血心肌细胞凋亡指数(apoptosis index, AI)于术后7和28 d处死各组兔,每组8只,取出心脏,将缺血心肌组织放入4 %中性甲醛缓冲液中固定16 h后,常规石蜡包埋并制作4~5 μm厚切片,贴于洁净的载玻片上,室温过夜之后存放于干燥避光处备用。TUNEL法检测细胞核DNA断裂和细胞凋亡情况。根据制造商的说明书进行操作。在荧光显微镜下观察切片。每次检测均设置1例阴性对照。结果判断标准:在400倍荧光显微镜下观察,细胞核蓝染者为TUNEL阴性,代表正常细胞;细胞核黄染者为TUNEL阳性,代表凋亡细胞。每张切片不重复随机选取5个区域,每个区域计数100个心肌细胞,计算每百个心肌细胞中的凋亡心肌细胞数,即AI(AI=凋亡的心肌细胞数/100)。
1.6 透射电镜观察各组兔心肌细胞形态表现于术后7 d处死兔取出心脏,选取缺血区1 mm×1 mm×1 mm大小的组织在4%戊二醛磷酸缓冲液中固定2 h,4℃保存,PBS冲洗3次;然后用1%锇酸缓冲液4℃固定2 h,PBS冲洗3次;采用50%酒精对组织进行脱水,用无水丙酮脱水2次;树脂包埋,制备超薄切片,载膜铜网捞片,醋酸铀和柠蒙酸铅双重染色。采用JEM-100SX型透射电镜观察各组兔心肌细胞形态表现并拍照。
1.7 实时荧光定量PCR法检测兔缺血心肌组织中TNF-αmRNA表达水平通过基因数据库GenBank检索TNF-α基因序列,应用Primer 5.0软件设计引物,由北京三博远志生物公司合成引物。TNF-α上游引物为5′-CGTAGTAGCAAACCCGCAAGTG -3′,下游引物为5′-CGCTGAAGAGAACCTGGGAGTAG-3′,产物长度为210 bp;管家基因β-actin上游引物为5′-CCATCTACGAGGGCTACGC-3′,下游引物为5′-CGGCTGTGGTCACGAAGG-3′,产物长度为397 bp。
各组兔按各自观察时间点处死,取出心脏,切取左室前壁缺血心肌组织迅速置于液氮中保存。取新鲜组织样品100 mg,剪碎,加入1 mL TRIzol裂解细胞,匀浆后进行总RNA提取。对所提取的总RNA进行紫外分光光度定量,测定RNA在分光光度计260 nm和280 nm处的吸光度(A)值,计算A(260)/A(280) 值。
按照逆转录试剂盒说明书进行cDNA合成。在20 μL反应体系中分别加入样本RNA模板0.5 μg,随机六聚体引物(0.2 g·L-1) 1 μL,加入去RNA酶水至12 μL, 70 ℃孵育5 min;加入5×反应缓冲液4 μL,RNase抑制剂(20 g·L-1)1 μL,10 mmol·L-1 dNTP混合液2 μL,25℃孵育5 min,最后加入RevertAidTM M-MuLV反转录酶(200 μ·μL-1)1 μL,总体积为20 μL。混匀后置于下列条件反应:42 ℃、60 min,70 ℃、10 min,产物即为cDNA。
反应在美国iQ5 RealTime PCR仪上进行,采用25 μL反应体系,其中含SYBR GREEN PCR mix 12.5 μL去离子水10.5 μL,cDNA 1 μL(50 ng), 引物(5 mmol·L-1)各1 μL。PCR扩增条件:95 ℃、10 s预变性;95℃、5 s,57℃、15 s,72 ℃、10 s,共40个循环。取待测cDNA样品,按10倍浓度梯度稀释,在同样反应条件下进行PCR扩增。
采用相对定量分析法中比较2-ΔΔCT法,利用公式F=2-ΔΔCT得到TNF-α mRNA的表达水平。
1.8 统计学分析采用GraphPad Prism 4.0统计软件进行统计学分析。各组兔心肌细胞的AI和TNF-α表达水平以x±s表示,组间比较采用单因素方差分析。以α=0.05为检验水准。
2 结果 2.1 术后各组兔心肌细胞的AITUNEL染色可见假手术对照组兔心肌组织中未观察到凋亡细胞,糖尿病心肌缺血组兔心肌组织中可观察到明显的凋亡细胞(图 1,见插页一)。糖尿病心肌缺血7d组和28d组兔心肌细胞AI均明显高于假手术对照组(P<0.05),并且7 d组兔心肌细胞AI高于28 d组(P<0.05)。见图 2。
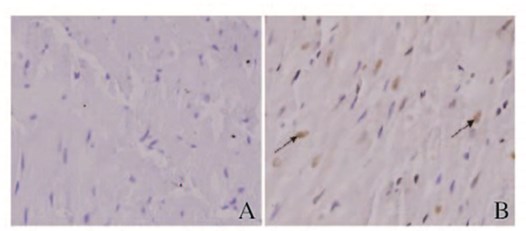
|
| 图 1 术后7 d假手术对照组(A)和糖尿病心 肌缺血组(B)兔心肌组织中凋亡细胞形态表现 (TUNEL,bar=20 μm) Figure 1 Morphology of apoptotic cells in myocardium tissue of rabbits in sham operation group (A) and diabetic myocardial ischemia group (B) 7 d after operation (TUNEL,bar = 20 μm) |
|
|
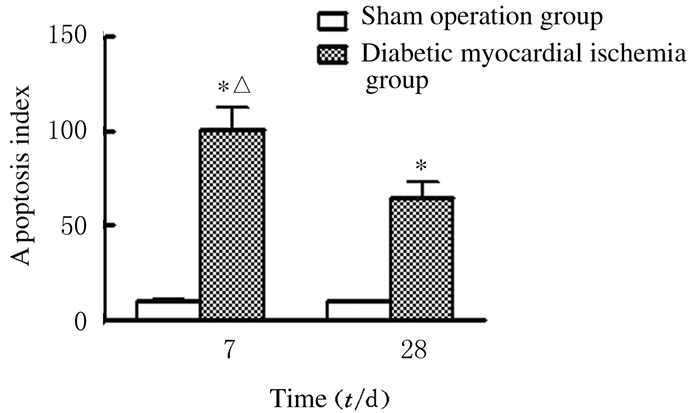
|
| *P < 0.05 vs sham operation group; △P < 0.05 vs 28d group. 图 2 术后各组兔心肌细胞凋亡指数 Figure 2 Apoptosis index of myocardial cells of rabbits in various groups |
|
|
透射电镜下观察:术后7d,假手术对照组兔心肌细胞核较大,呈梭型,位于细胞的中央,核内染色质分布均匀,核仁明显,大量肌原纤维排列规则,Z线结构清晰,肌节基本整齐,肌原纤维间线粒体丰富,线粒体嵴密集,结构清晰;糖尿病心肌缺血组兔心肌缺血区心肌细胞肿胀,细胞核形状不规则,核内染色质分布基本均匀,肌原纤维结构松散,肌节不整,电子密度较低,部分肌原纤维断裂,心肌细胞间线粒体增生明显,大小不一。见图 3。

|
| 图 3 术后7d假手术对照组(A-C)和糖尿病心肌缺血组(D-F)兔心肌细胞的形态表现(bar=2 μm) Figure 3 Morphology of myocardial cells of rabbits in sham operation group (A-C) and diabetic myocardial ischemia group (D-F) 7 d after operation (bar=2 μm) |
|
|
与假手术对照组比较,术后7 d和28 d糖尿病心肌缺血组兔心肌组织中TNF-α mRNA表达水平均明显升高(P<0.05);术后7 d糖尿病心肌缺血组兔心肌组织中TNF-α mRNA表达水平明显高于术后28 d(P<0.05)。见图 4。
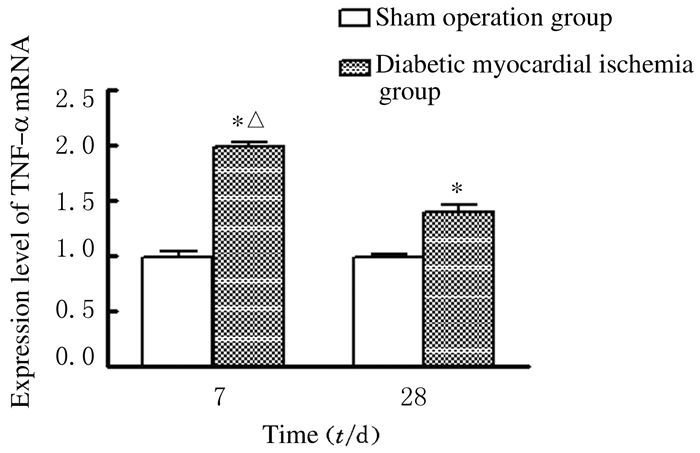
|
| *P < 0.05 vs sham operation group; △P < 0.05 vs 28d group. 图 4 各组兔缺血心肌组织中TNF-α mRNA表达水平 Figure 4 Expression levels of TNF-α mRNA in ischemic myocardium tissue of rabbits in various groups |
|
|
糖尿病是缺血性心脏病的独立危险因素,缺血性心脏病是糖尿病患者死亡的主要因素之一[1]。糖尿病并发缺血性心脏病患者的冠状动脉病变广泛,且呈弥漫性分布,冠状动脉管腔狭窄程度高,需要进行PCI或CABG治疗的概率明显高于非糖尿病患者。动物实验结果[5]证实:与非糖尿病大鼠比较,糖尿病大鼠心脏对缺血损伤的敏感性较高,且损伤严重。研究[6]显示:糖尿病并发心肌缺血损伤的机制可能与动脉粥样硬化的进展加速,胰岛素抵抗,氧化应激,炎症细胞因子、能量代谢紊乱以及离子通道功能障碍等有关。
胰岛素抵抗是指胰岛素作用的靶器官(主要是肝脏、肌肉和脂肪组织)对胰岛素作用的敏感性降低。动物实验[7]证明:胰岛素抵抗可引发炎症反应,从而加重糖尿病心肌缺血损伤,促进心肌细胞凋亡和坏死,并且缺血心肌周围炎症细胞因子如TNF-α、白细胞介素6(interleukin-6, IL-6) 和IL-10等表达水平升高。
研究[8]显示:氧化应激是促进糖尿病心肌缺血损伤的重要因素。体内研究[9]显示:糖尿病患者体内多种抗氧化酶表达水平降低,如超氧化物歧化酶(superoxide dismutase, SOD),可导致氧自由基清除减少,进一步增加过氧化物的产生。动物实验[10]证实:慢性心肌缺血兔模型早期缺血心肌组织中炎症细胞因子表达水平升高,如血管内皮生长因子(vascular endothelial growth factor, VEGF)和TNF-α。
TNF-α是心肌缺血后活性升高的细胞因子,参与了许多心血管疾病的病理生理过程,如心肌病、心肌梗死和心力衰竭[11-12]。TNF-α可以通过激活TNF1型受体(TNFR1) 诱导细胞凋亡[13]。由于心肌细胞本身对于各种刺激能够释放TNF-α[14],局部产生的TNF-α可能是心肌细胞凋亡和心肌功能紊乱的调节因子。急性心肌梗死时,心肌组织中TNF-α表达水平升高[15],并且可以吸引中性粒细胞迁移至缺血处,加重了炎症反应,促进了组织损伤进展[16]。动物研究[13]显示:糖尿病心肌病大鼠血清中TNF-α水平明显升高,可能参与了糖尿病心肌病的发生发展。研究[17]显示:大鼠在糖尿病发生10~12周时出现心肌细胞增生肥大和心肌受损,出现糖尿病心肌病病理表现,同时炎症细胞因子TNF-α表达水平升高。本研究结果显示:糖尿病并发心肌缺血早期兔心肌组织中TNF-α表达水平升高,这可能与心肌缺血缺氧诱导局部炎症反应有关,进一步证实TNF-α在糖尿病并发心肌缺血损伤中发挥重要作用,促进了心肌细胞损伤。
综上所述,糖尿病心肌缺血兔早期缺血区心肌细胞超微结构改变明显,缺血区出现心肌细胞凋亡,同时炎症细胞因子TNF-α表达水平明显升高,促进了心肌损伤。本研究结果提示:对糖尿病患者应该提倡早期预防和治疗,控制血糖尽早达标,防止糖尿病进一步发展出现缺血性心脏病。
| [1] | Kumarathurai P, Anholm C, Nielsen OW, et al. Effects of the glucagon-like peptide-1 receptor agonist liraglutide on systolic function in patients with coronary artery disease and type 2 diabetes:a randomized double-blind placebo-controlled crossover study[J]. Cardiovasc Diabetol, 2016, 15(1): 105. DOI:10.1186/s12933-016-0425-2 |
| [2] | Kowalczyk J, Mazurek M, Zielinska T, et al. Prognostic significance of HbA1c in patients with AMI treated invasively and newly detected glucose abnormalities[J]. Eur J Prev Cardiol, 2015, 22(6): 798–806. DOI:10.1177/2047487314527850 |
| [3] | Yin T, Hou R, Liu S, et al. Nitrative inactivation of thioredoxin-1 increases vulnerability of diabetic hearts to ischemia/reperfusion injury[J]. J Mol Cell Cardiol, 2010, 49(3): 354–361. DOI:10.1016/j.yjmcc.2010.05.002 |
| [4] | 杨亚冬, 张文元, 赵佳骏, 等. 骨髓间充质干细胞联合血管内皮生长因子移植治疗糖尿病兔下肢缺血的实验研究[J]. 医学研究杂志, 2015, 44(6): 47–51. DOI:10.11969/j.issn.1673-548X.2015.06.014 |
| [5] | Povlsen JA, Lofgren B, Dalgas C, et al. Protection against myocardial ischemia-reperfusion injury at onset of type 2 diabetes in Zucker diabetic fatty rats is associated with altered glucose oxidation[J]. PLoS One, 2013, 8(5): e64093. |
| [6] | 何志鹏, 孙维福, 王松, 等. 糖尿病心肌缺血/再灌注损伤机制及治疗进展[J]. 医学综述, 2013, 19(5): 906–909. |
| [7] | Kitsios K, Tsapas A, Karagianni P. Glycemia and cardiovascular risk:challenging evidence based medicine[J]. Hippokratia, 2011, 15(3): 199–204. |
| [8] | Ansley DM, Wang B. Oxidative stress and myocardial injury in the diabetic heart[J]. J Pathol, 2013, 229(2): 232–241. DOI:10.1002/path.4113 |
| [9] | Tangvarasittichai S. Oxidative stress, insulin resistence, dyslipidemia and type 2 diabetes mellitus[J]. World J Diabetes, 2015, 6(3): 456–480. DOI:10.4239/wjd.v6.i3.456 |
| [10] | Zhao Q, Sun C, Xu X, et al. CD34+ cell mobilization and upregulation of myocardial cytokines in a rabbit model of myocardial ischemia[J]. Int J Cardiol, 2011, 152(1): 18–23. DOI:10.1016/j.ijcard.2010.06.017 |
| [11] | Zhang O, Ji Q, Lin Y, et al. Circulating chemerin levels elevated in dilated cardiomyopathy patients with overt heart failure[J]. Clin Chim Acta, 2015, 448: 27–32. DOI:10.1016/j.cca.2015.05.018 |
| [12] | Zarrouk-Mahjoub S, Zaghdoudi M, Amira Z, et al. Pro-and anti-inflammatory cytokines in post-infarction left ventricular remodeling[J]. Int J Cardiol, 2016, 221: 632–636. DOI:10.1016/j.ijcard.2016.07.073 |
| [13] | 赵娅, 刘飞, 古远云, 等. 胰蛋白酶与2型糖尿病心肌病发病机制[J]. 重庆医科大学学报, 2015, 40(7): 997–1000. |
| [14] | Prabhu SD, Frangogiannis NG. The biological basis for cardiac repair after myocardial infarction:from inflammation to fibrosis[J]. Circ Res, 2016, 119(1): 91–112. DOI:10.1161/CIRCRESAHA.116.303577 |
| [15] | Somasuntharam I, Yehl K, Carroll SL, et al. Knockdown of TNF-α by DNAzyme gold nanoparticles as an anti-inflammatory therapy for myocardial infarction[J]. Biomaterials, 2016, 83: 12–22. DOI:10.1016/j.biomaterials.2015.12.022 |
| [16] | Liu J, Wang H, Li J. Inflammation and inflammatory cells in myocardial infarction and reperfusion injury:a double-edged sword[J]. Clin Med Insights Cardiol, 2016, 10: 79–84. |
| [17] | 孙晓慧, 牟艳玲. 糖尿病心肌病血清标志物的研究进展[J]. 山东医药, 2015, 55(41): 96–98. DOI:10.3969/j.issn.1002-266X.2015.41.040 |
 2017, Vol. 43
2017, Vol. 43


