扩展功能
文章信息
- 翟玥, 曲笑锋, 庞博, 李丽, 徐坤, 王梦涵, 高孜博, 宋佳音, 宋秀玲, 金明华
- ZHAI Yue, QU Xiaofeng, PANG Bo, LI Li, XU Kun, WANG Menghan, GAO Zibo, SONG Jiayin, SONG Xiuling, JIN Minghua
- 副溶血性弧菌高免卵黄抗体的制备和不同提纯方法效果的比较
- Preparation of high immunity yolk antibody against Vibrio parahemolyticus and comparison of effectiveness between different extraction methods
- 吉林大学学报(医学版), 2017, 43(02): 441-445
- Journal of Jilin University (Medicine Edition), 2017, 43(02): 441-445
- 10.13481/j.1671-587x.20170245
-
文章历史
- 收稿日期: 2016-09-13
鸡卵黄抗体 (immunoglobulin of egg yolk,IgY) 是由母鸡血液中的IgG经过受体介导转移至卵黄中的一种免疫球蛋白[1]。与哺乳动物的IgG相比,IgY具有许多不可替代的优势,如具有良好的稳定性,具有一定的耐热、耐酸碱及耐高渗性能;鸡蛋收集方便,无需抽取动物血液即可获得抗体,对动物无损伤,符合现代动物保护规则[2-4]。哺乳动物之间的亲缘关系更为接近,用哺乳动物制备的抗体有可能会造成动物间病原体的传播,而鸡的病原体往往不会与哺乳动物产生过敏反应或交叉血清反应,同时,高度保守的哺乳动物蛋白质对种系发生学上距离较远的禽类通常具有较强的免疫原性,易于刺激鸡的免疫系统引起免疫应答,因此,产生有效免疫反应所需的抗原量小,也容易获得大量的抗体[5]。随着人们对IgY研究的深入,其在免疫学检测、某些疾病防治方面具有比哺乳动物IgG更大的优势,也被称为一种新生代抗体[6-7]。
虽然鸡蛋能够提供廉价丰富的IgY (每枚鸡蛋含100~250 mg IgY),但是由于卵黄中含有丰富的营养物质,是细菌生长的良好培养基,容易导致IgY腐败变质,而且卵黄液内脂肪含量丰富且多与蛋白质结合形成脂蛋白,故如何将IgY从大量脂肪中高效地提取纯化出来是IgY能否被广泛应用、实现大规模工业化生产的关键[8]。本研究采用副溶血性弧菌免疫高产蛋鸡,收集鸡蛋,选取文献报道中最为常见、操作相对简单、仪器要求较低的3种IgY提纯方法进行提取纯化,通过分析提取率、抗体效价和纯度,以期找到最理想的IgY提纯方法,为IgY的规模化生产提供科学的依据。
1 材料与方法 1.1 实验动物、菌株、主要试剂与仪器无特定病原 (specific pathogen free,SPF) 蛋鸡购自山东昊泰实验动物繁育有限公司。副溶血性弧菌菌株 (ATCC 17802) 为本教研室保存菌株。弗氏完全佐剂、弗氏不完全佐剂和聚乙二醇 (PEG)-6000均购自美国Sigma公司,SDS-PAGE试剂盒购自北京康为世纪生物科技有限公司,BCA蛋白浓度测定试剂盒和彩色预染蛋白质相对分子质量标准均购自上海碧云天生物技术有限公司,其他常规化学试剂均购自北京化工厂。双层不锈钢隔离饲养箱购于苏州市冯氏实验动物设备有限公司,低温高速离心机购于美国Beckman公司,电子天平购于上海越平科学仪器有限公司,全波段酶标仪购自美国Biotech公司,垂直电泳仪及凝胶成像分析仪购自上海天能科技有限公司。
1.2 免疫蛋鸡和收集卵黄液SPF蛋鸡采用单元式笼养方式饲养于双层不锈钢隔离饲养箱中,箱内设定恒定温度20℃,相对湿度70 %,保持24 h通风良好,每日光照12 h。为维持其SPF状态,所饲喂的水及饲料均于饲喂前24 h内进行高压灭菌处理。将灭活的副溶血性弧菌菌液 (2.0×109 CFU·mL-1) 与等量的弗氏完全佐剂/弗氏不完全佐剂混合,搅拌至完全乳化状态,得到弗氏完全佐剂疫苗/弗氏不完全佐剂疫苗。采用肌肉多点注射的方式将疫苗接种于鸡胸。首次免疫采用弗氏完全佐剂疫苗,每只鸡1 mL,间隔2周后采用弗氏不完全佐剂疫苗进行第2次免疫,随后每隔2周进行1次强化免疫。编号后储存于4℃冰箱中。取免疫8周后的鸡蛋作为阳性蛋,取免疫前收集的鸡蛋作为阴性蛋,用自来水冲洗干净鸡蛋表面污渍,再用75%酒精擦拭消毒2次,于无菌条件下轻轻打破蛋壳。使用蛋黄分离器对卵黄、卵白进行初步分离后,将卵黄置于滤纸上,除去残留于卵黄膜表面的卵白。轻轻刺破卵黄膜,收集卵黄液,将收集到的卵黄液进行搅拌,保证卵黄抗体均匀分布。
1.3 3种方法提纯IgYPEG-6000沉淀法[9]:取3 mL卵黄,加入2倍体积PBS缓冲液和质量浓度为3.5%的PEG-6000,震荡混匀10 min,4℃、10000 r·min-1离心20 min,过滤,将滤液转移至新的离心管中,加入质量浓度为8.5%的PEG-6000,震荡混匀10 min,4℃、10000 r·min-1离心20 min,弃上清,加入10 mL PBS缓冲液重悬沉淀,加入1.2 g PEG-6000,震荡混匀10 min,4℃、10000 r·min-1离心20 min,弃上清,沉淀即为IgY。加入1.0 mL PBS缓冲液重悬沉淀后,0.1%生理盐水搅拌透析过夜后换用PBS缓冲液透析4 h。使用超滤离心管将得到的IgY溶液浓缩至1.5 mL。
氯仿抽提法[10]:取3 mL卵黄,加入6 mL无菌生理盐水,搅拌成卵黄稀释液。加入2倍氯仿,充分摇匀,室温静置1~2 h,3000 r·min-1离心15~20 min,收集上清液 (水层),得IgY溶液,将得到的IgY溶液浓缩至1.5 mL。
氯仿/PEG法[11]:取3 mL卵黄,加入9 mL PBS缓冲液,混匀,再加入12 mL氯仿混匀。3000 r·min-1离心30 min,离心后取最上层清液。加入质量浓度为12%的PEG-6000,搅拌均匀,室温作用30 min。3 000 r·min-1离心30 min,弃去上清。用1.0 mL PBS重悬沉淀。0.1%生理盐水搅拌透析过夜后换用PBS缓冲液透析4 h。将得到的IgY溶液浓缩至1.5 mL。
1.4 IgY蛋白水平测定采用BCA蛋白浓度测定试剂盒测定提取的IgY的蛋白水平,严格按照说明书进行操作,分别测定不同提纯方法获得的IgY提取物的蛋白水平。采用酶标仪读取562 nm波长处样品的吸光度 (A) 值,以蛋白标准品的浓度为横坐标,A值为纵坐标,绘制标准曲线,并分别计算样品的蛋白水平。
1.5 IgY效价测定采用间接ELISA法,测定IgY的效价。具体操作如下:将副溶血性弧菌用包被液 (pH=9.6的碳酸盐缓冲液)1:400稀释后包被于96孔酶标板,每孔100 μL,4℃过夜;PBST洗板3次后,每孔加入300 μL1%BSA进行封闭,37℃孵育2 h后,PBST洗板3次,加入待测样品,稀释倍数依次为1:200、1:400、1:800、1:1600、1:3200、1:6400、1:12800、1:25600、1:51200、1:102400、1:204800、1:409600,每孔100 μL,37℃孵育1 h。PBST洗板3次,加入HRP标记的山羊抗鸡二抗,1:10000稀释,每孔100 μL,37℃孵育1 h。PBST洗板3次,加入TMB底物显色液,每孔100 μL,室温避光显色15 min,每孔加入50 μL终止液 (2mol·L-1 H2SO4),采用酶标仪读取450 nm处的A值。计算阳性A (450) 值/阴性A (450) 值 (即P/N),以P/N≥2.1时抗体的稀释度作为抗副溶血性弧菌抗体效价。
1.6 IgY纯度测定采用SDS-PAGE法检测IgY的纯度。配制12%分离胶和5%浓缩胶进行电泳,电泳结束后,采用考马斯亮蓝染液染色30 min,并采用脱色液进行脱色。于凝胶成像系统中采集图片,进行结果分析。
2 结果 2.1 IgY蛋白水平采用BCA蛋白浓度测定试剂盒检测所提纯的IgY的蛋白水平,标准曲线为y=0.261x+0.079,R2=0.997。根据所得到的标准曲线方程,计算得待测IgY溶液的蛋白水平见表 1。每毫升卵黄中IgY提取量最高的是氯仿抽提法,其次为氯仿/PEG法,最低的为PEG沉淀法。
| [ρB/(g·L-1)] | |||
| Method | Protein content | Extraction amount | |
| PEG method | (+) | 1.18 | 0.590 |
| (-) | 1.13 | 0.565 | |
| Chloroform/PEG | (+) | 2.54 | 1.270 |
| method | (-) | 3.58 | 1.790 |
| Chloroform | (+) | 1.37 | 0.685 |
| method | (-) | 1.57 | 0.785 |
采用间接ELISA法测定3种方法提纯的IgY的效价,结果见图 1。其中采用氯仿法提纯的IgY的效价最高,其次为氯仿/PEG法,PEG法效价最低, 依次为1:25600、1:12800和1:6400。
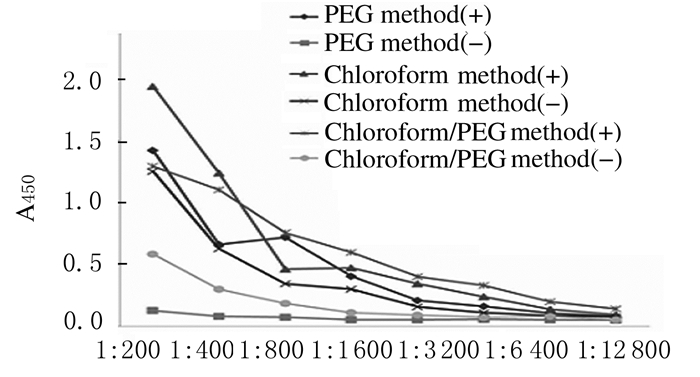
|
| 图 1 3种方法提纯的IgY效价 Figure 1 Titers of IgY extracted by three methods |
|
|
采用SDS-PAGE法对3种方法提纯的IgY的纯度进行鉴定,结果见图 2。IgY的相对分子质量约为180 000,由2条轻链 (相对分子质量19 000~30 000) 和2条重链 (分别60 000~80 000) 组成。由于3种提取方法所提纯出的IgY为卵黄中总IgY,其中包括免疫副溶血性弧菌疫苗后产生的IgY,因此在阴性蛋中也可以观察到IgY的重链和轻链。由图 2可知,当上样量相同时,采用PEG法提纯的IgY纯度最好,其次为氯仿/PEG法,氯仿抽提法提纯的IgY纯度最差,但是提纯的量最多,该结果也与蛋白水平测定结果相符合。
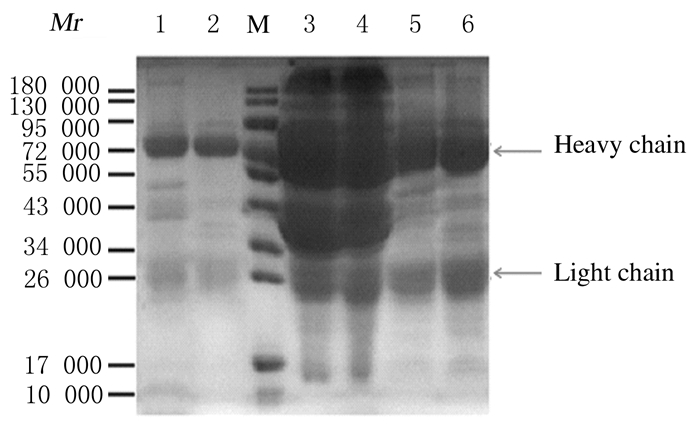
|
| Lane 1: IgY extracted by PEG method (+); Lane 2: IgY extracted by PEG method (-); M: Protein marker; Lane 3: IgY extracted by chloroform method (+); Lane 4: IgY extracted by chloroform method (-); Lane 5: IgY extracted by chloroform/PEG method (+); Lane 6:IgY extracted by chloroform/PEG method (-). 图 2 3种方法提纯的IgYSDS-PAGE电泳图 Figure 2 SDS-PAGE electrophoregram of IgYextracted by three methods |
|
|
卵黄的主要成分为水、蛋白质和脂肪,其中几乎所有的蛋白质和脂肪均结合形成了脂蛋白。IgY是一种存在于卵黄中的水溶性免疫球蛋白,根据其溶于水的特征,其应该存在于提取的水相中[12]。本实验从提取物蛋白水平、IgY效价、IgY纯度、操作过程、成本投入、安全性等方面比较了PEG法、氯仿/PEG法和氯仿抽提法对副溶血性弧菌IgY的影响[13]。蛋白水平测定结果显示:氯仿抽提法优于氯仿/PEG法和PEG沉淀法,抗体效果测定结果显示氯仿抽提法效价最高,氯仿/PEG法次之,PEG法效价最低,但是氯仿抽提法和氯仿/PEG法所测得的阴性蛋中IgY的效价均高于PEG法,可能是由于提取液中残留的氯仿影响了酶标板的吸附能力,从而增加了其非特异性吸附,进而导致阴性值偏高。IgY的相对分子质量约为180 000,由2条轻链 (相对分子质量19 000~30 000) 和2条重链 (相对分子质量60 000~80 000) 组成[14-15]。SDS-PAGE电泳结果显示:当上样体积相同时,采用PEG法提纯的IgY纯度最好,其次为氯仿/PEG法,氯仿抽提法提纯的IgY在位于重链和轻链间可见明显杂质蛋白集团,说明氯仿抽提法纯度最差,但由于氯仿抽提法提纯的IgY提取量最多,所以电泳结果中氯仿抽提法泳道中条带最粗,氯仿/PEG法虽可见较少杂质蛋白,但同时也可观察到IgY重链和轻链条带较粗,颜色较深,说明在提取物中所获IgY浓度较高。
从提取物蛋白水平、IgY效价、IgY纯度、操作过程、成本投入、安全性等方面综合考虑PEG沉淀法、氯仿抽提法和氯仿/PEG法这3种IgY的提纯方法。本实验结果显示:PEG法安全性较好,但提纯效率相对较低,耗时长,成本投入较高,仅适用于实验室的少量提取;氯仿抽提法操作简便,耗时较短,成本比PEG法低,能够高效地从卵黄中获得蛋白,但提纯物中掺杂了大量的杂质蛋白,同时由于氯仿能够经口、皮肤和呼吸道进入人体,引起急慢性中毒、生殖毒性及慢性肝肾毒性等,因此在IgY提纯过程中存在的环境污染问题和氯仿残留需要引起重视[16-17];氯仿/PEG法结合了前两者的优点,提纯效率高,抗体纯度好。虽然为保证其安全性,仍需对提取物进行进一步的纯化以去除残留氯仿,但综合看来,氯仿/PEG法具有生产成本低、对环境污染较小、提纯率高、提纯的IgY质量好等优点,比较适合IgY的工业化生产。
综上所述,PEG沉淀法、氯仿抽提法和氯仿/PEG法这3种IgY的提纯方法均存在各自的优缺点,应该根据实际情况进行选择,争取效益最大化。
| [1] | 闫俊, 赵小玲, 陈伟强, 等. 抗日本血吸虫Sjp40鸡卵黄抗体的制备及其生物学特性鉴定[J]. 解放军预防医学杂志, 2013, 31(6): 487–489. |
| [2] | Guo Y, Gao M, Zhang H, et al. Molecular characterization and B cell membrane expression analysis of Fc fragment gene of goose IgY[J]. Res Vet Sci, 2014, 97(2): 288–291. DOI:10.1016/j.rvsc.2014.07.005 |
| [3] | Mclaren RD, Prosser CG, Grieve RC, et al. The use of caprylic acid for the extraction of the immunoglobulin fraction from egg yolk of chickens immunised with ovine alpha-lactalbumin[J]. J Immunol Methods, 1994, 177(1/2): 175–184. |
| [4] | 段琳, 赵文锋, 丁建坤, 等. 卵黄抗体开发现状及应用进展[J]. 中国生化药杂志, 2010, 31(3): 212–215. |
| [5] | Duan HL, He QY, Zhou B, et al. Anti-trimeresurus albolabris venom IgY antibodies:preparation, purification and neutralization efficacy[J]. J Venom Anim Toxins Incl Trop Dis, 2016, 22(1): 23. DOI:10.1186/s40409-016-0078-3 |
| [6] | 蒋兴龙, 江国永, 成国祥. 几种从鸡血浆中提取免疫球蛋白IgY方法的比较[J]. 饲料与畜牧, 2015(3): 64–67. |
| [7] | 张彩虹, 祝贺, 高又文, 等. 抗非洲猪瘟病毒VP73蛋白鸡卵黄抗体的制备及鉴定[J]. 中国兽医科学, 2015, 45(8): 821–825. |
| [8] | 高建, 周玉春, 黄宇烽. 鸡卵黄抗体的纯化及临床应用[J]. 中华男科学杂志, 2008, 14(2): 166–170. |
| [9] | Pauly D, Chacana PA, Calzado EG, et al. IgY technology:extraction of chicken antibodies from egg yolk by polyethylene glycol (PEG) precipitation[J]. J Vis Exp, 2011(51): 3084. |
| [10] | 林婷婷, 王全溪. 两种卵黄抗体不同提取方法的比较试验[J]. 福建畜牧兽医, 2015, 37(3): 3–6. |
| [11] | Polson A. Isolation of IgY from the yolks of eggs by a chloroform polyethylene glycol procedure[J]. Immunol Invest, 1990, 19(3): 253–258. DOI:10.3109/08820139009041840 |
| [12] | Nasiri K, Nassiri MR, Tahmoorespur M, et al. Production and characterization of egg yolk antibody (IgY) against recombinant VP8-S2 antigen[J]. Pol J Vet Sci, 2016, 19(2): 271–279. |
| [13] | Lévesque S, Martinez G, Fairbrother JM. Improvement of adjuvant systems to obtain a cost-effective production of high levels of specific IgY[J]. Poult Sci, 2007, 86(4): 630–635. DOI:10.1093/ps/86.4.630 |
| [14] | 刘瑞生, 张洪波, 薛掌林, 等. 鸡新城疫卵黄抗体提取方法筛选研究[J]. 国外畜牧学-猪与禽, 2014, 34(6): 57–59. |
| [15] | 侯亚琴, 贾丽云, 王丽. 卵黄抗体检测法在禽流感免疫监测中的应用[J]. 当代畜牧, 2009(5): 15–16. |
| [16] | 陈志蓉, 裴新荣, 张凤兰, 等. 氯仿毒性的研究进展及法规管理现状[J]. 癌变·畸变·突变, 2014, 26(1): 71–74. |
| [17] | Adaramoye OA, Azeez AF, Ola-Davies OE. Ameliorative effects of chloroform fraction of Cocos nucifera L.husk fiber against cisplatin-induced toxicity in rats[J]. Pharmacognosy Res, 2016, 8(2): 89–96. DOI:10.4103/0974-8490.172658 |
 2017, Vol. 43
2017, Vol. 43


