扩展功能
文章信息
- 周明伟, 王连有, 姜日花, 朱明姬, 陈凤
- ZHOU Mingwei, WANG Lianyou, JIANG Rihua, ZHU Mingji, CHEN Feng
- A型肉毒素联合疗法治疗瘢痕疙瘩临床疗效和不良反应评价
- Evaluation on efficacy and adverse reactions of combined therapy with botulinum toxin type A in treatment of keloid
- 吉林大学学报(医学版), 2017, 43(02): 386-390
- Journal of Jilin University (Medicine Edition), 2017, 43(02): 386-390
- 10.13481/j.1671-587x.20170234
-
文章历史
- 收稿日期: 2016-12-23
2. 吉林大学中日联谊医院病理科, 吉林 长春 130033
2. Department of Pathology, China-Japan Union Hospital, Jilin University, Changchun 130033, China
瘢痕疙瘩是以胶原为主的细胞外基质成分过度沉积导致的一种皮肤纤维化疾病,皮损向周围正常皮肤浸润且边界超过原有损伤范围。瘢痕疙瘩不但影响外观,伴随瘙痒和疼痛,发生在关节等部位还会导致关节活动障碍,影响生活质量,给患者带来巨大的心理压力。皮损内注射糖皮质激素是目前治疗瘢痕疙瘩的常用一线疗法[1],但是单纯皮损内注射往往难以达到令人满意的疗效,少数痛痒严重的患者经正规激素治疗后痛痒无明显缓解,且瘢痕容易反跳。近年来国外研究[2-4]报道:A型肉毒素 (botulinum toxin type A,BTA) 在体内和体外实验中可以促进伤口修复,减少瘢痕形成,抑制瘢痕疙瘩成纤维细胞增殖,但是在临床研究中结果不尽相同,并且未见A型肉毒素联合透明质酸及得宝松治疗的报道。因此本文作者采用A型肉毒素联合得宝松局部注射及透明质酸外用与单纯得宝松局部注射及透明质酸外用治疗瘢痕疙瘩进行对比研究,探讨其临床疗效及不良反应。
1 资料与方法 1.1 研究对象所有患者均为2015年1月—2016年6月本院皮肤科就诊的瘢痕疙瘩患者。纳入标准:符合瘢痕疙瘩诊断标准[5], 皮损厚度1~5mm;皮损面积≤10cm2;痛痒症状明显;之前未进行过正规治疗。排除标准:皮损3个月内接受过治疗;皮损内感染;患有严重内科疾病、系统性感染、肿瘤、免疫缺陷性疾病及自身免疫性疾病;孕妇及哺乳期妇女;患有精神疾患及不能配合本试验者。按纳入标准筛选出58例患者,每例患者选1处典型皮损进行研究。58例瘢痕疙瘩皮损均质硬,颜色潮红或边缘有浸润现象,触碰时痛痒加重。因A型肉毒素费用较高,按患者使用意愿将患者分为2组:A型肉毒素联合得宝松 (复方倍他米松注射液) 局部注射及透明质酸外用组 (联合治疗组)28例和单纯得宝松局部注射及透明质酸外用组 (对照组)30例。联合治疗组男性16例,女性12例;年龄16~52岁,平均年龄 (30.7±5.4) 岁;病程6个月~20年,平均 (5.6±1.8) 年;皮损部位躯干18例,四肢10例。对照组男性17例,女性13例;年龄18~55岁,平均年龄 (33.1±7.2) 岁;病程1~23年,平均 (6.0±2.1) 年;皮损部位躯干22例,四肢8例。2组患者性别、年龄、病程和皮损部位等比较差异无统计学意义 (P > 0.05),具有可比性。本研究通过吉林大学中日联谊医院伦理委员会批准,所有患者均签署知情同意书。
1.2 药物和仪器复方倍他米松注射液 (得宝松,Diprospan,1 mL/支,美国先灵葆雅公司),含二丙酸倍他米松5 mg,倍他米松磷酸钠2 mg;注射用A型肉毒素 (保妥适,Botox,100U/支,美国Allergan公司);透明质酸修护生物膜 (滇虹药业集团股份有限公司)。疼痛视觉模拟评分尺 (北京清华紫光制药厂)。
1.3 治疗方法对照组和联合治疗组患者均采用得宝松进行瘢痕疙瘩皮损内注射,注射剂量0.2mL·cm-3,总量每次不超过1mL/人,2组患者均为每4周注射1次,连续3次,皮损每日外用透明质酸1次。联合治疗组患者除上述治疗外,在第1次皮损内注射得宝松后,即刻在瘢痕疙瘩皮损周围单次注射A型肉毒素,用0.9%生理盐水2.5mL稀释至40 U·mL-1,间隔1 cm注射1点,4 U/点,总量不超过100 U/人,仅注射1次。收集入组病例每次治疗前后相关评价疗效的参数数据和不良反应,每次治疗前后拍摄临床照片。
1.4 疗效评价标准①痛痒感测量:用视觉模拟评分法 (visual analogy scale,VAS)[6-7]评估痛痒症状的变化。VAS是根据患者判定的痛痒严重程度的相对评分。10cm的游动标尺,0 cm表示无痛痒,10 cm代表最严重的痛痒,患者根据痛痒程度滑动标定物至相应位置所对应的刻度为痛痒相对评分。每月进行1次VAS评估。②皮损厚度测量:用彩超测量治疗前后瘢痕疙瘩皮损厚度。每个皮损测3个不同位置后取平均值。③皮损反跳时间:经治疗后痛痒症状再次出现或加重,或皮损厚度较治疗后增加为反跳。给患者发放自觉症状评价量表,每周1次自行填写,治疗结束后收集所有评价量表,并在结束治疗3个月后再次随访反跳情况。
1.5 统计学分析采用SPSS 20.0统计软件进行统计学分析。2组患者3次治疗后VAS值和皮损厚度以x±s表示,组间比较采用双因素方差分析 (正态分布) 和Mann-Whitney检验 (非正态分布);2组患者注射后不良反应发生率比较采用χ2检验。以P < 0.05为差异有统计学意义。
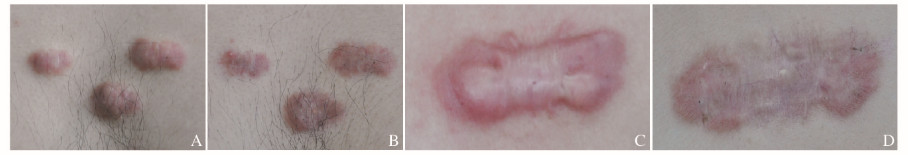
2 结果 2.1 2组患者瘢痕疙瘩大体观察治疗前,58例瘢痕疙瘩皮损均质硬,颜色潮红或边缘有浸润现象。对照组患者首次注射1个月后,瘢痕疙瘩中央区域颜色变暗,但皮损边缘仍较红;治疗第2和3个月时,瘢痕疙瘩周边红色充血区域较治疗第1个月时无明显变化,皮损厚度较治疗前有所减小。联合治疗组患者首次治疗1个月后,瘢痕疙瘩中央及周边区域均颜色变暗;治疗2个月时,瘢痕疙瘩颜色暗红;治疗3个月时,瘢痕疙瘩颜色暗紫,皮损厚度明显减低。见图 1(插页一)。
|
| A, B: Control group; C, D: Combined group; A, C: Before treatment; B, D: 3 month after treatment. 图 1 2组患者治疗前后瘢痕疙瘩大体观察结果 Figure 1 Results of gross observation of keloid of patients in two groups before and after treatment |
|
|
治疗前2组患者VAS值比较差异无统计学意义 (P > 0.05)。对照组患者治疗1个月时VAS值有所下降,但在2和3个月时又逐渐上升并接近治疗前水平。联合治疗组患者治疗1、2和3个月时VAS值逐渐下降,在2和3个月时与对照组比较VAS值差异有统计学意义 (P < 0.05)。见表 1。联合治疗组患者治疗3个月时,与治疗前比较,VAS值下降了51.3%,表明患者痛痒症状得到明显缓解。
| (x±s) | |||||
| Group | n | VAS value | |||
| Before treatment | 1 month | 2 month | 3 month | ||
| Control | 30 | 8.51±0.43 | 6.18±0.55 | 7.02±0.16 | 7.55±0.57 |
| Combined | 28 | 8.37±0.92 | 5.31±0.47 | 4.64±0.92* | 4.08±0.61* |
| *P < 0.05 compared with control group. | |||||
在首次治疗后1个月,2组患者皮损厚度均明显下降,但在第2和3个月时,联合治疗组患者皮损厚度进一步显著降低,而对照组患者厚度降低幅度不明显;3次治疗后,在瘢痕疙瘩的厚度降低方面,联合治疗组明显优于对照组,差异有统计学意义 (P < 0.05)。见表 2。
| (x±s, l/mm) | ||||
| Group | Thickness of keloid | |||
| Before treatment | 1 month | 2 month | 3 month | |
| Control | 4.8±0.9 | 4.2±0.3 | 4.4±0.6 | 4.0±0.5 |
| Combined | 4.7±1.0 | 4.3±0.5 | 3.6±0.9 | 2.5±0.7* |
| *P < 0.05 compared with control group. | ||||
根据自觉症状评价量表,2组患者痛痒症状均于首次治疗后1周左右缓解,皮损开始变软,但每次注射2周后对照组痛痒症状逐渐出现反跳,皮损厚度开始变大。联合治疗组患者痛痒感和皮损厚度无反跳,并在3个月的治疗时间内进一步减轻,在治疗停止后3个月时随诊仅有3例患者瘢痕疙瘩皮损边缘某些区域痛痒症状复发。
2.5 2组患者不良反应发生情况得宝松局部注射的不良反应主要包括毛细血管扩张、色素沉着、色素减退、紫癜及点状坏死等[8],对照组患者发生不良反应8例,不良反应发生率为26.7%;联合治疗组患者发生不良反应7例,不良反应发生率为25.0%,2组患者不良反应观察指标中各项发生率比较差异无统计学意义 (P > 0.05)。见表 3。A型肉毒素局部注射可能出现的不良反应为局部肌肉麻痹引起的功能障碍和注射区皮下瘀血[9],联合治疗组患者联合A型肉毒素局部注射,未发现局部肌肉麻痹引起的功能障碍,但出现1例注射区皮下淤血,后自行消退,不影响治疗。
| [n(η/%)] | |||||||
| Group | n | Angiotelectasis | Hyperpigmentation | Hypopigmentation | Purpura | Dot necrosis | Total |
| Control | 30 | 4 (13.3) | 2 (6.7) | 1 (3.3) | 1 (3.3) | 0 (0.0) | 8 (26.7) |
| Combined | 28 | 3 (10.7) | 2 (7.1) | 0 (0.0) | 1 (3.6) | 1 (3.6) | 7 (25.0) |
| P > 0.05 compared with control group. | |||||||
激素局部皮损内注射可以抑制成纤维细胞增殖,降低其合成胶原与其他细胞外基质成分的能力,减少转化生长因子β1(TGF-β1),并增加胶原酶的生成从而增强胶原的降解,是治疗瘢痕疙瘩的主要疗法之一[10]。瘢痕疙瘩易复发,据本科临床发现:单纯皮损内注射激素后瘢痕疙瘩皮损缓解,但约20 d后,多数患者自觉皮损厚度、痛痒觉又有所增加。蔡景龙[11]建议瘢痕疙瘩应根据皮损具体情况采用手术或激素等局部注射为主的综合治疗方法。
透明质酸是细胞外基质的组成部分,在组织增殖、再生和修复中起重要作用,在胎儿早期无瘢痕愈合中起重要作用。透明质酸有很强的水合能力,可以增加局部皮肤含水量,软化瘢痕,使胶原纤维变细,还能抑制炎性细胞迁移引起的促瘢痕效应,可作为瘢痕的辅助治疗手段[12]。
瘢痕疙瘩的发生机制至今尚不明确,因其好发于张力较大的部位如前胸、肩部和肩胛区等,说明局部张力增加可能是促进瘢痕疙瘩生成的原因之一[13]。研究[14]表明:减少皮肤张力,如减张缝合和皮瓣术可以预防和治疗异常瘢痕。近年来研究[15]发现:减少肌肉张力对恢复瘢痕中成纤维细胞增殖与凋亡的平衡、减少瘢痕产生或复发起到重要作用。A型肉毒素是一种神经毒素,通过抑制神经-肌肉接头的乙酰胆碱释放从而引起局部横纹肌麻痹,减少因肌肉牵拉引起的皮肤张力,因而减少瘢痕张力和张力引起的瘢痕周围炎症[16]。研究[17]发现:A型肉毒素能使大多数瘢痕疙瘩成纤维细胞处于非增殖期 (G0和G1期),并且减少瘢痕疙瘩成纤维细胞中TGF-β1的表达,而TGF-β1被认为是瘢痕疙瘩发病中最主要的调节因子,与瘢痕组织过度沉积和纤维化疾病密切相关[18]。在单纯应用肉毒素治疗病理性瘢痕的临床实验[3, 19]中,部分患者获得了良好的疗效。瘢痕疙瘩伴随的痛痒症状时常给患者带来困扰,因此缓解痛痒症状对患者同样重要。A型肉毒素具有缓解病理性瘢痕痛痒的作用[20],但其具体机制不明。研究[21]表明:瘢痕疙瘩的痛痒症状与P物质的表达密切相关。激素类药物不能抑制感觉神经末梢释放P物质,而A型肉毒素能直接作用于非胆碱能神经元和感觉神经末梢,抑制P物质释放[22-23]。此外,在多个研究中应用肉毒素治疗病理性瘢痕均未发现严重的不良反应,可以作为有效且安全的瘢痕疙瘩防治方法[24]。因此本文作者联合应用A型肉毒素皮损周围注射和得宝松局部注射及外用透明质酸治疗瘢痕疙瘩,并缓解顽固性痛痒。
本研究以瘢痕疙瘩患者为研究对象,分为对照组和联合治疗组,每月进行一次治疗并随访,进行皮损大体观察,对痛痒进行VAS量化评分,对皮损厚度、反跳时间等进行组间比较,较客观地反映了瘢痕疙瘩的疗效。本研究结果显示:2组患者在大体观察、VAS评分、皮损厚度方面较治疗前均有好转,但联合治疗组患者疗效更加明显,痛痒症状得到明显减轻,反跳时间比对照组更长,患者对治疗效果满意,且联合A型肉毒素未增加不良反应发生率。
综上所述,A型肉毒素联合得宝松局部注射及透明质酸外用治疗瘢痕疙瘩疗效明显优于单纯应用得宝松及透明质酸外用,对减轻痛痒症状效果尤为明显,安全性较好,值得临床进一步推广应用。
| [1] | Al-Attar A, Mess S, Thomassen JM, et al. Keloid pathogenesis and treatment[J]. Plast Reconstr Surg, 2006, 117(1): 286–300. DOI:10.1097/01.prs.0000195073.73580.46 |
| [2] | Gassner HG, Brissett AE, Otley CC, et al. Botulinum toxin to improve facial wound healing:a prospective, blinded, placebo-controlled study[J]. Mayo Clin Proc, 2006, 81(8): 1023–1028. DOI:10.4065/81.8.1023 |
| [3] | Xiao Z, Zhang F, Cui Z. Treatment of hypertrophic scars with intralesional botulinum toxin type A injections:a preliminary report[J]. Aesthetic Plast Surg, 2009, 33(3): 409–412. DOI:10.1007/s00266-009-9334-z |
| [4] | Haubner F, Leyh M, Ohmann E, et al. Effects of botulinum toxin A on patient-specific keloid fibroblasts in vitro[J]. Laryngoscope, 2014, 124(6): 1344–1351. DOI:10.1002/lary.v124.6 |
| [5] | Darzi MA, Chowdri NA, Kaul SK, et al. Evaluation of various methods of treating keloids and hypertrophic scars:a 10-year follow-up study[J]. Br J Plast Surg, 1992, 45(5): 374–379. DOI:10.1016/0007-1226(92)90008-L |
| [6] | 孙兵. 视觉模拟评分法 (VAS)[J]. 中华神经外科杂志, 2012, 28(6): 645–645. |
| [7] | 严广斌. 视觉模拟评分法[J]. 中华关节外科杂志:电子版, 2014, 8(2): 34. |
| [8] | 吴晓琰, 范红梅, 陈晓栋, 等. 无针注射器瘢痕疙瘩内注射糖皮质激素的疗效研究[J]. 中华皮肤科杂志, 2015, 48(9): 606–610. |
| [9] | 高琳, 殷荣, 王媛丽, 等. 肉毒毒素和透明质酸联合使用在面部年轻化处理中的应用[J]. 中国美容医学, 2016, 25(4): 94–97. |
| [10] | Insalaco L, Saxon S, Spiegel JH. What is the role of intralesional corticosteroid injections for keloids before considering surgery?[J]. Laryngoscope, 2016, 126(3): 549–550. DOI:10.1002/lary.v126.3 |
| [11] | 蔡景龙. 瘢痕疙瘩的诊疗指南建议[J]. 中国美容医学, 2016, 25(6): 38–40. |
| [12] | 李荟元. 瘢痕的药物治疗进展[J]. 中国临床康复, 2002, 6(8): 1090–1092. |
| [13] | 姜日花, 白爽, 戴跃, 等. 瘢痕疙瘩的生物力学特性[J]. 吉林大学学报:工学版, 2011, 41(6): 675–677. |
| [14] | Ogawa R, Akaishi S, Huang C, et al. Clinical applications of basic research that shows reducing skin tension could prevent and treat abnormal scarring:the importance of fascial and flap surgery for keloid and hypertrophic scar reconstruction[J]. J Nihon Med Sch, 2011, 78(2): 68–76. DOI:10.1272/jnms.78.68 |
| [15] | Lee BJ, Jeong JH, Wang SG, et al. Effect of botulinum toxin type a on a rat surgical wound model[J]. Clin Exp Otorhinolaryngol, 2009, 2(1): 20–27. DOI:10.3342/ceo.2009.2.1.20 |
| [16] | Viera MH, Amini S, Valins W, et al. Innovative therapies in the treatment of keloids and hypertrophic scars[J]. J Clin Aesthet Dermatol, 2010, 3(5): 20–26. |
| [17] | Xiao ZB, Zhang MB. Botulinum toxin type A affects cell cycle distribution of fibroblasts derived from hypertrophic scar[J]. J Plast Reconstr Aesthet Surg, 2008, 61(9): 1128–1129. DOI:10.1016/j.bjps.2008.05.003 |
| [18] | Xiao Z, Zhang F, Lin W, et al. Effect of botulinum toxin type A on transforming growth factor beta1 in fibroblasts derived from hypertrophic scar:a preliminary report[J]. Aesthetic Plast Surg, 2010, 34(4): 424–427. DOI:10.1007/s00266-009-9423-z |
| [19] | Xiao ZB, Zhang MB. Intralesional botulinum toxin type A injection as a new treatment measure for keloids[J]. Plast Reconstr Surg, 2009, 124(5): 275–277. DOI:10.1097/PRS.0b013e3181b98ee7 |
| [20] | Maderal AD, Tang JC, Vivas AC, et al. Hypertrophic scars and keloids, part 2:newer and investigational therapies[J]. Cosmet Dermatol, 2012, 25(8): 373–379. |
| [21] | Hochman B, Nahas FX, Sobral CS, et al. Nerve fibres:a possible role in keloid pathogenesis[J]. Br J Dermatol, 2008, 158(3): 651–652. DOI:10.1111/j.1365-2133.2007.08401.x |
| [22] | Lucioni A, Bales GT, Lotan TL, et al. Botulinum toxin type A inhibits sensory neuropeptide release in rat bladder models of acute injury and chronic inflammation[J]. BJU Int, 2008, 101(3): 366–370. DOI:10.1111/bju.2008.101.issue-3 |
| [23] | Wen WD, Yuan F, Wang JL, et al. Botulinum toxin therapy in the ovalbumin-sensitized rat[J]. Neuroimmunomodulation, 2007, 14(2): 78–83. DOI:10.1159/000107422 |
| [24] | Trisliana PA, Lazzeri D, Su W, et al. Recent developments in the use of intralesional injections keloid treatment[J]. Arch Plast Surg, 2014, 41(6): 620–629. DOI:10.5999/aps.2014.41.6.620 |
 2017, Vol. 43
2017, Vol. 43


