扩展功能
文章信息
- 杜思韵, 盖保东, 屈佳, 杨冬艳
- DU Siyun, GAI Baodong, QU Jia, YANG Dongyan
- 经皮超声引导与开腹术中超声引导植入放射性125I粒子治疗胰腺癌的效果比较
- Comparison of effects of ultrasound-guided implantation of radioative 125I particles in treatment of pancreatic cancer between percutaneous puncture and laparotomy
- 吉林大学学报(医学版), 2017, 43(02): 381-385
- Journal of Jilin University (Medicine Edition), 2017, 43(02): 381-385
- 10.13481/j.1671-587x.20170233
-
文章历史
- 收稿日期: 2016-12-20
2. 吉林大学中日联谊医院胃肠结直肠肛门外科, 吉林 长春 130033
2. Department of Gastrointestinal, Colorectal and Anal Surgery, China-Japan Union Hospital, Jilin University, Changchun 130033, China
胰腺癌系高度恶性消化系肿瘤,5年生存率低于5%[1]。患者确诊时多已达进展期,无法予以根治切除术治疗[2]。Wang等[3]行超声引导下开腹术中植入放射性125I粒子,术中判断胰腺肿物无法根除并行粒子植入姑息治疗。肿瘤内植入放射性粒子作为进展期胰腺癌患者的姑息性治疗方法之一,已取得较满意的临床疗效[4-5]。近年来,对于术前影像诊断为无法手术切除的患者,采用超声引导下经皮穿刺植入粒子治疗得到临床认可[6]。但目前对于经皮与开腹2种方式植入125I粒子治疗进展期胰腺癌的疗效对比尚无研究报道。本文作者对比分析超声引导经皮穿刺植入粒子和开腹术中超声引导植入粒子2种术式的临床疗效,为胰腺癌临床术式选择提供依据。
1 资料与方法 1.1 临床资料收集2011年4月—2016年7月于本院就诊的73例胰腺癌患者的临床资料,包括超声引导下经皮穿刺放射性125I粒子植入术组 (A组)42例和开腹术中超声引导放射性125I粒子植入术组 (B组)31例。术式选择均为医生结合患者自身术前评估情况,告知经皮穿刺与开腹术中植入粒子可能出现的并发症,由患者自愿选择术式而定。A组患者年龄 (63.00±12.95) 岁;胰头癌32例 (钩突部7例),体尾癌10例;肿瘤长径2.3~7.3cm,平均 (4.14±0.98) cm;37例伴疼痛,17例伴梗阻性黄疸;临床分期Ⅱ、Ⅲ和Ⅳ期分别为17、15和10例。B组患者年龄 (62.2±7.5) 岁;胰头癌23例 (钩突部4例),体尾癌8例;肿瘤长径2.0~8.0cm,平均 (4.21±1.27) cm;22例伴疼痛,13例伴梗阻性黄疸;临床分期Ⅱ、Ⅲ和Ⅳ期分别为11、13和7例。2组患者术前一般状况比较差异无统计学意义 (P > 0.05)。
| Item | Group A | Group B | t/χ2 | P |
| Average age (year) | 63.0±12.95 | 62.2±7.50 | -0.336 | 0.738 |
| Tumor stage | 1.374 | 0.503 | ||
| Ⅱ | 17 | 11 | ||
| Ⅲ | 15 | 13 | ||
| Ⅳ | 10 | 7 | ||
| Average length | ||||
| diameter (l/cm) | 4.14±0.98 | 4.21±1.27 | 0.246 | 0.806 |
| Growing zone | 0.038 | 0.845 | ||
| Pancreatic head | 32 | 23 | ||
| Pancreatic body and tail | 10 | 8 | ||
| Abdominal pain | 2.534 | 0.111 | ||
| Yes | 37 | 22 | ||
| No | 6 | 9 | ||
| Jaundice | 0.233 | 0.630 | ||
| Yes | 17 | 13 | ||
| No | 25 | 18 | ||
放射性125I粒子由中国同辐公司生产,长径4.5 mm,外径0.8 mm,释放27.4~35.5 keV能量,半衰期59.6 d。18G粒子植入针及Mick粒子植入枪 (美国库克公司)。iu22彩超仪 (美国飞利浦公司),MyLab90彩超仪 (意大利百胜公司),D-C7彩超仪 (中国迈瑞公司),低频凸阵探头及术中高频线阵探头。
1.3 手术设计①治疗计划制定:将患者薄层CT图像导入放射治疗计划系统 (Treatment Planning System, TPS) 予以三维重建,建立肿瘤立体放射靶区。依照肿瘤体积及粒子活度,由TPS计算术中所需粒子量,描绘粒子空间分布图,使靶区达90%以上等剂量线覆盖,完成粒子植入治疗计划。②穿刺计划制定:超声准确定位肿瘤各边界,规避穿刺路径内的重要组织器官,初步选定穿刺点及进针角度。
1.4 手术方法A组:梗阻性黄疸患者,术前均已操作完成超声引导经皮经肝穿刺胆管内置管引流或胆道内支架。全麻生效后消毒铺巾,选取穿刺点及最佳穿刺路径,探头加压推挤胃肠道,实时调整穿刺针角度,规避血管、胰管及胆道。每一针在安全前提下穿刺至肿瘤最深缘,植入该针道第1枚粒子,间隔约1cm边退针边植入至肿瘤浅缘。使粒子分布尽可能达术前TPS计划标准。粒子植入术后,手术室内观察30min,不定时超声扫查穿刺区域是否有异常积液。见图 1A。
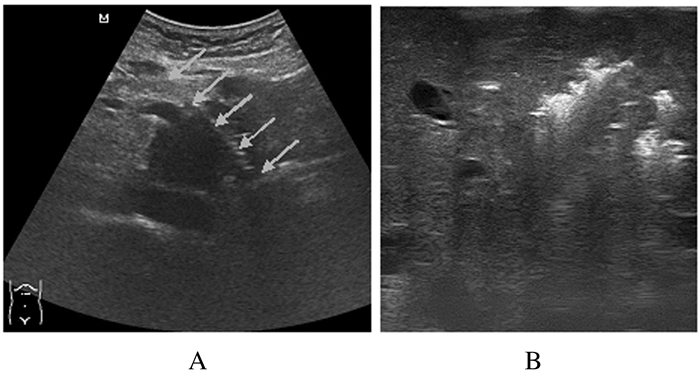
|
| The arrow pointed at pin tract of puncture. 图 1 超声引导经皮穿刺 (A) 和开腹术中 (B) 植入放射性125I粒子图像 Figure 1 Images of 125I seeds implantation by percutaneous puncture (A) and intraoperative way (B) |
|
|
B组:患者全麻后开腹探查,根据临床需求先进行胆肠吻合或胃肠吻合术。尽量充分暴露胰腺肿瘤及周围组织,超声反复扫查肿瘤,明确肿瘤周边尤其是肿瘤前面组织结构,穿刺前确定进针点及路径安全,并准确测量进针深度,穿刺至肿瘤深缘植入第1枚粒子,尽量依从TPS设计方案以1cm间距逐步退针并植入粒子。按需留置引流管。冲洗腹腔,关腹,术毕。见图 1B。
1.5 疗效评估依据WHO标准评价疼痛及缓解程度[7];以术后3个月CT结果评价肿瘤的局部控制状况,采用RECIST (Response Evaluation Criteria in solid Tumors) 标准评价[8]。术后随访3~36个月,截止随访日期为患者死亡日期。随访患者疼痛缓解、肿瘤局部控制、生存时间及并发症发生状况。
1.6 统计学分析采用SPSS21.0统计软件进行统计学分析。2组患者术前肿瘤分期、肿瘤生长部位、有无疼痛或黄疸及术后疼痛缓解、肿瘤局部控制和并发症发生率比较采用χ2检验;2组患者术前平均年龄和肿瘤平均长径以x±s表示,组间比较采用t检验;生存分析采用Kaplan-Meier分析,2组患者生存期比较采用Log-rank检验。以α=0.05为检验水准。
2 结果 2.1 2组患者疼痛缓解情况A组37例术前疼痛患者于术后2~5d疼痛开始缓解,完全缓解、部分缓解和无变化者分别为30、4和3例,有效率91.89%;B组22例术前疼痛患者于术后3~7d疼痛开始缓解,完全缓解、部分缓解和无变化者分别为14、5和3例,有效率86.40%,2组患者疼痛缓解有效率比较差异无统计学意义 (P>0.05)。
2.2 2组患者肿瘤局部控制情况A组患者完全缓解 (CR)13例,部分缓解 (PR)17例 (图 2A),稳定 (SD)8例 (图 2B),进展 (PD)4例,有效率71.05%;B组患者CR 7例,PR17例,SD 5例,PD2例,有效率77.42%,2组患者肿瘤局部控制有效率比较差异无统计学意义 (P>0.05)。

|
| 图 2 胰头癌患者术前 (A) 和术后1个月 (B) CT图像 Figure 2 Images of CT of patients with pancreatic head cancer before (A) and one month after (B) operation |
|
|
术后随访3~36个月,随访截止日期为患者死亡日期。A组患者术后生存期范围为5~31个月,中位生存期达11个月,1年生存率36.9%;B组患者术后生存期范围4~36个月,中位生存期达12个月,1年生存率35.8%。见图 3。应用Log-rank进行生存期对比分析,χ2=0.188,P=0.664,2组患者术后生存期比较差异无统计学意义 (P>0.05)。
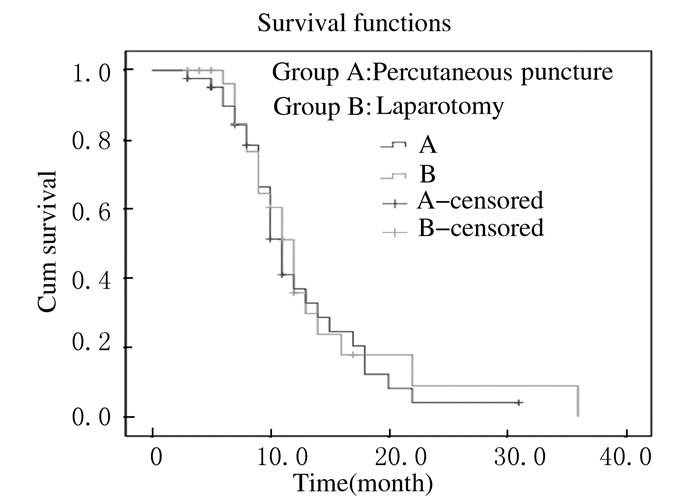
|
| 图 3 2组患者术后生存曲线 Figure 3 Survival curves of patients in two groups after operation |
|
|
A组术后7例 (16.67%) 患者出现发热;B组术后12例 (38.71%) 患者出现并发症,其中6例出现发热,2例出现小腿肌间静脉血栓,1例出现胃潴留,1例出现胆肠吻合口瘘,1例出现腹胀,1例术后早期出现肠梗阻,均经对症治疗后好转;2组患者并发症发生率比较差异有统计学意义 (P < 0.05)。
3 讨论对于已无手术切除机会的进展期胰腺癌,首选治疗方法为放疗及化疗。放疗有2种方式,即体外放疗与体内近距离放疗,放射性125I粒子组织间植入术属于后者。胰腺癌的生物学特性决定其对化疗药物敏感性较低[2],治疗效果不佳,且因化疗的不良反应,患者不易耐受,很难坚持。胰腺位处腹膜后,解剖位置深在,周围结构复杂,而其邻近器官 (胃、十二指肠和大肠等) 不易耐受放射线照射,故体外放疗剂量受到限制[9],且体外放疗为间断性治疗,对胰腺癌杀伤效果不佳。放射性125I粒子肿瘤内植入具有靶区放射强度高、周围组织损伤小和可反复植入等优点,于临床获取极高程度认可;其能有效缓解胰腺癌患者的疼痛,控制肿瘤局部进展,延长生存期,提高患者的生活质量。
3.1 疼痛缓解情况胰腺癌患者多以上腹及腰背部疼痛为主要临床表现。肿物沿神经鞘侵犯腹腔神经丛是临床症状的主因,患者疼痛难忍,饮食及睡眠受影响,生活质量极差[10]。肿瘤内植入放射性125I粒子所释放射线有效覆盖肿瘤区域,最大限度杀伤肿瘤细胞,瘤体变小而减轻对周围神经丛的挤压。近距离放疗可引起肿瘤内部坏死[9],且射线照射损毁腹腔神经丛,从而缓解甚至消除疼痛。王俊杰等[11]以125I粒子组织间植入术治疗22例进展期胰腺癌患者,疼痛缓解有效率93.33%。本研究中2组患者疼痛缓解有效率分别为91.89%和86.40%,2种手术方式均达到相近的疼痛缓解效果。
3.2 肿瘤局部控制和生存时间放射性125I粒子的电离辐射可产生氧自由基,破坏DNA、蛋白质及脂质等重要细胞成分,引起肿瘤细胞凋亡。同时粒子的持续低剂量辐射促使低甲基化发生,抑制细胞增殖。放射性125I粒子通过影响细胞生长机制从而减小肿瘤体积,使局部得到良好控制[12]。本研究中2组患者的肿瘤局部控制有效率分别为71.43%和77.42%,统计学分析显示其临床控制效果一致。经统计进展期胰腺癌患者中位生存期为6~10个月[13],本研究2组患者中位生存期分别为11和12个月,2种术式均可相应延长生存时间,疗效相近。
3.3 并发症发生情况放射性125I粒子最早应用于治疗胰腺癌的方式即开腹术中植入,并发症较多。Peretz等[14]以125I粒子组织间植入术治疗98例胰腺癌患者,19例发生严重并发症,即胰瘘、腹腔脓肿、胃溃疡出血和肠梗阻。随着影像引导技术的发展,并发症较前明显减少[15-17]。本研究中2组患者均由超声引导穿刺植入,监测肿瘤内情况及其与周围组织的关系,避免因误伤胰管、胆管、血管、肠道所致胰瘘、胆瘘、出血和肠穿孔等并发症。超声实时观察肿瘤内粒子分布情况,最大限度依从术前TPS计划,既可有效杀伤肿瘤又可避免因粒子植入不均或植入部位偏差所致的放射性损伤。本研究结果显示:B组患者并发症发生率较高,由于开腹探查会加重手术创伤,使并发症发生概率上升;A组患者采用经皮穿刺植入125I粒子,减少了对机体的损伤刺激,避免开腹所致并发症的发生。
超声引导经皮穿刺组织间植入放射性125I粒子可动态引导穿刺针出入瘤体,遵循穿刺路径,避免误刺而促使并发症发生。开腹方式超声引导影像显示术野小、操作受限,导致部分病例的部分切面不能实时引导。而经体表方式植入粒子影像显示空间及体表操作空间明显增大,穿刺针及探头可随时灵活调整方向及角度。对于局部进展期胰腺癌的治疗,超声引导经体表方式植入放射性125I粒子在多方面可达到与开腹方式植入放射性125I粒子相同的疗效[18-19],且前者更具操作简便、灵活、创伤小、并发症少的优势,有较高临床推广价值。
| [1] | Klein AP. Identifying people at a high risk of developing pancreatic cancer[J]. Nat Rev Cancer, 2013, 13(1): 66–74. |
| [2] | Inal A, Kos FT, Algin E, et al. Gemcitabine alone versus combination of Gemci-tabine and cisplatin for the treatment of patients with locally advanced and/or metastatic pancreatic carcinoma:a retrospective analysis of multicenter study[J]. Neoplasma, 2012, 59(3): 297–301. DOI:10.4149/neo_2012_038 |
| [3] | Wang J, Jiang Y, Li J, et al. Intraoperative ultrasound-guided iodine-125 seed implantation for unresectable pancreatic carcinoma[J]. J Exp Clin Cancer Res, 2009, 28: 88. DOI:10.1186/1756-9966-28-88 |
| [4] | Niu H, Zhang X, Wang B, et al. The clinical utility of image-guided iodine-125 seed in patients with unresectable pancreatic cancer[J]. Tumor Biol, 2016, 37(2): 2219–2223. DOI:10.1007/s13277-015-4045-3 |
| [5] | Liu B, Zhou T, Geng J, et al. Percutaneous computed tomography-guided iodine-125 seeds implantation for unresectable pancreatic cancer[J]. Indian J Cancer, 2015, 52(Suppl 2): e69–e74. |
| [6] | 盖保东, 李清春, 杨冬艳. 超声引导经皮穿刺125I放射性粒子组织间植入治疗胰腺癌安全性分析[J]. 中华内分泌外科杂志, 2016, 10(3): 180–181. |
| [7] | 赵俊, 李树人, 宋文阁, 等. 疼痛诊断与治疗学[M]. 郑州: 河南医科大出版社,1999: 201. |
| [8] | Eisenhauer EA, Therasse P, Bogaerts J, et al. New response evaluation criteria in solid tumors:revised RECIST guideline (version 1.1)[J]. Eur J Cancer, 2009, 45(2): 228–247. DOI:10.1016/j.ejca.2008.10.026 |
| [9] | 王颖, 李亚明. 胰腺癌放射性核素内照射治疗现状及进展[J]. 中国普通外科杂志, 2015, 24(3): 408–412. |
| [10] | Cunningham D, Chau I, Stocken DD, et al. Phase Ⅲ randomized comparison of gemcitabine versus gemcitabine plus capecitabine in patients with advanced pancreatic cancer[J]. Bri J Cancer, 2009, 104(7): 1071–1078. |
| [11] | 王俊杰, 修典荣, 冉维强, 等. 术中超声引导放射性125I粒子组织间植入治疗胰腺癌[J]. 中华放射肿瘤学杂志, 2007, 16(1): 34–37. |
| [12] | Ma JX, Jin ZD, Si PR, et al. Continuous and low-energy 125I seed irradiation changes DNA methyltransferases expression patterns and inhibits pancreatic cancer tumor growth[J]. J Exp Clin Cancer Res, 2011, 30: 35. DOI:10.1186/1756-9966-30-35 |
| [13] | Haller DG. New perspectives in the management of pancreas cancer[J]. Semin Oncol, 2003, 30(4 suppl 11): 3–10. |
| [14] | Peretz T, Nori D, Hilaris B, et al. Treatment of primary unresectable carcinoma of the pancreas with I-125 implantation[J]. Int J Radiat Oncol Biol Phys, 1989, 17(5): 931–935. DOI:10.1016/0360-3016(89)90138-7 |
| [15] | 杨文魁, 陈勇, 王磊, 等. CT引导下125I粒子植入联合GP方案治疗局部进展期胰腺癌[J]. 世界华人消化杂志, 2014, 22(10): 1455–1459. |
| [16] | 李帅, 周志刚, 高剑波, 等. CT引导下组织间植入125I粒子联合替吉奥治疗老年胰腺癌疗效分析[J]. 郑州大学学报:医学版, 2015, 50(2): 270–274. |
| [17] | 张新刚, 张新鹏, 李晓晗, 等. 自身免疫性胰腺炎组织病理学特征分析[J]. 中国实用内科杂志, 2015, 35(12): 1027–1030. |
| [18] | 陶为杰, 石小举, 王广义. 125I放射性粒子植入治疗不可切除胰腺癌的研究进展[J]. 临床肝胆病杂志, 2016, 32(5): 972–976. |
| [19] | 季洪兵, 陈忠华. 盐酸吉西他滨联合立体定向放疗治疗局部晚期胰腺癌的效果评价[J]. 临床肝胆病杂志, 2016, 32(3): 537–540. |
 2017, Vol. 43
2017, Vol. 43


