扩展功能
文章信息
- 潘军强, 张殿新, 孙超峰, 杨进
- PAN Junqiang, ZHANG Dianxin, SUN Chaofeng, YANG Jin
- 微纤维蛋白1在瓣膜性心房颤动患者心房组织中的表达及其与心房纤维化的关系
- Expression of fibrillin-1 in atrium tissue and analysis on its relationship with atrial fibrosis in patients with valvular atrial fibrillation
- 吉林大学学报(医学版), 2017, 43(02): 339-343
- Journal of Jilin University (Medicine Edition), 2017, 43(02): 339-343
- 10.13481/j.1671-587x.20170224
-
文章历史
- 收稿日期: 2016-07-26
2. 第四军医大学附属西京 医院心血管内科, 陕西 西安 710032;
3. 西安交通大学医学部第一附属医院心血管内科, 陕西 西安 710061
2. Department of Cardiovascular Diseases, Xijing Hospital, Fourth Military Medical University, Xi'an 710032, China;
3. Department of Cardiovascular Diseases, First Affiliated Hospital, School of Medical Sciences, Xi'an Jiaotong University, Xi'an 710061, China
心房颤动 (atrial fibrillation, AF) 是临床上最为常见和复杂的心律失常之一,同时也是栓塞和中风最为普遍的危险因素。随着老龄化社会的发展,AF的发病率逐渐增高,有当代心脏病的“流行病”之称[1]。AF大多继发于器质性心脏病患者或存在AF相关危险因素,如心脏瓣膜病、先天性心脏病、原发性高血压和冠心病等患者,在我国AF最常见继发于风湿性心脏瓣膜病[2]。以往多中心研究[3]显示:继发于风湿性心脏瓣膜病的AF患者存在明显的心房结构重塑,而心房纤维化是AF患者心房结构重塑最典型的特点。微纤维蛋白1(fibrillin-1, FBN-1) 是广泛存在于细胞外基质中的一种糖蛋白,其以前微纤维蛋白的形式分布于心脏瓣膜、血管、皮肤结缔组织和肺等人体众多组织和器官中。细胞外基质中FBN-1与弹性蛋白一起参与弹性纤维的构成,弹性纤维与胶原纤维共同作用可明显增强其所在组织的弹性[4]。此外富含FBN-1的微原纤维还具有在弹性组织中与弹性纤维一起导致弹性蛋白沉积、在非弹性组织维持结构支架支持细胞黏附等作用[5]。已有研究[6]发现:异常纤维蛋白和其他基质蛋白在风湿性二尖瓣病变黏液样变性发生发展中起主要作用,但其与风湿性心脏瓣膜病心房纤维化关系的相关研究少有报道。本研究选择因风湿性心脏瓣膜病住院进行心脏瓣膜置换手术的患者84例,探讨FBN-1在风湿性心脏瓣膜病并发AF患者心房组织中的表达及其与心房纤维化的关系。
1 资料与方法 1.1 研究对象的选择选择西京医院、西安交通大学第一附属医院、陕西省人民医院心脏外科因心脏瓣膜病住院并行心脏瓣膜置换术的患者84例,依据病史及心电图、24小时动态心电图结果分为AF组39例和窦性心律 (sinus rhythm, SR) 组45例。入选标准:风湿性心脏瓣膜病且行心脏瓣膜置换术伴或不伴AF者。排除由于严重心、肝、肾功能衰竭,自身免疫病,左心室射血分数小于40%风湿热急性活动期,急性感染者和肿瘤等疾病不能耐受或不愿意接受手术治疗者。入选患者均签定知情同意书,同时经西北大学伦理委员会审核通过。
1.2 临床资料和标本采集收集整理患者的临床基线资料,包括年龄、性别、血压、现病史、既往史、生化检查、心电图及心脏彩超等。入选患者均于晨起空腹采集肘静脉血5mL,于4℃冰箱静置3h,离心机分离血清 (室温,1000r·min-1,20 min),于-80℃低温保存。入选患者在心脏外科术中取右心房组织 (0.3~0.5cm3),除去血液、脂肪组织及其他杂质后每块心房组织切成3块:第1块放入液氮瓶中送-80℃保存用于蛋白提取、Western blotting法等检测;第2块放入EP管用于胶原含量检测和mRNA分离;第3块于4%甲醛溶液固定,用于石蜡包埋切片和免疫组织化学染色。
1.3 Masson染色观察心房组织纤维化程度及胶原含量的测定Masson染色后光镜下观察心房组织切片。经染色处理后,胶原纤维为蓝色,肌肉组织为红色。显微镜下在每张切片中随机选取6个高倍视野,采用多功能显微镜及自动图像处理分析系统 (德国Leica公司) 拍照,测定胶原容积分数 (collage volume fraction, CVF;CVF=胶原面积/所测视野面积×100%),取平均值。胶原纤维中主要成分为原蛋白,胶原蛋白中羟脯氨酸所占比例为13.4%。先测定心房组织中羟脯氨酸含量 (按羟脯氨酸测定试盒操作说明书进行),心房组织中胶原蛋白含量的测定按如下公式计算:心房组织中胶原含量 (mg·L-1)=7.46×心房组织中羟脯氨酸的含量。
1.4 Western blotting法测定心房组织中FBN-1蛋白表达水平常规提取心房组织总蛋白,BCA试剂盒测蛋白总浓度,绘制标准曲线,计算出样品实际浓度 (g·L-1)。80mV电压下在100 g·L-1 SDS-PAGE凝胶电泳2h。PVDF膜在250mA下转膜70 min。50 g·L-1脱脂奶粉封闭液中室温下封闭2 h,TBST洗膜3次。加入FBN-1(1:500比例稀释)、β-actin (1:5000比例稀释) 一抗,4℃孵育过夜;洗膜3次后加入二抗 (1:5000比例稀释),室温下孵育2h,TBST洗膜10 min3次,置强化学发光试剂ECL底物中化学反应5 min,暗室曝光显示特异的蛋白信号。用Gel Doc100成像系统进行图像处理,并记录结果。用目的条带与内参 (β-actin) 条带吸光面积积分的比值表示目的蛋白表达水平。
1.5 统计学分析采用SPSS18.0统计软件对数据进行统计学分析。2组患者年龄、血压、血红蛋白、射血分数、左右心房直径、胶原容积分数、胶原含量、FBN-1蛋白及mRNA表达水平等均以x±s表示,并经正态性检验均符合正态生分布布,2组间均数比较采用t检验;性别构成比组间比较采用χ2检验;采用Person相关分析右心房组织中FBN-1蛋白表达水平与胶原含量的相关性。以P < 0.05为差异有统计学意义。
2 结果 2.1 2组患者的临床资料AF组患者左和右心房直径明显大于SR组,2组比较差异有统计学意义 (P < 0.05);2组患者性别构成比、年龄、血压、血常规和生化指标等比较差异无统计学意义 (P>0.05),具有可比性。见表 1。
| Group | n | Age (year) | Gender (Male/Female) | SBP (P/mmHg) | DBP (P/mmHg) | WBC (×109 L-1) | RBC (×1012 L-1) | Hb[ρB/(g·L-1)] | CR[cB/(μmol·L-1)] | LVEF (η/%) | LAD (l/mm) | RAD (l/mm) |
| AF | 39 | 51.1±9.0 | 24/15 | 112.4±10.4 | 71.7±7.34 | 6.29±1.55 | 4.55±0.67 | 137.1±16.6 | 92.5±12.5 | 53.1±5.9 | 66.2±13.6 | 40.5±6.8 |
| SR | 45 | 48.1±10.9 | 19/26 | 115.8±14.3 | 70.5±11.5 | 6.00±1.91 | 4.44±0.51 | 135.3±16.8 | 91.6±12.4 | 54.5±5.9 | 54.6±14.6 | 36.1±7.0 |
| t/χ2 | -1.045 | 3.083 | 1.242 | -0.567 | -0.763 | -0.811 | -0.482 | -0.225 | 1.041 | 2.739 | 2.118 | |
| P | 0.164 | 0.086 | 0.218 | 0.572 | 0.448 | 0.420 | 0.631 | 0.823 | 0.301 | 0.009 | 0.040 | |
| SBP: Systolic blood pressure; DBP: Diastolic blood pressure; WBC: White blood cells; RBC: Red blood cells; Hb: Hemoglobin; CR: Serum creatinine; LVEF: Left ventricular ejection fraction; LAD: Left atrium diameter; RAD: Right atrium diameter. | ||||||||||||
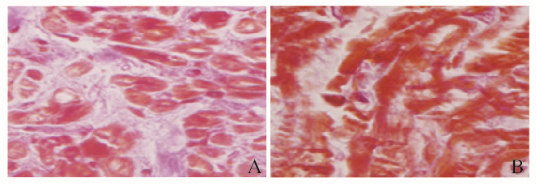
Masson染色显示:心肌细胞染成棕红色,胶原纤维染成蓝色。AF组患者心房组织中可见大量蓝色胶原纤维呈条索状组织分割包绕棕红色的心肌细胞,间质中胶原纤维沉积、表达明显增多;SR组患者心房组织以大量红色心肌细胞为主,其间可见少量蓝色的胶原纤维。见图 1(插页四)。心房组织Masson染色结果经图像分析的半定量结果显示:AF组CVF明显高于SR组 (45.4±2.3vs 12.9±1.0),组间比较差异有统计学意义 (P < 0.002)。采用羟脯氨酸检测试剂盒检测2组患者心房组织中羟脯氨酸水平,计算出每组患者心房组织胶原水平,AF组和SR组患者心房组织中胶原水平分别为 (234.0±4.5) 和 (166.0±7.4) mg·L-1,AF组患者心房组织中胶原水平明显高于SR组 (P < 0.05)。
|
| A: AF group B: SR group 图 1 2组患者心房组织Masson染色结果 (×400) Figure 1 Results of Masson staining of atrium tissue of patients in two groups (×400) |
|
|
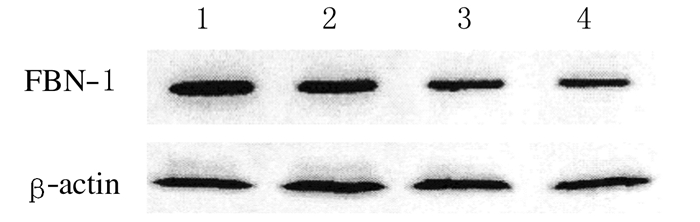
Western blotting法检测结果显示:AF组和SR组患者心房组织中FBN-1蛋白表达水平分别为1.432±0.153和0.621±0.093,AF组患者心房组织中FBN-1蛋白表达水平明显高于SR组 (P < 0.05)。见图 2。
|
| Lane 1, 2:AF group; Lane 3, 4:SR group. 图 2 2组患者心房组织中FBN-1蛋白表达电泳图 Figure 2 Electrophoregram of expressions of FBN-1 protein in atrium tissue of patients in two groups |
|
|
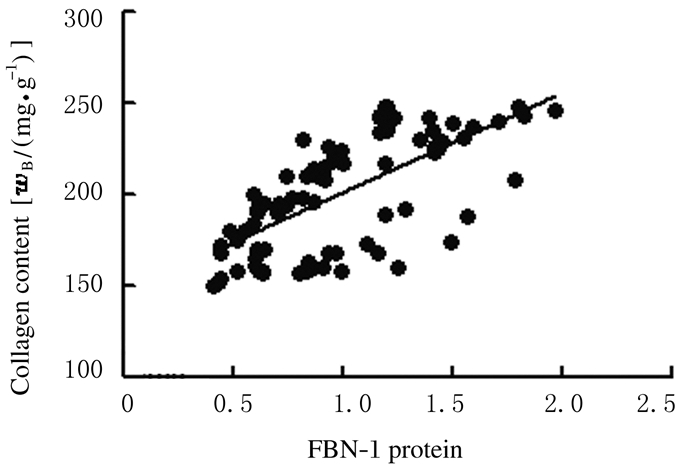
84例患者右心房组织中FBN-1蛋白表达水平与胶原水平呈正相关关系 (r=0.544,P=0.021)。见图 3。
|
| 图 3 风湿性心脏瓣膜病患者心房组织中FBN-1蛋白表达水平与胶原水平相关性 Figure 3 Relationship between expressions of FBN-1 protein and collagen contents in atrium tissuein patients with rheumatic heart value disease |
|
|
风湿性心脏瓣膜病是AF独立的危险因素,AF时心房典型的病理变化为心房重塑,后者是AF发生和维持的关键。心房重塑包括结构重塑和电重塑,其中结构重塑包括心房腔直径扩大、心房肌间质改变和心房肌细胞超微结构改变3个方面[2-3]。心房腔扩大与AF发生与维持密切关联,左心房直径每增加5mm,心房颤动的发生风险增加1.4倍[7]。本研究结果显示:风湿性心脏瓣膜病AF组患者左和右心房直径均明显大于SR组,这与相关报道[3]一致。其原因为:在风湿性心脏瓣膜病变时,血流动力学发生异常改变及心房收缩功能障碍,最终导致心房腔直径明显增大。AF时心房结构重塑最突出的特点是心房间质纤维化,这也是AF发生和维持的结构基础。心房间质纤维化的主要病理学特点是胶原代谢异常所致心肌间质中各型胶原蛋白比例失调、沉积增多、胶原纤维排列紊乱[8-9]。本研究通过形态学、半定量及定量方法检测胶原水平结果的一致性表明:心房纤维化在AF组较SR组明显加重,验证了心房纤维化与风湿性心脏瓣膜病患者AF发生和维持的密切关系[10]。
FBN-1是以前微纤维蛋白形式存在于细胞外基质中的一种糖蛋白,广泛分布于皮肤结缔组织及肺、血管和心脏瓣膜等组织中。FBN-1结构完整和功能稳定依赖3个富含半胱氨酸功能区:类表皮生长因子结构区、潜在的转化生长因子1结合蛋白结构区、Fib结构区 (FBN-1所特有)[11]。FBN-1与弹性蛋白共同组成弹性纤维,后者与胶原纤维交织使其所分布的组织弹性明显增强。此外富含FBN-1的微原纤维还具有在弹性组织中与弹性纤维一起导致弹性蛋白沉积、在非弹性组织维持结构支架支持细胞黏附等作用。FBN-1基因突变可严重影响微原纤维的结构与功能,导致机体结缔组织病变,如Marfan综合征、单纯晶状体异位和Weill-Marchesani综合征等[12-13]。研究[14]表明:FBN-1连接平滑肌细胞与邻近的弹性纤维在胚胎发育过程中调节组织发育、维持组织弹性方面亦发挥重要作用。在胚胎期瓣膜形成过程中,FBN-1降解过多或产生不足可影响瓣叶的形成,导致瓣膜畸形、缺失及增厚和挛缩。已有研究[15]显示:异常纤维蛋白和其他基质蛋白在风湿性二尖瓣黏液样变性发生发展中起主要作用。
本研究以风湿性心脏瓣膜病患者为研究对象,应用Western blotting法测定患者心房组织中FBN-1蛋白表达水平结果显示:AF组患者心房组织中FBN-1蛋白表达水平显著高于SR组,且心房组织中FBN-1蛋白表达水平与胶原含量呈正相关关系。风湿性心脏病变是由A组乙型溶血性链球菌的抗原刺激机体产生的相应抗体,进而引起免疫复合物在心脏中沉积所致的变态反应性疾病。A组乙型溶血性链球菌的抗原与心脏中的糖蛋白 (FBN-1为其中之一) 有共同抗原,因此链球菌感染后刺激机体抗体可与人体心脏组织产生交叉免疫反应形成循环免疫复合物,激活补体成分产生炎性病变。
综上所述,AF患者心房组织中FBN-1的高表达具有明显的促纤维化作用,这为进一步探讨AF患者心房纤维化的发生和维持提供了理论基础,但在风湿性心脏瓣膜病AF患者心房组织中FBN-1表达上调的具体机制仍需进一步深入研究。
| [1] | Guo Y, Tian Y, Wang H, et al. Prevalence, incidence, and lifetime risk of atrial fibrillation in China:new insights into the global burden of atrial fibrillation[J]. Chest, 2015, 147(1): 109–119. DOI:10.1378/chest.14-0321 |
| [2] | Yang P, Lee S, Park J, et al. Early left atrial tissue features in patients with chronic mitral regurgitation and sinus rhythm:Alterations of not remodeled left atria[J]. Int J Cardiol, 2016, 6(25): 1–6. |
| [3] | 潘军强, 张殿新, 寿锡凌, 等. 瓣膜性心房颤动患者心房结构重塑特征分析的多中心研究[J]. 西安交通大学学报:医学版, 2016, 37(1): 74–77. |
| [4] | Jensen SA, Handford PA. New insights into the structure, assembly and biological roles of 10-12 nm connective tissue microfibrils from fibrillin-1 studies[J]. Biochem J, 2016, 473(7): 827–838. DOI:10.1042/BJ20151108 |
| [5] | Khan AO, Bolz HJ, Bergmann C. Results of fibrillin-1 gene analysis in children from inbred families with lens subluxation[J]. J AAPOS, 2014, 18(2): 134–139. DOI:10.1016/j.jaapos.2013.11.012 |
| [6] | Marshall LM, Carlson EJ, O'Malley J, et al. Thoracic aortic aneurysm frequency and dissection are associated with fibrillin-1 fragment concentrations in circulation[J]. Circ Res, 2013, 113(10): 1159–1168. DOI:10.1161/CIRCRESAHA.113.301498 |
| [7] | Zaman JA, Harling L, Ashrafian H, et al. Post-operative atrial fibrillation is associated with a pre-existing structural and electrical substrate in human right atrial myocardium[J]. Int J Cardiol, 2016, 220: 580–588. DOI:10.1016/j.ijcard.2016.06.249 |
| [8] | Gillinov AM, Bagiella E, Moskowitz AJ, et al. Rate control versus rhythm control for atrial fibrillation after cardiac surgery[J]. N Engl J Med, 2016, 74(20): 1911–1921. |
| [9] | Verheule S, Tuyls E, Gharaviri A, et al. Loss of continuity in the thin epicardial layer because of endomysial fibrosis increases the complexity of atrial fibrillatory conduction[J]. Circ Arrhythm Electrophysiol, 2013, 6(12): 202–211. |
| [10] | Kallergis EM, Goudis CA, Kanoupakis EM, et al. Sinus rhythm restoration affects collagen turnover in patients with persistent atrial fibrillation[J]. Europace, 2014, 16(12): 1726–1730. DOI:10.1093/europace/eut401 |
| [11] | Katzke S, Booms P, Tiecke F, et al. TGGE screening of the entire coding sequence in 126 individuals with marfan syndrome and related fibrillinopathies[J]. Hum Mutat, 2002, 20(3): 153–161. DOI:10.1002/humu.v20:3 |
| [12] | Elshershari H, Harris C. Paternal fibrillin-1 mutation transmitted to an affected son with neonatal marfan syndrome:the importance of early recognition[J]. Cardiol Young, 2014, 24(4): 735–738. DOI:10.1017/S1047951113001029 |
| [13] | Guo G, Rödelsperger C, Digweed M, et al. Regulation of fibrillin-1 gene expression by Sp1[J]. Gene, 2013, 527(2): 448–455. DOI:10.1016/j.gene.2013.07.006 |
| [14] | Chou HT, Shi YR, Hsu Y, et al. Association between fibrillin-1 gene exon 15 and 27 polymorphisms and risk of mitral valve prolapse[J]. J Heart Valve Dis, 2003, 12(4): 475–481. |
| [15] | Ozdemir O, Olgunturk R, Karaer K, et al. Fibrillin-1 gene intron 56 polymorphism in Turkish children with mitral valve prolapse[J]. Cardiol Young, 2010, 20(2): 173–177. DOI:10.1017/S1047951109991284 |
 2017, Vol. 43
2017, Vol. 43


