扩展功能
文章信息
- 霍燕伟, 谢冰, 姜磊, 张睿, 宋美, 王岚, 王学义, 许顺江
- HUO Yanwei, XIE Bing, JIANG Lei, ZHANG Rui, SONG Mei, WANG Lan, WANG Xueyi, XU Shunjiang
- 快速老化相关miRNAs在遗忘型轻度认知功能障碍患者血清中的表达及其生物信息学分析
- Expressions of miRNAs related to accelerating senescence in serum of patients with amnestic mild cognitive impairment and analysison their biological information
- 吉林大学学报(医学版), 2017, 43(02): 322-327
- Journal of Jilin University (Medicine Edition), 2017, 43(02): 322-327
- 10.13481/j.1671-587x.20170221
-
文章历史
- 收稿日期: 2016-07-29
2. 河北医科大学中西医结合学院, 河北 石家庄 050031;
3. 河北医科大学第一医院精神卫生科, 河北 石家庄 050031
2. School of Chinese Integrative Medicine, Hebei Medical University, Shijiazhuang 050031, China;
3. Department of Mental Health, First Hospital, Hebei Medical University, Shijiazhuang 050031, China
轻度认知功能障碍 (mild cognitive impairment, MCI) 是介于正常衰老和痴呆之间的一种以认知功能损害为主要特征的中间状态,临床主要表现为患者的认知和学习记忆能力有所下降,但未发展到痴呆。其中遗忘型轻度认知功能障碍 (amnestic mild cognitive impairment,aMCI) 是MCI最常见亚型,以单纯记忆障碍为主,其他认知领域保持相对完整,主要发展方向为阿尔茨海默病 (Alzheimer’s disease, AD) [1]。约50%的aMCI患者4年内可进展为AD。随着全球人口老龄化的加速,AD的患病率也逐年升高。目前对于中重度AD的治疗效果不佳。因此,对aMCI的研究和干预就显得尤为重要。microRNAs (miRNAs) 为非编码小RNA,长度为19~24bp。miRNAs可调控细胞的生长、发育、分化及凋亡的各个环节[2],并参与生理状态的改变及疾病的发生发展。近年来研究[3]表明:miRNAs可调节大脑神经元的发育、分化与凋亡,与AD等神经退行性疾病的发病过程及病理改变密切相关。本课题组前期的研究[4]采用基因芯片技术在快速老化小鼠 (SAMP8) 海马组织中筛选出一组差异性表达的miRNAs,发现miR-132、miR-193b、miR-130b、miR-20a、miR-296、miR-329和miR-206等表达失衡,提示上述miRNAs可能参与AD的发病过程。但这些与快速老化相关的miRNAs在aMCI患者血清中的表达是否也存在改变尚不清楚。本研究利用实时定量PCR (qRT-PCR) 技术检测上述快速老化相关miRNAs在aMCI患者和认知功能正常者血清中的表达情况,并对这些差异性表达的miRNAs进行靶基因预测及生物信息学分析,以探讨快速老化相关miRNAs在aMCI患者血清中的表达及其意义。
1 资料与方法 1.1 研究对象选取2010年12月—2012年12月河北省老年期痴呆发病相关危险因素调查人群为研究对象。根据认知功能的评估结果,将研究对象分为aMCI组和正常对照组。本研究中aMCI组共66例,其中男性24例,女性42例,平均年龄 (72.89±7.59) 岁。纳入标准:①年龄>60岁;②调查既往病史,3个月内未采取临床治疗措施;③符合aMCI国际诊断标准[5]。a.患者或知情者主诉认知功能减退且超过3个月,但未达到痴呆的诊断标准;b.有认知减退的客观证据,表现为相应神经心理检查有与年龄和文化程度不相符的损害;c.基本生活能力保持正常,但复杂的工具性生活能力可有轻微损伤;d.排除特殊原因引起的认知功能减退;e.临床痴呆评定量表评分为0.50分。排除标准:①排除糖尿病 (空腹血糖≥7 mol·L-1)、高血压 (收缩压≥140 mmHg,舒张压≥90 mmHg)、根据病史排除风湿免疫性疾病、肿瘤及血液系统疾病;②排除脑器质性疾病和脑外伤;③排除帕金森等其他神经系统及精神疾病。对照组共76例,其中男性33例,女性43例,平均年龄 (73.17±6.16) 岁。入组标准:①年龄>60岁;②调查既往病史,3个月内未采取临床措施;③有正常的日常生活能力;④听力和视觉功能基本正常,能够顺利完成问卷调查;⑤认知功能正常,通过量表初筛和临床评估不符合aMCI诊断标准。排除标准同aMCI组。
以上2组研究对象年龄 (P=0.811) 及性别 (P=0.392) 比较差异无统计学意义。所有研究对象均由神经科医生进行临床诊断及评估。本研究通过河北医科大学第一医院伦理委员会批准,并与所有参与者签署了知情同意书。
1.2 标本采集所有受试者于清晨采取空腹外周静脉血5 mL,置于真空管中,室温 (15℃~25℃) 静置30 min,于3000 r·min-1离心10 min,再于4℃、16000 r·min-1离心10 min,分离出上层血清于-80℃保存备用。
1.3 miRNAs检测使用miRNeasy血清/血浆试剂盒 (德国Qiagen公司) 提取血清样本中的总RNA,操作过程严格按照说明书要求进行。利用NanoDrop Lite分光光度仪 (德国Thermo公司) 检测RNA的浓度和纯度。使用miScript Ⅱ RT试剂盒 (德国Qiagen公司) 进行逆转录。反应体系为20 μL,包含4 μL 5 × miScriptHiSpec溶液,2 μL 10 × miScriptNucleics混合液,2 μL miScript反转录混合液,2 μL无RNA酶水和10 μL模板RNA。使用Bio-RAD T100热循环系统在37℃、60 min和95 ℃、5 min条件下进行逆转录反应。使用miScript SYBR Green PCR试剂盒 (德国Qiagen公司) 对目标miRNA进行检测。以cel-miR-39为内参,利用ABI 7500 PCR仪 (美国ABI公司) 进行qRT-PCR反应。反应条件:95℃变性15 min,94℃变性15 s,55℃退火30 s,70℃延伸30 s,重复40次循环。反应产物经溶解曲线检测特异性。
1.4 miRNAs的生物信息学分析使用TargetScan 6.0 (http://www.targetscan.org) 软件对血清中差异性表达的miRNA进行靶基因预测。使用注释、可视化和整合发现的数据库 (Database for Annotation, Visualization and Interrogated Discovery,DAVID) 在线分析工具 (http://david.abcc.ncifcrf.gov/) 对预测的靶基因进行生物学功能分析。
1.5 血清中脑源性神经营养因子 (brain derived neurotrophic factor,BDNF) 和沉默信息调节因子1(silent information regulator 1,SIRT1) 表达水平测定利用酶联免疫吸附实验 (ELISA) 检测血清中BDNF和SIRT1的表达水平。血清BDNF的检测采用Human BDNF Quantikine Kit试剂盒 (美国R & D公司),检测灵敏度20 ng·L-1,板内变异系数为5.00%,板间变异系数为11.30%。血清SIRT1的检测采用Human SIRT1 ELISA Kit (武汉优尔生科技股份有限公司) 试剂盒,检测灵敏度0.25 μg·L-1,板内变异系数为10.00%;板间变异系数为12.00%。实验步骤严格按照试剂盒说明进行。
1.6 统计学分析采用lg2-ΔCt法计算miRNA在血清中的表达水平。使用IBM SPSS 22.0统计软件进行统计学分析。通过IBM SPSS 22.0中Bootstrap分析模块进行靴值分析,检验由样本得到的统计量的可信程度。2组受试者年龄和miRNAs、BDNF、SIRT1表达水平比较采用独立样本t检验;性别比例比较采用χ2检验。2组受试者血清miRNAs表达水平中位数的比较采用非参数检验 (Mann-Whitney U检验)。采用GraphPad Prism version 5.0进行作图。以α=0.05为检验水准,双侧检验。
2 结果 2.1 2组受试者血清中快速老化相关miRNAs表达水平本研究检测了与快速老化相关的miRNAs (miR-132、miR-193b、miR-130b、miR-20a、miR-296、miR-329和miR-206) 在aMCI患者和认知功能正常者血清中的表达水平。结果显示:与对照组比较,aMCI组患者血清中miR-206和miR-132的表达水平均升高,差异均有统计学意义 (P < 0.05)。而血清miR-193b、miR-130b、miR-20a、miR-296和miR-329表达水平2组比较差异无统计学意义 (P> 0.05)。为避免设计效应与样本量对本实验结果的影响,本研究采用靴值分析检验aMCI组和对照组统计量的可信程度。结果显示:血清中7种快速老化相关miRNAs的表达水平在各组观察样本中和Bootstrap随机重新取样中的差异很小 (Bias < 0.05),说明本研究样本具有代表性,适用于进一步分析。见表 1和2。
| Group | n | Age (year) | Gender (Male/Female) | miR-206 | miR-132 | miR-193b | miR-130b | miR-20a | miR-296 | miR-329 |
| Control | 76 | 73.17±6.16 | 33/43 | -0.36 | -1.30 | -0.81 | -1.23 | -1.26 | -0.70 | -1.50 |
| MCI | 66 | 72.89±7.59 | 24/42 | -1.99 | -2.57 | -0.88 | -1.31 | -1.56 | -0.67 | -1.30 |
| P | 0.811 | 0.392 | < 0.001 | < 0.001 | 0.051 | 0.161 | 0.064 | 0.616 | 0.631 |
| miRNA | aMCI (n=66) | Control (n=76) | |||||||||
| Observed sample (mean) | Bootstrap sample (mean) | Bias | SE | BCa percentile | Observed sample (mean) | Bootstrap sample (mean) | Bias | SE | BCa percentiles | ||
| miR-206 | -1.94 | -1.94 | 0.01 | 0.12 | -2.16--1.71 | -0.42 | -0.42 | -0.01 | 0.10 | -0.61--0.22 | |
| miR-132 | -2.51 | -2.51 | 0.01 | 0.09 | -2.71--2.36 | -1.15 | -1.15 | 0.01 | 0.07 | -1.29--0.99 | |
| miR-193b | -0.96 | -0.96 | -0.01 | 0.08 | -1.12--0.81 | -0.73 | -0.73 | -0.01 | 0.07 | -0.86--0.58 | |
| miR-130b | -1.25 | -1.24 | < 0.01 | 0.11 | -1.45--1.03 | -1.01 | -1.01 | < 0.01 | 0.09 | -1.20--0.85 | |
| miR-20a | -1.54 | -1.54 | -0.01 | 0.12 | -1.77--1.23 | -1.25 | -1.25 | -0.01 | 0.11 | -1.45--1.01 | |
| miR-296 | -0.80 | -0.81 | -0.01 | 0.10 | -1.01--0.62 | -0.87 | -0.87 | -0.01 | 0.08 | -1.04--0.71 | |
| miR-329 | -1.47 | -1.47 | -0.01 | 0.01 | -1.66--1.28 | -1.50 | -1.50 | -0.01 | 0.07 | -1.64--1.36 | |
| SE: Standard error; BCa: Bias-corrected and accelerated; Observed sample could be taken as test set; Bootstrap sample could be taken as training set. | |||||||||||
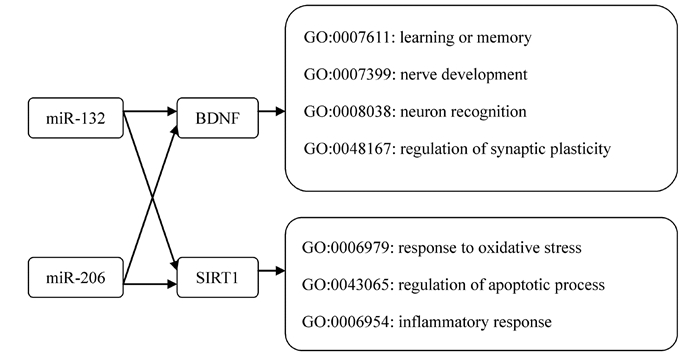
采用TargetScan 6.0软件对miR-206和miR-132的靶基因进行预测,结果显示BDNF和SIRT1共为miR-206和miR-132的靶基因。采用DAVID在线分析工具对BDNF和SIRT1进行生物学功能分析,结果显示:BDNF的生物学功能主要集中在神经系统发育、神经干细胞分化、突触联系、树突棘形成和神经细胞的保护等方面;SIRT1的生物学功能主要集中在氧化应激、神经细胞凋亡、炎症反应和神经可塑性等方面。见图 1。
|
| 图 1 miR-206和miR-132的靶基因预测及其生物学功能分析 Figure 1 Target gene prediction and biological function analysis of miR-206 and miR-132 |
|
|
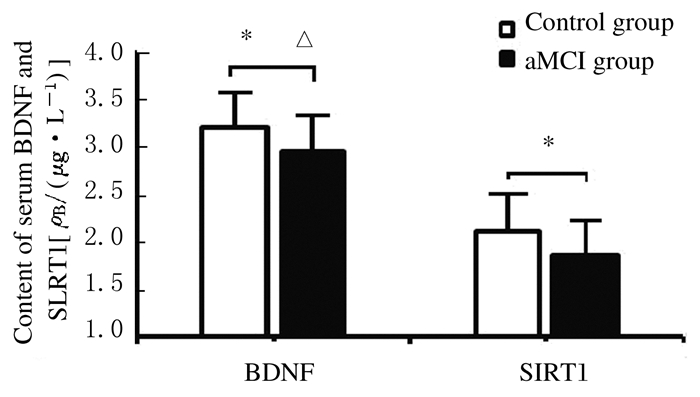
利用ELISA方法分别检测aMCI组与对照组受试者血清中BDNF和SIRT1表达水平,结果发现:与对照组比较,aMCI组患者血清BDNF表达水平 (29.50 μg·L-1±3.13 μg·L-1) 明显低于对照组 (32.29 μg·L-1±3.66 μg·L-1),2组比较差异具有统计学意义 (P < 0.05)。同时,aMCI组患者血清SIRT1表达水平 (1.86 μg·L-1±0.25 μg·L-1) 亦明显低于对照组 (2.10 μg·L-1±0.29 μg·L-1),2组比较差异有统计学意义 (P < 0.05)。见图 2。
|
| *P < 0.01 vs control group. △The value of serum BDNF level was displayed in 10-1 scale at Y-axis. 图 2 2组受试者血清BDNF和SIRT1表达水平 Figure 2 Expression levels of serum BDNF and SIRT1 of subjects in two groups |
|
|
miRNAs是机体内一类高度保守的内源性小分子非编码单链RNAs,主要在转录后水平调控其靶基因的表达[6],参与细胞的增殖、分化和凋亡等一系列生命活动。目前,研究[7]表明:miRNAs在认知障碍与AD等神经退行性病变中起着重要作用。Wang等[8]发现:miR-107在aMCI及AD等患者大脑皮质内表达水平明显下调。本课题组前期采用基因芯片技术在快速老化小鼠SAMP8海马组织中筛选出一组差异性表达的miRNAs,发现miR-132、miR-193b、miR-130b、miR-20a、miR-296、miR-329和miR-206表达失衡,提示以上miRNAs可能参与AD的发病过程[4]。本研究观察上述快速老化相关miRNAs在aMCI患者血清中的表达,并探讨其可能发挥的生物学功能。
本研究采用qRT-PCR方法检测上述快速老化相关miRNAs在aMCI患者血清中表达水平,结果显示:miR-206和miR-132在aMCI患者血清中表达水平明显升高。Lee等[9]通过向Tg2576转基因AD小鼠脑室中注射AM-206(miR-206的抑制剂),发现miR-206的低表达可以改善Tg2576转基因AD小鼠的认知功能,证实了miR-206的表达与AD的发生存在相关性。另有研究[10]显示:miR-132能直接影响Nurr1(也称为核受体亚家族4组的成员2,NR4A2) 基因的表达,而该基因能直接调控胚胎干细胞分化成多巴胺神经元。且中脑多巴胺能神经元的退行性死亡是神经退行性疾病的最显著特征。这些研究提示miR-206和miR-132可能与aMCI的发生存在一定的相关性。
为了进一步探讨miR-206和miR-132的生物学功能,本文作者通过TargetScan6.0软件对miR-206和miR-132的靶基因进行了预测,结果显示BDNF和SIRT1共为miR-206和miR-132的靶基因。本文作者采用ELISA法检测了2组受试者血清中靶基因的水平,发现aMCI组患者血清BDNF和SIRT1表达水平均明显低于对照组。Lee等[9]通过向AD模型鼠侧脑注室射AM-206 (miR-206的中和抑制剂),发现miR-206可以调节AD模型鼠脑组织中BDNF水平和改善记忆功能,增加海马中突触的形成及神经元的发育。Moon等[11]通过对早期AD患者鼻内嗅觉上皮细胞的研究,发现该细胞中大量miR-206的高表达可以使BDNF表达水平明显下调,加速记忆缺陷的发生,影响早期AD的进展。而miR-132可能与SIRT1的3′UTRs结合而抑制SIRT1的表达[12]。这些结果表明:miR-206和miR-132可能通过调控患者体内BDNF和SIRT1的表达水平而影响AD的进程。
本研究进一步通过生物信息学分析发现:BDNF的生物学功能主要集中在神经系统发育、神经干细胞分化、突触联系、树突棘形成和神经细胞的保护等方面;而SIRT1主要在氧化应激、神经细胞凋亡、炎症反应和神经可塑性等方面发挥作用。已经有研究[13-15]证明:BDNF主要通过增加突触终末的密度、促进树突和轴突的生长2种途径来改善突触的可塑性,从而直接参与调节学习和记忆过程。体内外实验[16]均证实AD患者脑内β淀粉样蛋白可以引起BDNF水平下降,并且与β淀粉样蛋白的种类和数量呈负相关关系。Tang等[17]采用SIRT1激活剂白藜芦醇上调神经细胞SIRT1的表达,减少活性氧ROS的产生,改善了氧化损伤对空间记忆能力的损害。Michán等[18]发现:SIRT1与小鼠的学习、认知及突触功能的建立密切相关。这些研究揭示了miR-206和miR-132参与aMCI发病的可能机制。
由于本研究样本量较小,存在一定的局限性。为避免设计效应与样本量对本实验结果的影响,本研究采用靴值分析检验统计量。其原理是从待分析的数据中随机重新取样,代替原有的数据,重建一系列与原数据同样大小的“鞋带”式取样数据,一般重复500或1000次。靴值分析结果证实了本研究测定结果的可信度。
| [1] | 贾建平, 周爱红. 中国老年人轻度认知障碍的患病率和病因亚型研究[J]. 中华内科杂志, 2014, 53(5): 411. |
| [2] | Cao X, Yeo G, Muotri AR, et al. Noncoding RNAs in the mammalian central nervous system[J]. AnnuRev Neurosci, 2006, 29(29): 77–103. |
| [3] | 张敏, 吴洁. 微小RNA与认知功能障碍[J]. 国际妇产科学杂志, 2013, 40(3): 230–233. |
| [4] | Zhang R, Zhang Q, Niu J, et al. Screening of microRNAs associated with Alzheimer's disease using oxidative stress cell model and different strains of senescence accelerated mice[J]. J Neurol Sci, 2014, 338(1/2): 57–64. |
| [5] | Petersen RC. Mild cognitive impairment as a diagnostic entity[J]. J Intern Med, 2004, 256(3): 183–194. DOI:10.1111/jim.2004.256.issue-3 |
| [6] | 俞焙秦, 刘炳亚. miRNA的生物学特性和功能[J]. 上海交通大学学报:医学版, 2007, 27(5): 621–623. |
| [7] | Wang WX, Huang Q, Hu Y, et al. Patterns of microRNA expression in normal and early Alzheimer's disease human temporal cortex:white matter versus gray matter[J]. Acta Neuropathol, 2011, 121(2): 193–205. DOI:10.1007/s00401-010-0756-0 |
| [8] | Wang WX, Rajeev BW, Stromberg AJ, et al. The expression of microRNA miR-107 decreases early in Alzheimer's disease and may accelerate disease progression through regulation of beta-site amyloid precursor protein-cleaving enzyme 1[J]. J Neurosci, 2008, 28(5): 1213–1223. DOI:10.1523/JNEUROSCI.5065-07.2008 |
| [9] | Lee ST, Chu K, Jung KH, et al. MiR-206 regulates brain-derived neurotrophic factor in Alzheimer disease model[J]. Ann Neurol, 2012, 72(2): 269–277. DOI:10.1002/ana.v72.2 |
| [10] | Yang D, Li T, Wang Y, et al. MiR-132 regulates the differentiation of dopamine neurons by directly targeting Nurr1 expression[J]. J Cell Sci, 2012, 125(7): 1673–1682. DOI:10.1242/jcs.086421 |
| [11] | Moon J, Lee ST, Sunwoo JS, et al. Early diagnosis of Alzheimer's disease from elevated olfactory mucosal miR-206 level[J]. Sci Rep, 2016, 6: 20364. DOI:10.1038/srep20364 |
| [12] | Strum JC, Johnson JH, Ward J, et al. MicroRNA 132 regulates nutritional stress-induced chemokine production through stress-induced chemokine production through repression of Sirt1[J]. Mol Endocrinol, 2009, 23(11): 1876–1884. DOI:10.1210/me.2009-0117 |
| [13] | Mertz K, Koscheck T, Schilling K. Brain-derived neurotrophic factor modulates dendritic morphology of cerebellar basket and stellate cells:an in vitro study[J]. Neuroscience, 2000, 97(2): 303–310. DOI:10.1016/S0306-4522(99)00585-0 |
| [14] | Gao X, Smith GM, Chen J. Impaired dendritic development and synaptic formation of postnatal-born dentate gyrus granular neurons in the absence of brain-derived neurotrophic factor signaling[J]. Exp Neurol, 2009, 215(1): 178–190. DOI:10.1016/j.expneurol.2008.10.009 |
| [15] | Chapleau CA, Carlo ME, Larimore JL, et al. The actions of BDNF on dendritic spine density and morphology in organotypic slice cultures depend on the presence of serum in culture media[J]. J Neurosci Methods, 2008, 169(1): 182–190. DOI:10.1016/j.jneumeth.2007.12.006 |
| [16] | Peng S, Garzon DJ, Marchese M, et al. Decreased brain-derived neurotrophic factor depends on amyloid aggregation state in transgenic mouse models of Alzheimer's disease[J]. J Neurosci, 2009, 29(29): 9321–9329. DOI:10.1523/JNEUROSCI.4736-08.2009 |
| [17] | Tang Y, Xu J, Qu W, et al. Resveratrol reduces vascular cell senescence through attenuation of oxidative stress by SIRT1/NADPH oxidase-dependent mechanisms[J]. J Nutr Biochem, 2012, 23(11): 1410–1416. DOI:10.1016/j.jnutbio.2011.08.008 |
| [18] | Michán S, Li Y, Chou MM, et al. SIRT1 is essential for normal cognitive function and synaptic plasticity[J]. J Neurosci, 2010, 30(29): 9695–9707. DOI:10.1523/JNEUROSCI.0027-10.2010 |
 2017, Vol. 43
2017, Vol. 43


