扩展功能
文章信息
- 侯睿哲, 赵颖佳, 刘艳, 陈群帮, 付红, 陈井彦, 赵兴利
- HOU Ruizhe, ZHAO Yingjia, LIU Yan, CHEN Qunbang, FU Hong, CHEN Jingyan, ZHAO Xingli
- 弥散张量成像的部分各项异性值和表观弥散系数值在胶质瘤分级中应用的Meta分析
- Application of diffusion tensor imaging FA value and ADC value in glioma grading:AMeta-analysis
- 吉林大学学报(医学版), 2017, 43(02): 311-316
- Journal of Jilin University (Medicine Edition), 2017, 43(02): 311-316
- 10.13481/j.1671-587x.20170219
-
文章历史
- 收稿日期: 2016-03-28
2. 吉林大学第二医院妇产科, 吉林 长春 130041;
3. 吉林大学中日联谊医院超声科, 吉林 长春 130033
2. Department of Obstetrics and Gynecology, Second Hospital, Jilin University, Changchun 130041, China;
3. Department of Ultrasound, China-Japan Union Hospital, Jilin University, Changchun 130033, China
胶质瘤 (glioma) 是最常见的颅内原发恶性肿瘤,占颅内原发肿瘤的40%~50%。根据2007年WHO中枢神经系统的肿瘤分类[1],胶质瘤分为Ⅰ~Ⅳ级,其中WHOⅠ级和Ⅱ级为低级别胶质瘤 (low-grade glioma,LGG),WHOⅢ级和Ⅳ级为高级别胶质瘤 (high-grade glioma,HGG)。因LGG与HGG在恶性程度及侵袭性生长方面存在较大差异,故术前明确胶质瘤的分级,有助于治疗方案的制定及疾病预后的判断。在近几年国内外的研究[2-12]中,弥散张量成像 (diffusion tensor imaging,DTI) 的量化参数指标逐渐成为评价胶质瘤肿瘤级别的热点,特别是部分各向异性 (fractional anisotropy,FA) 值[13-15]和表观弥散系数 (apparent diffusion coefficient,ADC) 值[16]更为常用。但很多报道[2-5]的结果往往因为研究设计、研究对象和处理因素等多的不同而有差异,甚至相互矛盾,且尚无对FA值与ADC值进行系统评价的文献报道。本研究为明确FA值及ADC值在胶质瘤分级中的应用,采用Meta分析的方法,对以往的研究结果进行定量综合分析,以期为神经外科医生的临床实践提供更为可靠的循证医学证据。
1 资料与方法 1.1 检索方法采用MeSH主题词与关键词检索相结合的检索策略,检索1994年—2014年3月关于FA值和ADC值在胶质瘤分级中应用的文献。以“弥散张量成像”、“部分各向异性”、“表观弥散系数”、“胶质瘤”、“diffusion tensor imaging”、“glioma”、“apparent diffusion coefficient”、“fractional anisotropy”、“ADC”、“FA”为关键词或主题词,经2名系统评价员共同商议后,计算机检索PubMed数据库、EMBASE数据库、中国知网 (CNKI)、万方数据库和维普数据库。手工检索神经外科学杂志、神经影像学杂志和有关神经外科的学术会议论文集,回溯检索综述性论文的参考文献。
1.2 纳入标准与排除标准纳入标准:①研究类型,选择临床病例系列研究;②研究对象,经病理证实为胶质瘤的患者,且分为LGG组 (WHOⅠ~Ⅱ级) 与HGG组 (WHOⅢ~Ⅳ级);③干预措施,DTI的参数弥散敏感系数 (b值) 均为1000 s·mm-2;感兴趣区 (region of interest,ROI) 为T1WI呈软组织信号,T1WI增强后有明显强化的区域,或者虽无强化,但T2WI呈高信号或Flair呈高信号的区域 (指瘤体内,不包括水肿区) 且可获得ROI的FA值或ADC值。排除标准:①研究类型,同一人群资料的重复研究,统计学方法错误的研究;②研究对象,排除发生坏死及囊变的胶质瘤患者;③干预措施,ROI的选择不明确。
1.3 纳入文献的质量评价采用英国国立临床优化研究所 (National Institute for Clinical Excellence,NICE) 推荐的对病例系列研究的质量评价标准[17],对纳入的文献进行评分。
1.4 统计学分析采用Review Manager 5.2软件进行Meta分析。对各研究效应量做异质性检验, 根据异质性检验结果确定效应量合并的方法, 若实验结果间同质,采用固定效应模型;反之采用随机效应模型。采用加权均数差 (WMD) 及其95%可信区间 (CI) 为效应指标。变更效应指标为标准化均数差 (SMD) 及其95%CI,行敏感性分析。观察漏斗图的对称程度,定性测量发表偏倚。
2 结果 2.1 纳入文献及其质量评价查找全文数据库 (OVID平台、Wiley数据库、Elsevier数据库、SpringLink数据库) 获取全文。计算机检索:计算机检索PubMed数据库329篇、EMBASE数据库573篇、中国知网 (CNKI)43篇、中国生物医学数据库 (CBM)176篇,万方数据库22篇和维普数据库53篇。手工检索神经外科学杂志、神经影像学杂志和有关神经外科的学术会议论文集8篇,回溯检索综述性论文的参考文献16篇,联系作者未发表的文章0篇。各个数据库中查出的文献进行整合,排除重复文献1182篇,得到可能相关主题的文献38篇,阅读文献的题目及摘要信息,初步筛选剔除明显不相关的文献8篇,得到可能相关主题的文献30篇,查全文数据库,获取全文,排除不符合纳入标准的文献21篇,共有9篇文献入选本研究。采用NICE推荐的对病例系列研究的质量评价标准[17],对纳入的文献进行评分 (满分8分)。纳入文献的基本情况及质量评价见表 1。
| Study | Year | Group | NICE score | |
| No. of LGG | No.of HGG | |||
| Wang X[18] | 2013 | 23 | 15 | 4 |
| Ma L, et al.[19] | 2013 | 10 | 15 | 6 |
| Piyapittayanans S, et al.[20] | 2013 | 17 | 26 | 5 |
| Smitha KA, et al.[21] | 2013 | 49 | 30 | 7 |
| Chen F[22] | 2012 | 8 | 6 | 5 |
| White ML, et al.[23] | 2011 | 9 | 25 | 6 |
| Kinoshita M, et al.[15] | 2008 | 6 | 9 | 5 |
| Stadlbauer A, et al.[9] | 2006 | 7 | 13 | 5 |
| Goebell E, et al.[24] | 2006 | 11 | 12 | 4 |
设定ROI为胶质瘤肿瘤实质区,分别测量LGG和HGG的FA值与ADC值,该资料类型为数值变量资料,采用WMD作为合并统计量,行Meta分析FA值。按照α=0.10的检验水准,行异质性检验,P=0.15 > 0.05,I2=33%,表明研究间异质性差异无统计学意义,故采用固定效应模型合并效应量,选择Ⅰ-Ⅴ法,WMDFA值=-0.02,95%CI:-0.03~-0.01,有统计学意义,显示LGG肿瘤实质区的FA值低于HGG肿瘤实质区的FA值。见图 1。ADC值:按照α=0.10的检验水准,行异质性检验,P=0.26 > 0.05,I2=24%,表明各研究间异质性无统计学意义,故采用固定效应模型合并效应量,选择Ⅰ-Ⅴ法,WMDADC值=0.15,95%CI:0.02~0.28, 差异有统计学意义;LGG肿瘤实质区的ADC值高于HGG肿瘤实质区的ADC值。见图 2。
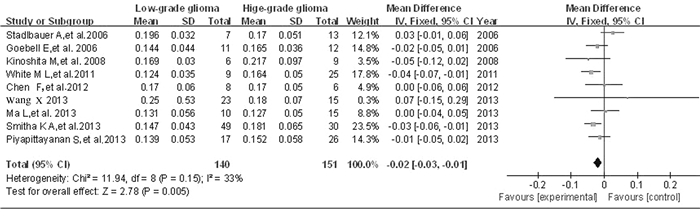
|
| 图 1 FA值在胶质瘤分级中应用的森林图 Figure 1 Forest plot of FA value applicated in glioma grading |
|
|
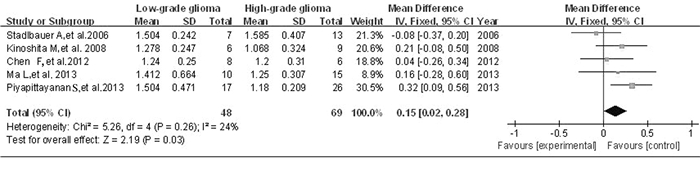
|
| 图 2 ADC值在胶质瘤分级中应用的森林图 Figure 2 Forest plot of ADC value applicated in glioma grading |
|
|
变换效应量为SMD,行敏感性分析。SMDFA值=-0.29,95%CI:-0.53~-0.5;SMDADC值=-0.47,95%CI:0.09~0.85,均未改变原结果,提示本研究的合并分析结果稳定,结论可靠。
2.4 发表偏倚分析FA值的漏斗图显示:各点左右分布略显不对称,提示关于FA值纳入的文献资料存在潜在的发表偏倚。见图 3。ADC值的漏斗图显示:各点左右分布比较对称,提示关于ADC值纳入的文献资料存在较小的发表偏倚。见图 4。
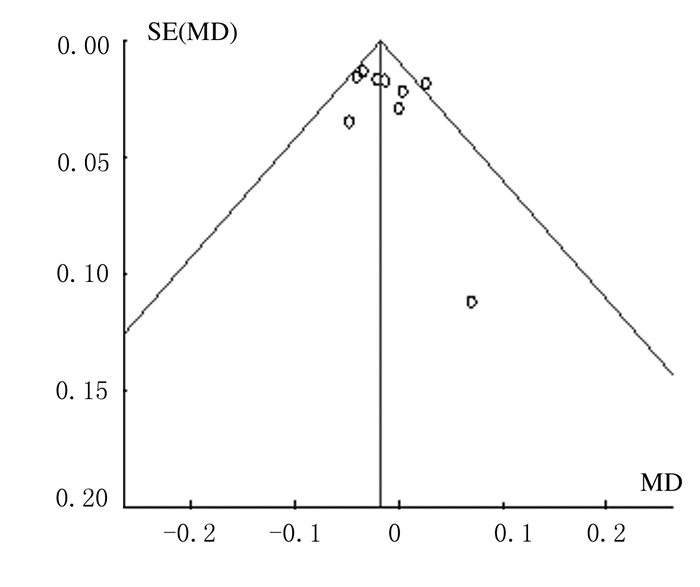
|
| 图 3 FA值在胶质瘤分级中应用合并结果的漏斗图 Figure 3 Funnel plot of combined results of FA value applicated in glioma grading |
|
|
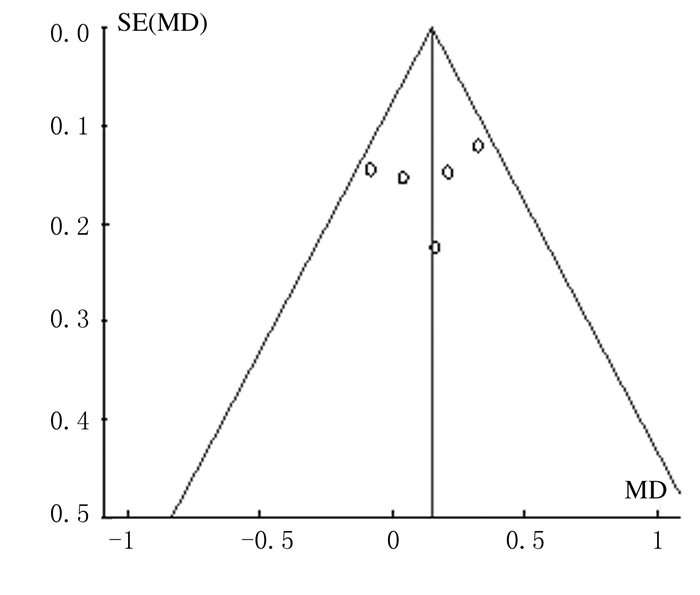
|
| 图 4 ADC值在胶质瘤分级中应用合并结果的漏斗图 Figure 4 Funnel plot of combined results of ADC value applicated in glioma grading |
|
|
胶质瘤的术前分级对于胶质瘤治疗方案的选择及预后判断十分重要。常规的核磁共振等影像学方法虽然能直观地显示颅内病变,但不能很好地对肿瘤进行分级。利用DTI对胶质瘤进行定性、定量分析是近年来的研究热点,特别是定量参数ADC值和FA值,能够从微观上对胶质瘤进行诊断与分级。本研究通过检索有关胶质瘤中FA值和ADC值的相关文献,分别进行Meta分析,结果显示:LGG肿瘤实质区的FA值低于HGG肿瘤实质区的FA值,LGG肿瘤实质区的ADC值高于HGG肿瘤实质区的ADC值。FA值是水分子弥散方向的定量参数,LGG肿瘤实质区的FA值低于HGG肿瘤实质区的FA值说明HGG肿瘤实质区水分子的弥散更趋于往一个方向,分析其原因,考虑到LGG与HGG的肿瘤实质区的白质纤维束均已破坏,使水分子失去沿轴突走行弥散的方向,但HGG肿瘤实质区的肿瘤细胞往往呈恶性生长,细胞密度较LGG会明显增加,导致细胞外间隙明显减小,存在水分子在某一区域沿细胞外间隙走向而弥散的可能,所以HGG肿瘤实质区的FA值比LGG肿瘤实质区的FA值更高[3];但也有研究[11]显示:HGG的肿瘤细胞进一步恶变坏死,水分子的运动空间将加大,进而方向性减弱,FA值会减低。尽管HGG存在这样的发展趋势,但本研究纳入的文献中,肿瘤实质区均未发生囊变坏死,存在相应病理改变的文献均被排除标准排除在外。ADC值是描述水分子弥散程度大小的定量指标,代表水分子弥散的平均程度。也就是说水分子弥散的越快,ADC值就越高,反之亦然。HGG肿瘤实质区的ADC值较LGG肿瘤实质区的ADC值低,说明肿瘤级别越高,水分子弥散受限越明显,这是由于肿瘤的恶性程度越高,细胞数目越多,细胞增殖比例就越大,而细胞外间隙则越小,再加之细胞异型性随恶性度增高,核浆比例加大,导致水分子弥散运动受限,ADC值较低。另外,LGG肿瘤细胞增殖及有丝分裂不明显,因此水分子易于沿着宽大的细胞外间隙扩散,致使其ADC值高于HGG[25]。
综上所述,胶质瘤实质区的FA值越大,ADC值越低,胶质瘤的级别就越高。本研究结果有助于临床医生对治疗方案的选择和判断预后。但本研究中因未纳入中、英文以外语种的文献,可能造成语种偏倚。因此, 在今后的研究中,尚需要解决此类问题,以使FA值及ADC值在评估胶质瘤分级中更具有说服力。
| [1] | 《中国中枢神经系统胶质瘤诊断和治疗指南》编写组. 中国中枢神经系统胶质瘤诊断和治疗指南 (2012)[J]. 中华医学杂志, 2013, 93(31): 2418–2449. |
| [2] | Stecco A, Pisani C, Quarta R, et al. DTI and PWI analysis of peri-enhancing tumoral brain tissue in patients treated for glioblastoma[J]. J Neurooncol, 2011, 102(2): 261–271. DOI:10.1007/s11060-010-0310-x |
| [3] | Abdullah KG, Lubelski D, Nucifora PG, et al. Use of diffusion tensor imaging in glioma resection[J]. Neurosurg Focus, 2013, 34(4): E1. DOI:10.3171/2013.1.FOCUS12412 |
| [4] | Byrnes TJ, Barrick TR, Bell BA, et al. Diffusion tensor imaging discriminates between glioblastoma and cerebral metastases in vivo[J]. NMR Biomed, 2011, 24(1): 54–60. DOI:10.1002/nbm.v24.1 |
| [5] | De Belder FE, Oot AR, van Hecke W, et al. Diffusion tensor imaging provides an insight into the microstructure of meningiomas, high-grade gliomas, and peritumoral edema[J]. J Comput Assist Tomogr, 2012, 36(5): 577–582. DOI:10.1097/RCT.0b013e318261e913 |
| [6] | Castillo M, Smith JK, Kwock L, et al. Apparent diffusion coefficients in the evaluation of high-grade cerebral gliomas[J]. AJNR Am J Neuroradiol, 2001, 22(1): 60–64. |
| [7] | 何光武, 孟宪科, 孙洪勋, 等. 大脑胶质瘤弥散张量磁共振成像定量研究[J]. 中国中西医结合影像学杂志, 2005, 3(2): 111–114. |
| [8] | Morita K, Matsuzawa H, Fujii Y, et al. Diffusion tensor analysis of peritumoral edema using lambda chart analysis indicative of the heterogeneity of the microstructure within edema[J]. J Neurosurg, 2005, 102(2): 336–341. DOI:10.3171/jns.2005.102.2.0336 |
| [9] | Stadlbauer A, Ganslandt O, Buslei R, et al. Gliomas:histopathologic evaluation of changes in directionality and imaging magnitude of water diffusion at diffusion-tensor MR[J]. Radiology, 2006, 240(3): 803–810. DOI:10.1148/radiol.2403050937 |
| [10] | 晏怡, 唐文渊, 邓朝霞, 等. 弥散张量成像 (DTI) 对肿瘤脑浸润的量化和应用[J]. 中国神经精神疾病杂志, 2008, 34(11): 666–670. |
| [11] | 李敏, 贾中正, 顾红梅, 等. 表观弥散系数值与部分各向异性值在脑星形胶质细胞瘤分级中的作用[J]. 中华医学杂志, 2008, 88(47): 3352–3355. |
| [12] | 蒋玲, 姚振威, 冯晓源. DTI定量参数对胶质瘤病理及治疗的评价[J]. 国际医学放射学杂志, 2011, 34(2): 126–129. |
| [13] | Cortez-Conradis D, Favila R, Isaac-Olive K, et al. Diagnostic performance of regional DTI-derived tensor metrics in glioblastoma multiforme:simultaneous evaluation of p, q, L, Cl, Cp, Cs, RA, RD, AD, mean diffusivity and fractional anisotropy[J]. Eur Radiol, 2013, 23(4): 1112–1121. DOI:10.1007/s00330-012-2688-7 |
| [14] | Beppu T, Inoue T, Shibata Y, et al. Fractional anisotropy value by diffusion tensor magnetic resonance imaging as a predictor of cell density and proliferation activity of glioblastomas[J]. Surg Neurol, 2005, 63(1): 56–61. DOI:10.1016/j.surneu.2004.02.034 |
| [15] | Kinoshita M, Hashimoto N, Goto T, et al. Fractional anisotropy and tumor cell density of the tumor core show positive correlation in diffusion tensor magnetic resonance imaging of malignant brain tumors[J]. Neuroimage, 2008, 43(1): 29–35. DOI:10.1016/j.neuroimage.2008.06.041 |
| [16] | 彭娟, 罗天友, 方维东, 等. ADC值和rADC值在脑星形细胞瘤分级诊断中的应用价值[J]. 实用放射学杂志, 2006, 22(4): 398–401. |
| [17] | NICE.Appendix 4 Quality of case series form[EB/OL].[2014-3-21].Available from URL:http://www.nice.org.uk/guidance/index.jsp?action=download&o=29075. |
| [18] | 王鑫. DTI、DTT及MRS在胶质瘤分级和术前评价中的应用价值研究[D]. 长春: 吉林大学, 2013. |
| [19] | Ma L, Song ZJ. Differentiation between low-grade and high-grade glioma using combined diffusion tensor imaging metrics[J]. Clin Neurol Neurosurg, 2013, 115(12): 2489–2495. DOI:10.1016/j.clineuro.2013.10.003 |
| [20] | Piyapittayanan S, Chawalparit O, Tritakarn SO, et al. Value of diffusion tensor imaging in differentiating high-grade from low-grade gliomas[J]. Chotmaihet Thangphaet, 2013, 96(6): 716–721. |
| [21] | Smitha KA, Gupta AK, Jayasree RS. Total magnitude of diffusion tensor imaging as an effective tool for the differentiation of glioma[J]. Eur J Radiol, 2013, 82(5): 857–861. DOI:10.1016/j.ejrad.2012.12.027 |
| [22] | Chen F, Zhang X, Li M, et al. Axial diffusivity and tensor shape as early markers to assess cerebral white matter damage caused by brain tumors using quantitative diffusion tensor tractography[J]. CNS Neurosci Ther, 2012, 18(8): 667–673. DOI:10.1111/cns.2012.18.issue-8 |
| [23] | White ML, Zhang Y, Yu F, et al. Diffusion tensor MR imaging of cerebral gliomas:evaluating fractional anisotropy characteristics[J]. AJNR Am J Neuroradiol, 2011, 32(2): 374–381. DOI:10.3174/ajnr.A2267 |
| [24] | Goebell E, Paustenbach S, Vaeterlein O, et al. Low-grade and anaplastic gliomas:differences in architecture evaluated with diffusion-tensor MR imaging[J]. Radiology, 2006, 239(1): 217–222. DOI:10.1148/radiol.2383050059 |
| [25] | Higano S, Yun X, Kumabe T, et al. Malignant astrocytic tumors:clinical importance of apparent diffusion coefficient in prediction of grade and prognosis[J]. Radiology, 2006, 241(3): 839–846. DOI:10.1148/radiol.2413051276 |
 2017, Vol. 43
2017, Vol. 43


