扩展功能
文章信息
- 糜心雅, 石立强, 李洪宇, 苑广信, 谢立亚, 杜培革, 安丽萍
- MI Xinya, SHI Liqiang, LI Hongyu, YUAN Guangxin, XIE Liya, DU Peige, AN Liping
- 高活性小牛血去蛋白提取物对糖尿病大鼠肾损伤的保护作用
- Protective effect of high activity deproteinized extract of calf blood on kidney injury of diabetic rats
- 吉林大学学报(医学版), 2017, 43(02): 293-297
- Journal of Jilin University (Medicine Edition), 2017, 43(02): 293-297
- 10.13481/j.1671-587x.20170216
-
文章历史
- 收稿日期: 2016-08-04
小牛血去蛋白提取物 (deproteinized extract of calf blood, DECB) 是一种从小牛血清中提取的小分子生物活性物质,其中30%的有机成分包括低分子多肽、核苷、氨基酸和寡糖等物质。目前临床上DECB主要用于治疗脑细胞代谢障碍性疾病,同时还具有角膜修复功能[1-2]。有研究[3-4]表明:DECB具有改善神经细胞代谢和糖尿病周围神经病变等作用。本课题组一直致力于DECB相关研究,改进其生产工艺,提高药效学活性,这种高活性的DECB生产工艺已经获得国家授权专利 (专利号:201210434370.7)[5]。DECB保护糖尿病周围神经病变的作用在临床上已经得到应用[6],但对于糖尿病肾脏损伤的保护作用少有报道。本研究旨在探讨DECB对糖尿病大鼠肾损伤的保护作用及其作用机制,为DECB对糖尿病肾病 (diabetic hephropathy, DN) 大鼠肾脏的保护作用及其应用提供依据。
1 材料与方法 1.1 实验动物、主要试剂和仪器健康Wistar雄性大鼠100只,体质量165~189 g,由吉林省长春市亿斯实验动物技术有限责任公司提供 (动物许可证号:SCXK (吉)20140003)。高活性DECB由本实验室自制,高密度脂蛋白胆固醇 (HDL-C)、低密度脂蛋白胆固醇 (LDL-C)、总胆固醇 (TC)、甘油三酯 (TG)、尿素氮 (BUN)、血肌酐 (SCr)、尿酸 (UA)、尿微量白蛋白 (UAlb)、尿肌酐 (UCr) 和超氧化物歧化酶 (SOD) 测定试剂盒均购自中生北控生物科技股份有限公司,谷胱甘肽 (GSH)、谷胱甘肽过氧化物酶 (GSH-Px) 和丙二醛 (MDA) 试剂盒均购自南京建成生物工程研究所 (批号分别为20150607、20150426和20150523)。SPX-250B-Z型恒温生化培养箱 (上海博远实业有限公司),5430R低温高速离心机 (美国Eppendorf公司),紫外分光光度计 (日本岛津国际贸易有限公司),Infinite M200型酶标仪 (瑞士TECAN公司)。
1.2 糖尿病模型制备100只雄性Wistar大鼠适应性饲养1周后,随机抽取10只作为空白对照 (NC) 组,以普通饲料喂养,其余大鼠腹腔注射溶于0.1 mol·L-1枸橼酸缓冲液 (pH4.2) 的链脲霉素 (STZ)(65 mol·kg-1) 建立糖尿病模型,给药1次。1周后检测空腹血糖,以空腹血糖≥7.8 mmol·L-1作为模型成功的判定标准。
1.3 动物分组和给药将模型制备成功的大鼠按血糖水平 (7.8~16.0 mmol·L-1) 分为5组,每组10只,分别为模型 (M) 组、二甲双胍 (MMet) 组、低剂量DECB联合给药 (ML) 组、中剂量DECB联合给药 (MM) 组和高剂量DECB联合给药 (MH) 组。MMet组大鼠灌胃给予二甲双胍的剂量为105mg·kg-1。ML、MM和MH组在灌胃给予等剂量二甲双胍的同时腹腔注射给予DECB,剂量分别为94.5、189.0和378.0 mg·kg-1,每日1次,连续给药8周。
1.4 生化指标检测给药8周结束后,将大鼠放入代谢笼中,收集12h尿液,取上清,测定尿液中UAlb和Ucr水平。腹腔注射乌拉坦100 mg·kg-1麻醉,腹主动脉取血4~5 mL并处死动物。血样于3500 r·min-1离心10 min,分离血清,按照试剂盒说明书方法测定血清中血糖、TC、TG、HDL-C、LDL-C、UA、BUN、SCr、GSH、MDA水平和SOD、GSH-Px活性。
1.5 肾脏组织病理形态学观察取出大鼠肾脏,采用10%中性甲醛固定,常规石蜡包埋、切片,HE染色,光镜下观察大鼠肾组织病理学变化。
1.6 统计学分析采用SPSS16.0统计软件进行统计学分析。各组大鼠尿液中UAlb和Ucr水平,血清中血糖、TC、TG、HDL-C、LDL-C、UA、BUN、SCr、CSH和MDA水平,以及SOD和GSH-Px活性均以x±s表示,组间比较采用t检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 各组大鼠体质量和血糖水平造模前各组大鼠体质量差异无统计学意义 (P > 0.05);给药后与NC组比较,M组大鼠体质量明显降低 (P < 0.05),血糖水平明显升高 (P < 0.05);与M组比较,MH、MM、ML和MMet组大鼠体质量明显升高 (P < 0.05,MH和MM组血糖明显降低 (P < 0.05)。见表 1。
| (n=10, x±s) | ||
| Group | Weight (m/g) | Level of blood glucose [cB/(mmol·L-1)] |
| NC | 285.45±14.34 | 4.71±0.41 |
| M | 115.47±31.27* | 28.8±3.65* |
| ML | 136.47±17.28△ | 27.53±3.87 |
| MM | 149.45±12.94△ | 20.74±5.85△ |
| MH | 146.83±23.53△ | 22.62±4.91△ |
| MMet | 133.45±25.94△ | 27.05±3.53 |
| *P < 0.05 vs NC group; △P < 0.05 vs M group. | ||
与NC组比较,M组大鼠UAlb和UCr水平明显升高 (P < 0.05);与M组比较,MM和MH组大鼠UAlb和UCr水平明显降低 (P < 0.05);与MMet组比较,MM和MH组大鼠UAlb和UCr水平明显降低 (P < 0.05)。见表 2。
| (n=10, x±s) | ||
| Group | UAlb (m/mg) | UCr [cB/(μmol·L-1)] |
| NC | 19.96±1.52 | 20.86±2.14 |
| M | 41.94±3.22* | 35.29±7.38* |
| ML | 39.66±3.89 | 33.91±6.90 |
| MM | 35.03±1.73△# | 27.09±6.05△# |
| MH | 34.53±1.98△# | 28.85±6.73△# |
| MMet | 39.72±2.17 | 34.59±6.92 |
| *P < 0.05 vs NC group; △ P < 0.05 vs M group;#P < 0.05 vs MMet group. | ||
与NC组比较,给药后M组大鼠血清中SCr、UA和BUN水平均明显升高 (P < 0.05);与M组比较,MM和MH组大鼠SCr、UA和BUN水平均降低 (P < 0.05),ML组虽有降低趋势但差异无统计学意义 (P > 0.05);与MMet组比较,MM和MH组大鼠BUN、UA和Scr水平明显降低 (P < 0.05)。见表 3。
| (n=10, x±s) | |||
| Group | SCr [cB/(mmol·L-1)] | UA [cB/(μmol·L-1)] | BUN [cB/(mmol·L-1)] |
| NC | 7.46±1.64 | 456.01±78.25 | 6.52±0.15 |
| M | 17.24±3.41* | 771.57±70.79* | 13.45±0.40* |
| ML | 16.97±3.21 | 765.21±32.66 | 12.98±0.61 |
| MM | 13.32±3.32△# | 618.70±38.56△# | 10.09±1.48△# |
| MH | 12.65±3.14△# | 693.29±57.33△# | 8.88±1.63△# |
| MMet | 17.09±3.22 | 769.81±14.04 | 13.24±0.78 |
| *P < 0.05 vs NC group; △P < 0.05 vs M group;#P < 0.05 vs MMet group. | |||
与NC组比较,M组大鼠血清中LDL-C、TC和TG水平明显升高 (P < 0.05),HDL-C水平明显降低 (P < 0.05);与M组比较,ML和MM组大鼠LDL-C和TC水平均明显降低 (P < 0.05), HDL-C水平升高 (P < 0.05), MH和MMet组大鼠LDL-C、TC和HDL-C水平无明显改变,ML、MM、MH和MMet组大鼠TG水平显著降低 (P < 0.05)。见表 4。
| [n=10, x±s, cB/(mmol·L-1)] | ||||
| Groups | LDL-C | HDL-C | TC | TG |
| NC | 1.75±0.08 | 1.22±0.09 | 1.03±0.07 | 1.03±0.07 |
| M | 3.43±0.08* | 0.61±0.06* | 15.61±0.53* | 1.81±0.29* |
| ML | 3.23±0.21 | 0.66±0.04 | 14.58±1.06 | 1.50±0.85△ |
| MM | 3.02±0.53△ | 0.73±0.09△ | 13.71±1.58△ | 1.41±1.13△ |
| MH | 3.12±0.35△ | 0.71±0.09△ | 13.81±1.47△ | 1.45±1.18△ |
| MMet | 3.26±0.18 | 0.65±0.03 | 14.57±1.13 | 1.46±0.23△ |
| * P < 0.05 vs NC group; △P < 0.05 vs M group | ||||
与NC组比较,M组大鼠血清中SOD、GSH-Px活性和GSH水平明显降低 (P < 0.05);与M组比较,MH、MM、ML和MMet组大鼠SOD、GSH-Px活性和GSH水平明显升高 (P < 0.05)。与NC组比较,M组大鼠血清中MDA水平明显升高 (P < 0.05);与M组比较,ML、MM、MH和MMet组大鼠血清中MDA水平均明显降低 (P < 0.05)。见表 5。
| (n=10, x±s) | ||||
| Group | SOD [λB/(U·mg-1prot)] |
GSH-Px [λB/(U·mg-1prot)] |
MDA [λB/(μmol·mg-1prot)] |
GSH [λB/(μmol·mg-1prot)] |
| NC | 439.45±20.46 | 99.02±9.50 | 2.44±0.24 | 463±25 |
| M | 314.83±8.51* | 14.99±2.15* | 3.50±0.24* | 311±56* |
| ML | 323.33±4.81△ | 18.12±3.10△ | 3.24±0.29△ | 335±11△ |
| MM | 337.06±7.16△ | 26.61±6.56△ | 3.13±0.25△ | 376±58△ |
| MH | 333.43±14.53△ | 26.23±8.57△ | 3.14±0.33△ | 364±49△ |
| MMet | 325.32±8.57△ | 18.67±5.12△ | 3.29±0.22△ | 333±31△ |
| *P < 0.05 vs NC group; △P < 0.05 vs M group | ||||
NC组肾小管和肾小球大小及形态均正常,肾小球血管薄而清晰;M组肾小球出现充血、破裂,肾小管严重水肿,间质轻度增生;ML组肾小球周围水肿、变性明显。MMet组肾小球充血严重。与M组比较, MM和MH组细胞状态明显改善,间质增质增生不明显,肾小球无明显增加。见图 1(插页四)。
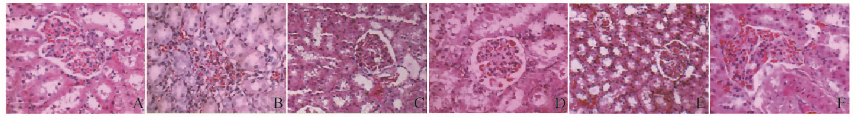
|
| A:N Control; B:M group; C: ML group; D: MM group; E: MH group; F:MMet group. 图 1 各组大鼠肾脏组织病理形态学表现 (HE,×400) Figure 1 Pathomorphology of kidney tissue of rats in various groups (HE, ×400) |
|
|
DN是糖尿病微血管病变最常见的并发症之一,也是造成终末期肾病 (ESRD) 的最常见原因之一,有20%~40%糖尿病患者最终会发展到DN阶段[7-9]。UAlb和UCr升高是整个血管系统改变的征象,是肾脏和心血管系统改变的早期指征[10-11]。本研究中大鼠给药8周后,模型组大鼠尿液中UAlb和UCr水平升高,提示糖尿病大鼠肾脏出现损伤。病理观察结果显示:M组大鼠肾脏组织病变明显,肾小球充血,肾小管水肿。血清学检测结果显示:M组大鼠血清BUN、UA和SCr水平明显升高,其原因是由于肾小球滤过功能降低。经DECB联合给药治疗后,大鼠血清BUN、UA和SCr水平明显降低,说明DECB对肾小球滤过功能起到一定保护作用,其作用机制可能为DECB中的磷酸肌醇寡糖和小分子激活肽,促进线粒体合成ATP,改善缺血状态下细胞对氧的利用,活化细胞,并可转变细胞的无氧糖酵解为有氧糖代谢,从而延长细胞在缺血缺氧状态下生存时间[12-14],增加组织细胞的抵抗能力,同时抑制缺血瀑布中的重要介导物质即一氧化氮的合成,全方位阻断缺血瀑布反应,提高肾脏缺血,改善肾小球滤过率,延缓肾功能衰退[15-16]。
本研究结果显示:DECB联合给药还可减轻糖尿病大鼠的高血脂状况。与M组比较,各给药组LDL-C水平明显降低,HDL-C水平明显升高。而M组大鼠TC和TG水平明显升高,说明M组大鼠已经产生血管病变。经DECB联合给药治疗后,大鼠TC和TG水平明显降低,说明DECB对于糖尿病血管病变有保护作用。同时,糖尿病大鼠体内发生较强的氧化应激,SOD和GSH-Px活性及GSH水平明显降低,脂质过氧化物MDA水平明显著升高;而DECB能显著升高糖尿病大鼠血清SOD和GSH-Px活性及GSH水平,并降低MDA水平,提示DECB可以通过降低体内氧化应激程度从而起到保护糖尿病大鼠肾损伤的作用。肾脏组织病理观察结果显示:与M组比较,各给药组大鼠肾脏组织病变明显好转,肾小管空泡变性减轻,间质增生不明显。
综上所述,DECB联合二甲双胍给药可降低糖尿病大鼠血糖水平,改善糖尿病大鼠肾组织病理学变化;降低尿液中UAlb和UCr水平以减轻肾脏损伤;降低血清中TC、TG和LDL-C水平,升高HDL-C的水平,发挥调血脂作用;升高SOD和GSH-Px活性, 升高GSH水平,降低MDA水平,增强机体的抗氧化能力。
| [1] | Macheret IeL, Khanenko NV. Drug therapy of patients with dyscirculatory encephalopathy[J]. Lik Sprava, 2002(3/4): 84–87. |
| [2] | Lv H, Liu Z, Li X, et al. Effect of lacrimal plugs combined with deproteinized calf blood extract eye gel for filamentary keratitis[J]. J Ocul Biol Dis Infor, 2010, 3(4): 134–140. DOI:10.1007/s12177-011-9066-6 |
| [3] | 李子军, 王洪新, 刘震. 小牛血清去蛋白注射液对糖尿病性周围神经病的症状和神经传导功能的影响[J]. 中国医师进修杂志, 2007, 30(3): 60–61. |
| [4] | 罗邦尧, 荣蓉, 赵明, 等. 小牛血去蛋白提取物注射液治疗2型糖尿病周围神经病变的临床研究[J]. 中国临床医学, 2006, 13(6): 963–964. |
| [5] | 北华大学. 小牛血去蛋白提取物及制备工艺[P]. 中国医药技术领域, 201210434370. 7. 2013-02-06. |
| [6] | 王力, 袁玫, 耿洁, 等. 小牛血去蛋白注射液治疗糖尿病性周围神经病变的临床效果[J]. 实用医药杂志, 2004, 21(3): 231. |
| [7] | 倪伟建, 丁海华, 唐丽琴, 等. 小檗碱对糖尿病肾病大鼠肾组织VEGF表达的影响[J]. 中国药理学通报, 2015, 31(6): 795–800. |
| [8] | 李敏州, 高彦彬, 马鸣飞, 等. 糖尿病肾病发病机制研究进展[J]. 中国实验方剂学杂志, 2012, 18(32): 344–349. |
| [9] | 俞翔, 陈敏. 中医药治疗糖尿病肾病的研究进展[J]. 现代中西医结合杂志, 2016, 25(25): 2847–2850. |
| [10] | 吴伟, 朱章志, 李红, 等. 葛根素治疗早期2型糖尿病肾病的Meta分析[J]. 中成药, 2013, 35(7): 1399–1406. |
| [11] | Brenner BM, Cooper ME, de Zeeuw D. Effects of losartan on renal and cardiovascular outcomes in patients with type 2 diabetes and neuropathy[J]. N Engl J Med, 2011, 345: 861–869. |
| [12] | 任淑萍. 小牛血清去蛋白注射液与小牛血去蛋白注射液有效成分含量和生物活性的比较[J]. 中华神经医学杂志, 2006, 5(8): 767–769. |
| [13] | 周丽敏, 于佳玥, 林富林, 等. 小牛血去蛋白提取物对小鼠能量代谢的影响[J]. 东南国防医药, 2010, 12(2): 104–106. |
| [14] | Wang L, Chopp M, Szalad A, et al. Sildenafil ameliorates long term peripheral neuropathy in type Ⅱ diabetic mice[J]. PLoS One, 2015, 10(2): e0118134. DOI:10.1371/journal.pone.0118134 |
| [15] | Schuelert N, Gorodetskaya N, Just S, et al. Electrophysiological characterization of spinal neurons in different models of diabetes type 1-and type 2-induced neuropathy in rats[J]. Neuroscience, 2015, 291C: 146–154. |
| [16] | 李峥, 王灿, 宋丹青, 等. 小檗碱类似物Y53在STZ诱导的糖尿病C57BL/6J小鼠中抗糖尿病肾病的作用研究[J]. 中国药理学通报, 2016, 32(9): 1236–1241, 1242. |
 2017, Vol. 43
2017, Vol. 43


