扩展功能
文章信息
- 王迦南, 冯辉, 王倩, 何悦铭, 宋艳秋, 朱继红
- WANG Jianan, FENG Hui, WANG Qian, HE Yueming, SONG Yanqiu, ZHU Jihong
- 自然杀伤细胞联合他莫昔芬对乳腺癌细胞的杀伤作用及其机制
- Killer effect of natural killer cells combined with tamoxifen on breast cancer cells in vitro and its mechanism
- 吉林大学学报(医学版), 2017, 43(02): 281-287
- Journal of Jilin University (Medicine Edition), 2017, 43(02): 281-287
- 10.13481/j.1671-587x.20170214
-
文章历史
- 收稿日期: 2016-07-14
2. 吉林大学第一医院生殖中心, 吉林 长春 130021
2. Reproductive Medicine Center, First Hospital, Jilin University, Changchun 130021, China
美国癌症学会的统计结果[1]显示:每年约有120万女性被新诊断为乳腺癌, 其发病率居女性所有恶性肿瘤的首位, 死亡率也在逐年升高, 全世界每年有近50万名患者死于乳腺癌。大约10%乳腺癌患者为ER/PR+ HER-2+,70%为ER/PR+ HER-2-,仅7%为ER/PR-HER-2+,而其余13%由于癌细胞表面无任何受体被称为三阴性乳腺癌[2]。由此可见,超过70%的乳腺癌患者为激素受体阳性,其通常有一个更有利的临床行为、预后以及复发模式,因此能够从内分泌治疗中获益[3]。他莫昔芬 (tamoxifen, TAM) 主要通过与体内的雌激素竞争乳腺癌细胞 (breast cancer cells,BCC) 的雌激素受体 (estrogen receptor,ER) 而达到抑制肿瘤细胞生长的目的[4]。TAM于1971年被首次应用于临床,1978年又经美国FDA批准应用,尽管这期间有新药不断问世,但由于其疗效肯定且经济,已被美国国家癌症网络 (National Comprehensive Cancer Network,NCCN) 指南推荐为用于绝经前乳腺癌患者辅助性内分泌治疗的药物[5]。自然杀伤细胞 (natural killer cells,NK细胞) 作为先天性免疫系统的重要组成部分,是机体抗肿瘤、抗感染及清除非己细胞的第1道防线。NK细胞发挥作用不需要肿瘤特异性抗原识别,能够直接杀伤肿瘤细胞,进而发挥抗肿瘤作用。本研究为系列实验的一部分,前期的相关实验[6-8]已经证实NK细胞联合表阿霉素及曲妥珠单抗体外均能够协同杀伤乳腺癌细胞,而NK细胞与TAM是否存在协同作用尚未见文献报道。本研究观察NK细胞与TAM联合对BCC是否存在协同杀伤作用,并初步探讨其作用机制。
1 材料与方法 1.1 细胞培养人乳腺癌细胞系和NK细胞来自吉林大学第一医院肿瘤中心实验室,选用受体表达情况不同的3种乳腺癌细胞系,即ER+、PR+、HER-2-乳腺癌细胞系MCF-7,ER+、PR+、HER-2+乳腺癌细胞系BT-474,ER-、PR-、HER-2-乳腺癌细胞系MDA-MB-231。BCC贴壁培养于含10%胎牛血清的DMEM-F12高糖培养液中,置于5%CO2饱和湿度的37℃培养箱中;当细胞生长密度达75%时传代1次,取对数生长期细胞用于实验。NK细胞取培养至第14天的细胞用于实验。
1.2 主要药物和试剂TAM (美国Sigma公司),以DMSO溶解配制成浓度40 mmol·L-1的母液,并分装避光保存于-20℃冰箱。钙黄绿素-AM染色液 (上海东仁化学科技有限公司),以DMSO溶解成浓度1 mmol·L-1的母液,分装避光保存于-20℃冰箱; 肿瘤坏死因子α(tumor necrosis factor-α, TNF-α) 和干扰素γ(interferon-γ, IFN-γ) ELISA试剂盒 (武汉博士的生物有限公司),4℃冰箱避光保存; 流式抗体 (BD Pharmingen及R & D system),4℃冰箱避光保存。
1.3 实验分组和设计MTT法检测分组:设置空白对照组和各浓度/时间梯度实验组 (终浓度分别为1.25、2.50、5.00、10.00和20.00 μmol·L-1,作用时间分别为8、16、24和48 h)。取对数生长的3种BCC接种于96孔板,贴壁后实验组分别加相应浓度梯度TAM,空白对照组则加入等体积培养液。培养相应时间后,每孔加入MTT 20 μL,继续培养4 h后吸取MTT,每孔加入DMSO溶液150 μL,自动酶标仪于570 nm波长处检测各组吸光度 (A) 值, 计算细胞增殖抑制率。每组设置6个复孔,重复3次。细胞增殖抑制率=[1-(实验组A值-空白对照组A值)/空白对照组A值]×100%。
钙黄绿素-AM释放法检测分组:共5组,即自然释放组 (空白对照)、最大释放组 (加Triton-X100)、TAM组 (终浓度5 μmol·L-1)、NK细胞组和联合实验组 (BCC+NK细胞+TAM),其中联合组有3种不同效靶比,即3:1、10:1和30:1。BCC经钙黄绿素-AM染色液染色后,接种于96孔板中,根据上述分组加入TAM和NK细胞,培养箱中共培养4h后,离心吸取每孔100μL细胞上清置于另一块新96孔板中,自动酶标仪检测各孔A值,计算细胞杀伤率。每组设置6个复孔,重复3次。细胞杀伤率=[(实验组A值-自然释放组A值)/(最大释放组A值-自然释放组A值)]×100%。
ELISA检测分组:共4组,即空白对照组 (NK细胞)、NK细胞+TAM组、NK细胞+BCC组、联合实验组 (BCC+NK细胞+TAM),其中效靶比为1:1,TAM终浓度为5 μmol·L-1。取对数生长的靶细胞接种于96孔板,相应组加入终浓度5 μmol·L-1的TAM和NK细胞,共培养24h后,离心收集上清行ELISA检测。实验步骤按照ELISA试剂盒说明书操作,每次实验均做出标准曲线,计算每组对应细胞因子浓度。
流式细胞术检测分组:由于抑制性受体和活化性受体表达于NK细胞表面,所以实验分为空白对照组 (NK细胞)、NK细胞+TAM组、NK细胞+BCC组和联合实验组 (NK细胞+BCC+TAM);活化性配体则表达于乳腺癌细胞表面,所以实验分为空白对照组 (BCC)、BCC+TAM组、BCC+NK组和联合实验组 (BCC+NK细胞+TAM)。将细胞接种于6孔板中,效靶比为1:1,TAM终浓度为5 μmol·L-1,培养24 h后,收集细胞行流式抗体染色,上机检测。每组均设置6个复孔,重复3次。实验结果使用Flowjo 7.6.1软件处理后进行统计分析。
1.4 统计学分析采用SPSS 17.0统计软件进行统计学分析。各组实验数据以x±s表示,组间比较采用t检验,多组间比较采用方差分析,组内两两比较采用Dunnett-t检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 各组BCC增殖抑制率TAM在低浓度时对3种细胞的抑制作用比较弱,当浓度≥5 μmol·L-1时,增殖抑制作用明显增加, 并且细胞系间差异也明显增大。20 μmol·L-1TAM作用24 h后,MCF-7细胞增殖抑制率为 (54.73±2.47)%,BT-474细胞增殖抑制率为 (50.83±1.57)%,MDA-MB-231细胞增殖抑制率为 (26.26±1.58)%。不同浓度TAM作用不同时间后,3种BCC的增殖抑制率明显升高,具有时间和浓度依赖性 (P < 0.05)。见图 1。
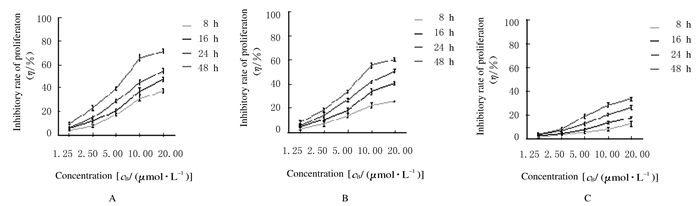
|
| A:MCF-7;B:BT-474;C:MDA-MB-231. 图 1 不同浓度TAM作用不同时间后3种BCC的增殖抑制率 Figure 1 Inhibitory rates of proliferation of three kinds of BCC after trated with different concentrations of TAM for different time |
|
|
实验中选择TAM终浓度5 μmol·L-1作为最终作用浓度。随着效靶比的增加,NK组较TAM组BCC杀伤率明显升高,差异具有统计学意义 (P < 0.01);且NK细胞与TAM联合组BCC杀伤率均明显高于NK细胞组和TAM组 (P < 0.01)。见表 1。
| (x±s, η/%) | |||
| Group | Different target BCC | ||
| MCF-7 | BT-474 | MDA-MB-231 | |
| TAM | 6.92±3.22 | 4.22±0.67 | 2.12±1.45 |
| 3:1 NK | 20.67±1.99* | 14.09±2.40* | 6.17±3.86* |
| 3:1 NK+TAM | 27.03±3.83** | 17.86±1.40** | 13.31±1.57* |
| 10:1 NK | 30.69±2.76** | 24.79±0.99** | 15.20±4.35* |
| 10:1 NK+TAM | 43.27±3.95** | 37.16±3.19** | 21.83±1.77** |
| 30:1 NK | 62.93±1.88** | 44.36±3.03** | 29.26±3.50** |
| 30:1 NK+TAM | 72.77±2.39** | 56.93±1.61** | 39.57±3.45** |
| * P < 0.05, ** P < 0.01 vs TAM group | |||
ELISA检测结果:与空白对照组比较,各实验组无论有无BCC存在,NK细胞中TNF-α和IFN-γ水平均不同程度升高 (P < 0.05或P < 0.01);并且与TAM联合后,TNF-α和IFN-γ水平明显升高,组间比较差异具有统计学意义 (P < 0.01)。见表 2。
| [x±s,ρB/(ng·L-1)] | ||
| Group | IFN-γ | TNF-α |
| Blank control (NK) | 72.33±3.17 | 44.55±3.75 |
| NK+TAM | 104.68±4.26△ | 63.29±1.61△ |
| NK+MCF-7 | 90.97±5.23** | 67.99±3.93** |
| NK+TAM+MCF-7 | 220.90±10.88△ | 128.53±6.06△ |
| NK+BT-474 | 88.25±4.92* | 59.95±2.69** |
| NK+TAM+BT-474 | 187.70±6.04△ | 84.40±6.89△ |
| NK+MDA-MB-231 | 81.65±3.18* | 51.81±3.59* |
| NK+TAM+MDA-MB-231 | 108.74±6.83△ | 72.15±4.91△ |
| * P < 0.05, ** P < 0.01 vs blank control group;△P < 0.01 vs corresponding NK groups. | ||
与空白对照组比较,NK细胞+TAM组、NK细胞+BCC组和联合实验组NK细胞中NKp46表达水平均升高,组间比较差异有统计学意义 (P < 0.05)。见图 2。
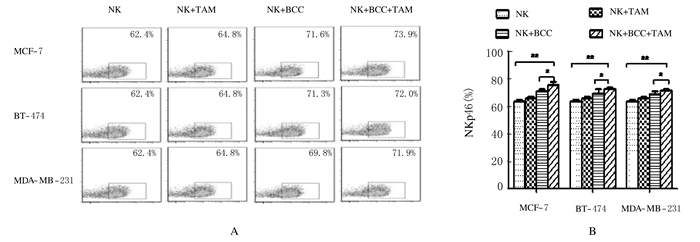
|
| 图 2 各组NK细胞中活化性受体NKp46表达流式细胞图 (A) 和条形图 (B) Figure 2 Flow cytometry figure (A) and histogram (B) of expressions of activating receptor NKp46 in NK cells in various groups |
|
|
与BCC组比较,各联合实验组BCC中MICA和ULBP1表达水平均明显升高 (P < 0.05或P < 0.01),而ULBP2升高程度相对较小,但组间比较差异仍有统计学意义 (P < 0.05或P < 0.01)。见图 3。
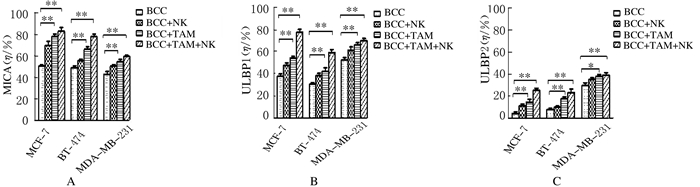
|
| A:MICA; B:ULBP1;C:ULBP2.*P < 0.05, **P < 0.01 vs BCC group. 图 3 各组BCC中活化性配体表达水平 Figure 3 Expression levels of activating ligands in BCC in various groups |
|
|
与空白对照组比较,NK细胞+TAM组NK细胞中D158a、CD158b、CD158b2和CD158e表达水平下降,组间比较差异有统计学意义 (P < 0.05或P < 0.01);与空白对照组比较,各联合实验组抑制性受体表达水平均明显下降 (P < 0.01)。见表 3。
| (x±s) | ||||
| Group | Expression level of inhibitory receptor | |||
| CD158a | CD158b | CD158b2 | CD158e | |
| Blank control (NK) | 9.19±0.27 | 38.83±2.59 | 43.22±1.16 | 9.12±0.93 |
| NK+TAM | 7.88±0.12** | 34.48±1.07* | 40.23±2.19* | 8.06±0.99* |
| NK+MCF-7 | 7.14±0.06 | 25.96±1.92 | 33.18±3.18 | 6.72±0.18 |
| NK+TAM+MCF-7 | 5.37±0.21** | 22.69±2.32** | 28.77±3.21** | 6.39±0.28** |
| NK+BT-474 | 7.69±0.16 | 27.45±0.64 | 32.33±2.02 | 7.39±0.60 |
| NK+TAM+BT-474 | 6.13±0.07** | 24.31±1.22** | 31.44±2.12** | 6.63±0.24** |
| NK+MD-MBA-231 | 7.82±0.13 | 34.23±0.98 | 39.91±1.85 | 7.82±0.88 |
| NK+TAM+MD-MBA-231 | 7.12±0.50** | 32.33±2.33** | 38.97±1.60** | 7.41±0.15s** |
| *P < 0.05, ** P < 0.01 vs blank control group | ||||
乳腺癌被认为是目前全球女性最常见的恶性肿瘤之一, 也是发展中国家居首位死亡原因的恶性肿瘤, 严重影响着女性的健康[5]。TAM作为一种选择性雌激素受体调节剂 (selective estrogen receptor molecular,SERM), 是激素受体阳性乳腺癌患者内分泌治疗的首选药物[9]。TAM不仅能够改善患者预后及延长生存期,而且由于其副作用相对较轻、费用较低等优势,使其被广泛应用于各期乳腺癌的治疗及乳腺癌高危人群的预防[10]。TAM作用机制主要是通过与ER竞争性结合形成稳定的复合物,阻断雌激素与受体结合,进而阻断雌激素的生物学效应,从而抑制肿瘤细胞的增殖,使肿瘤细胞停滞于G1期,减少S期细胞比例[4]。
本研究结果显示:TAM对ER+及ER-BCC均有不同程度的生长抑制作用,并且存在明显的时间及浓度依赖性。上述结果与Samali等[11]研究结果相一致,TAM能够诱导BCC凋亡, 较小剂量时就能诱导ER+细胞凋亡,而诱导ER-细胞的凋亡则需要较大剂量。随着浓度增加及作用时间的延长,TAM对3种BCC的抑制作用也相对增强。在相同浓度TAM作用下,ER+BCC的抑制作用远远强于ER-细胞。且2种ER+的细胞系对TAM的敏感性也存在差异,这可能由于HER-2通路与雌激素通路存在相互影响有关[12]。大量临床试验[13-15]也已证实:无论早期或者晚期乳腺癌患者的内分泌治疗,激素受体阳性伴HER-2+相较于伴HER-2-患者存在治疗抵抗。这在一定程度上也说明:HER-2的表达影响乳腺癌内分泌治疗的预后。
最近几年随着分子生物学及免疫学的发展,生物免疫治疗已经越来越受到人们的关注。免疫治疗也被陆续应用于肿瘤的治疗中,其中研究较多的为NK细胞。特别是NK细胞新受体的发现, 使得对其研究重新成为热点, 既往研究[16-18]显示:NK细胞的活化主要是活化性受体和抑制性受体双重作用的结果。NK细胞作为人体免疫细胞之一,其不同于B细胞及T细胞,不需要体细胞基因重组产生高度特异受体而能够直接识别靶细胞。成熟的NK细胞中储备了大量富含穿孔素及颗粒酶的细胞毒颗粒,同时还储备了大量在受到刺激时能够翻译INF-γ的信使RNA[19]。闫振北等[20]发现:在人体内TAM能够促进白细胞介素2(interleukin-2, IL-2) 的生成,提高一些机体免疫细胞 (如NK细胞、巨噬细胞等) 的细胞毒作用,进而诱导癌细胞凋亡。与此同时,一些临床研究[21]也肯定了IL-2激活的免疫细胞的治疗作用,研究者给转移癌患者输入IL-2激活的NK细胞或输入在体外经过扩增的自身或供者来源的NK细胞, 能够达到治疗肿瘤的目的。
前期实验[6-8]已经证实:NK细胞联合表阿霉素及曲妥珠单抗体外均能够协同杀伤BCC。本研究为了探讨NK细胞与TAM联合对BCC的杀伤是否存在协同作用,采用钙黄绿素-AM释放法检测,结果显示:在TAM浓度为5 μmol·L-1时,随着效靶比的增加,NK组与TAM组比较杀伤率明显升高; 并且各联合组的杀伤率均明显高于NK组及单用TAM组,说明两者存在协同杀伤作用。两者协同作用机制:第一,在有或无靶细胞存在的情况下,TAM均能够增加NK细胞分泌TNF-α和IFN-γ水平。与空白对照组比较,各实验组无论有无BCC存在,NK细胞分泌2种细胞因子的水平均存在不同程度升高,联合TAM组TNF-α和IFN-γ水平明显升高。TAM作用后TNF-α水平升高程度大于IFN-γ。研究者[22-23]发现:IFN-γ与TAM联合作用时对ER+的BCC和ER-的BCC均具有协同抗增殖作用, 而且IFN-γ能增强TAM的抗肿瘤作用,其作用机制是通过影响细胞周期和诱导细胞凋亡。第二,在联合作用下,TAM能够明显上调NK细胞表达活化性受体NKp46及BCC表达NK细胞活化性配体MICA、ULBP1和ULBP2的水平,同时下调NK细胞表达抑制性受体CD158a、CD158b、CD158b2和CD158e的水平。与NK细胞组比较,联合实验组NK细胞活化性受体NKp46的表达水平升高,且各联合实验组BCC中MICA、ULBP1和ULBP2表达水平较NK组明显升高;且在3种乳腺癌细胞系中,MCF-7及BT-474增加程度明显大于MDA-MB-231。与空白对照组比较,NK细胞+TAM组NK细胞中抑制性受体表达水平下降;与空白对照组比较各联合实验组抑制性受体表达水平均明显降低。
综上所述,本文作者推测TAM作用后刺激NK细胞分泌更多TNF-α和IFN-γ,同时增加NK细胞活化性受配体并降低其抑制性受体的表达水平,进而使得NK细胞活化性受体与活化性配体结合增多,活化信号增强,使其活化增多,最终增强其对人BCC的杀伤能力。
| [1] | Igene H. Global health inequalities and breast cancer:an impending public health problem for developing countries[J]. Breast J, 2008, 14(5): 428–434. DOI:10.1111/tbj.2008.14.issue-5 |
| [2] | Onitilo AA, Engel JM, Greenlee RT. Breast cancer subtypes based on ER/PR and Her2 expression:comparison of clinicopathologic features and survival[J]. Clin Med Res, 2009, 7(1/2): 4–13. |
| [3] | Milani A, Geuna E, Mittica G, et al. Overcoming endoccrine resistance in metastatic breast cancer:Current evidence and future directions[J]. World J Clin Oncol, 2014, 5(5): 990–1001. DOI:10.5306/wjco.v5.i5.990 |
| [4] | Patel RR, Sharma CG, Jordan VC. Optimizing the antihormonal treatment and prevention of breast cancer[J]. Breast Cancer, 2007, 14(2): 113–122. DOI:10.2325/jbcs.966 |
| [5] | 张厚云, 赵凌云. 乳腺癌内分泌治疗研究进展[J]. 中国普通外科杂志, 2014, 23(5): 680–684. |
| [6] | 朱歌. 曲妥珠单抗联合NK细胞对乳腺癌细胞体外杀伤作用的实验研究[D]. 长春: 吉林大学, 2014. |
| [7] | 董营. 表柔比星序贯NK细胞体外杀伤乳腺癌细胞的研究[D]. 长春: 吉林大学, 2015. |
| [8] | Feng H, Dong Y, Wu J, et al. Epirubicin pretreatment enhances NK cell-mediated cytotoxicity against breast cancer cells in vitro[J]. Am J Translat Res, 2016, 8(2): 473. |
| [9] | Jemal A, Bray F, Center MM, et al. Global cancer statistics[J]. CA Cancer J Clin, 2011, 61(2): 69–90. DOI:10.3322/caac.v61:2 |
| [10] | Pagani O, Regan MM, Francis PA. Are SOFT and TEXT results practice changing and how?[J]. Breast, 2016, 27: 122–125. DOI:10.1016/j.breast.2016.02.008 |
| [11] | Salami S, Karami-Tehrani F. Biochemical studies of apoptosis induced by tamoxifen in estrogen receptor positive and negative breast cancer cell lines[J]. Clin Biochem, 2003, 36(4): 247–253. DOI:10.1016/S0009-9120(03)00007-9 |
| [12] | Metah A, Tripathy D. Co-targeting estrogen receptor and HER2 pathways in breast cancer[J]. Breast, 2014, 23(1): 2–9. DOI:10.1016/j.breast.2013.09.006 |
| [13] | Musgrove EA, Sutherland RL. Biological determinants of endocrine resistance in breast cancer[J]. Nat Rev Cancer, 2009, 9(9): 631–643. DOI:10.1038/nrc2713 |
| [14] | Ellis MJ, Coop A, Singh B, et al. Letrozole is more effective neoadjuvant endocrine therapy than tamoxifen for ErbB-1-and/or ErbB-2-positive, estrogen receptor-positive primary breast cancer:evidence from a phase Ⅲ randomized trial[J]. J Clin Oncol, 2001, 19(18): 3808–3816. DOI:10.1200/JCO.2001.19.18.3808 |
| [15] | Ellis MJ, Tao Y, Young O, et al. Estrogen-independent proliferation is present in estrogen-receptor HER2-positive primary breast cancer after neoadjuvant letrozole[J]. J Clin Oncol, 2006, 24(19): 3019–3025. DOI:10.1200/JCO.2005.04.3034 |
| [16] | Lanier LL. NK cell recognition[J]. Annu Rev Immunol, 2005, 23: 225–274. DOI:10.1146/annurev.immunol.23.021704.115526 |
| [17] | 王鹏, 李玲, 阚全程, 等. 表达US3基因腺病毒载体下调CTL和NK细胞对其转染肝细胞杀伤活性的影响[J]. 西安交通大学学报:医学版, 2015, 36(5): 655–660. |
| [18] | 吴朝真, 刘放, 李宁. Fractalkine、IP-10及不同信号通路抑制剂对肿瘤微环境中NK细胞的影响[J]. 解放军医学杂志, 2015, 40(7): 547–553. |
| [19] | Wang W, Erbe AK, Hank JA, et al. NK cell-mediated antibody-dependent cellular cytotoxicity in cancer immunotherapy[J]. Front Immunol, 2015, 6: 368. |
| [20] | 闫振北, 韩明强. 雌激素水平影响他莫昔芬抑制乳腺癌细胞生长的机制探讨[J]. 中国医刊, 2008, 43(1): 57–58. |
| [21] | Chang E, Rosenberg SA. Patients with melanoma metastases at cutaneous and subcutaneous sites are highly susceptible to interleukin-2-based therapy[J]. J Immunother, 2001, 24(1): 88–90. DOI:10.1097/00002371-200101000-00010 |
| [22] | 高德宗, 孙靖中, 高华, 等. γ-干扰素增强他莫昔芬抗乳腺癌作用的体外研究[J]. 中国肿瘤生物治疗杂志, 2006, 13(1): 45–49. |
| [23] | 张巧利, 李芬, 吕淑兰, 等. 乳腺密度、性激素补充治疗与乳腺癌的关系[J]. 中国老年学杂志, 2015, 35(17): 5012–5016. |
 2017, Vol. 43
2017, Vol. 43


