扩展功能
文章信息
- 车鸿泽, 车彦海, 卢晴, 陈楠楠, 陈飞, 金权, 马宁
- CHE Hongze, CHE Yanhai, LU Qing, CHEN Nannan, CHEN Fei, JIN Quan, MA Ning
- PLGA涂层处理的nHA-Mg多孔复合材料对兔颌骨缺损的修复作用
- Repair effect of nHA-Mg porous composite materials modified by PLGA on jaw bone defect of rabbits
- 吉林大学学报(医学版), 2017, 43(02): 276-280
- Journal of Jilin University (Medicine Edition), 2017, 43(02): 276-280
- 10.13481/j.1671-587x.20170213
-
文章历史
- 收稿日期: 2017-01-05
口腔颌面部先天性畸形、肿瘤、外伤以及慢性炎症等均会造成颌骨缺损,传统修复主要包括自体、异体骨移植,天然以及合成材料植入等[1],但每种方法均存在相对的不足。1995年Grane等[2]首次系统提出骨组织工程的概念,将骨缺损的修复方法引领到全新的领域,学者们[3-5]通过不断尝试以获得理想的骨修复材料,而发展至今普遍认为骨组织工程的中心环节是能够研制出供给细胞移植和引导骨再生的支架材料[6]。纳米羟基磷灰石 (nano-hydroxyapatite,nHA) 作为理想的植入物,其优越的成骨效果已得到广泛的肯定[7],但nHA在临床中使用常需要与其他材料复合以弥补其强度差的弊端[8]。镁 (Mg) 作为医用植入材料历史悠久,近来研究[9]显示:Mg2+在一定浓度范围内可以激活磷脂酰肌醇3-激酶/蛋白激酶B (PI3K/Akt) 通路,上调磷酸化Akt (p-Akt) 表达,增强细胞活力以及分化水平,从而促进新骨形成。目前,Mg及Mg合金作可降解支架材料受到国内外学者的广泛关注[10]。Liu等[11]将多孔Mg合金植入到兔股骨髁部,发现Mg合金可以起到骨修复的作用,并且产生的少量气体对周围组织基本无影响。本实验中将nHA与Mg两者复合,尚未见相关文献报道。nHA可以提高复合材料的成骨作用,Mg可以增加材料的机械强度,形成的复合材料应具有较好的空间结构、材料硬度和成骨效果。而表面采用聚乳酸-羟基乙酸共聚物 (poly lactic acid/glycolic acid, PLGA) 修饰可以减缓Mg的降解速率,本实验将复合材料植入到下颌骨缺损的动物模型中,观察其对骨修复的作用,为复合材料的进一步研究提供实验依据。
1 材料与方法 1.1 实验动物、主要试剂和仪器日本大耳白兔18只,体质量2.0~2.5kg,月龄3个月,延边大学动物实验中心提供,动物合格证号:SCXK (吉)2011-0006。nHA-Mg多孔复合材料、表面经PLGA处理的nHA-Mg多孔复合材料 (吉林大学口腔医院和吉林大学材料科学与工程学院共同研制,方法性能详见参文[12]),10%水合氯醛 (吉林大学公共卫生学院动物实验中心),阿替卡因肾上腺素注射液 (法国碧兰公司),青霉素、甲硝唑、生理盐水和头孢呋辛钠 (海南灵康制药有限公司),组织染色材料 (4%多聚甲醛固定液,15%乙二胺四乙酸)(上海阿拉丁生化科技股份有限公司),各级乙醇、二甲苯、石蜡、苏木素染液和HE染液 (北京索莱宝科技有限公司)。牙科高速涡轮机,常用外科手术器械,DIGORA Optime口内牙片数字成像系统 (SOREDEX公司,芬兰),石蜡切片机 (EXAKT公司,德国),电热恒温培养箱 (南京实验仪器厂,南京),硬组织切磨系统 (EXAKT公司,德国)。
1.2 动物分组和方法从18只白兔中随机选取9只,在左侧下颌骨缺损植入经PLGA处理的nHA-Mg复合材料作为实验组,右侧下颌骨缺损不填加任何材料作为空白对照组;剩余9只左侧下颌骨缺损植入nHA-Mg复合材料作为阳性对照组,右侧同样不填加任何材料作为空白对照组。
称量兔子质量,麻醉剂10%水合氯醛按照3 mL·kg-1耳缘静脉缓慢注射,以呼吸深缓,几乎无角膜反射、趾璞反射为麻醉标准;局部必兰5 mL浸润麻醉。将兔子固定在手术台上,常规备皮、消毒、铺洞巾,沿颏下正中线切开皮肤,钝性分离肌肉层,暴露双侧下颌骨下颌体中部,涡轮手机造成10 mm×5 mm×1 mm骨缺损 (双侧缺损大小、位置相同)。生理盐水配合甲硝唑反复冲洗术区,按照实验分组将材料植入 (材料经过双面紫外线照射灭菌不少于10 h,实验过程严格按照无菌操作进行)。分层严密拉拢缝合,术后5 d每天2次,每次0.1 mL·kg-1青霉素肌注。术后动物恢复良好,无感染、伤口开裂等情况。饲养4、8和12周,每次每组处死3只,截取实验区域下颌骨。
1.3 影像学观察拍摄X线片,观察材料降解程度、与周围骨组织关系及缺损边缘骨组织密度改变。
1.4 组织学观察石蜡切片:4%多聚甲醛固定,20%甲酸和15%乙二胺四乙酸脱钙,各级乙醇脱水、浸蜡、包埋、切片,染色观察;硬组织磨片:固定、各级乙醇脱水、树脂渗透、包埋聚合、切片HE染色观察。
1.5 新生骨小梁面积计量采用IPP (Image-pro plus)6.0病理图像分析软件,对不同时期实验组、阳性对照组和空白对照组的组织切片进行新生骨小梁面积计量,具体方法:在20倍率镜下,选取缺损区域的4个角,4条边的中点和缺损中心,用软件采集计量区域内新生骨小梁面积,并计算所占区域总面积百分比,取9个区域百分比的平均值。
1.6 统计学分析采用SPSS 17.0统计软件进行统计学分析。各组兔子新生骨小梁面积百分比以x±s表示,组间比较采用t检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 各组新生骨小梁面积组织切片20倍镜下可见:在同一时间点实验组新生骨小梁面积所占百分比大于阳性对照组和空白对照组 (P > 0.05),而阳性对照组和空白对照组比较差异无统计学意义 (P > 0.05)。见表 1。
| (n=9, x±s, η/%) | |||
| Group | Percentage of area of newborn trabecula | ||
| (week)4 | 8 | 12 | |
| Positive control | 5.20±1.11 | 13.21±1.02 | 16.67±1.19 |
| Blank control | 3.62±0.97 | 12.22±0.75 | 15.10±0.98 |
| Experimental | 8.41±1.05*△ | 17.68±1.2*△ | 20.22±1.01*△ |
| *P < 0.05 compared with positive control group;△P < 0.05 compared with blank control group | |||
X线片显示:4周时实验组与阳性对照组无明显差异,材料与缺损处骨组织间隙模糊。而空白对照组缺损处边缘密度略有减低;8周时实验组材料少部分分解,体积与植入时相差不大,呈毛玻璃样阻射影,部分与缺损处骨组织融合。阳性对照组材料大部分分解,与周围骨组织间隙清晰,呈碎片状。空白对照组骨边缘有明显密度减低、骨高度下降现象。见图 1。12周时实验组材料大部分分解,只可见少量絮状阻射影,与周围骨组织融合,间隙消失,可见新生骨的骨纹理。阳性对照组材料剩余少部分并且密度减低,与骨组织间隙清晰,成骨不理想。见图 2。
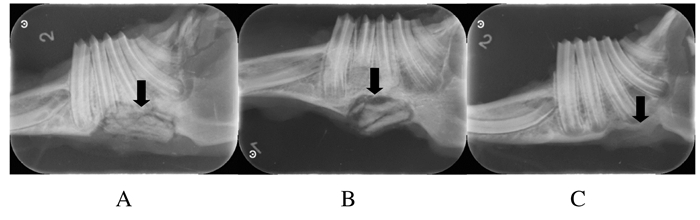
|
| A:Experimental group; B:Positive control group; C:Blank control group. 图 1 各组兔下颌骨缺损植入材料术后8周X线表现 Figure 1 X-ray appearance of jaw bone defect of rabbits 8 weeks after implantation in various groups |
|
|
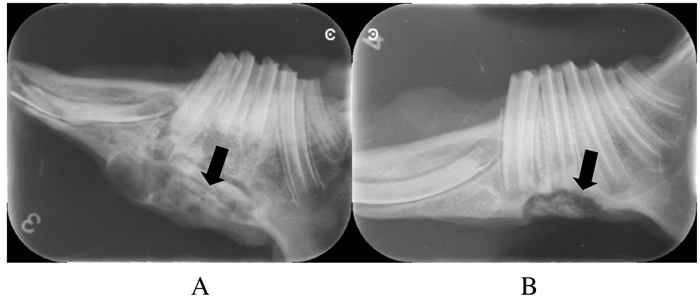
|
| A:Experimental group; B:Positive control group. 图 2 各组兔下颌骨植入材料术后12周X线表现 Figure 2 X-ray appearance of jaw bone defect of rabbits 12 weeks after implantation in various groups |
|
|
石蜡切片:术后4周实验组和阳性对照组可见缺损空间维持良好,未见结缔组织长入缺损区。而空白对照组缺损区有纤维肉芽组织覆盖。术后8周, 实验组可见有血管组织以及形状不规则、边缘不整齐的新生骨小梁,排列的成骨细胞聚集在新生骨小梁周围,大量骨陷窝位于骨小梁中,陷窝中包含骨细胞;与术后8周比较,12周时新生骨小梁增粗,排列更致密,有改建为板层骨趋势。见图 3(插页三)。
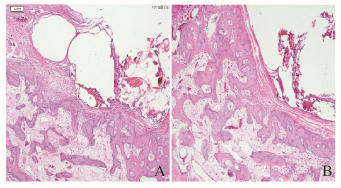
|
| A:8 weeks; B:12 weeks. 图 3 兔下颌骨植入材料术后实验组组织学观察 (HE, ×40) Figure 3 Histological observation of jaw bone of rabbits in experimental group after implantation (HE, ×40) |
|
|
硬组织磨片:术后8周实验组和阳性对照组材料均有降解,并且缺损区可见骨基质和编织骨成分,经过计量对比发现:实验组材料剩余量与形成骨基质量多于阳性对照组。见图 4(插页四) 和表 2。
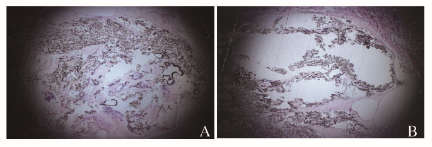
|
| A:Experimental group; B:Positive control group. 图 4 兔下颌骨植入材料术后8周硬组织磨片观察 (HE, ×20) Figure 4 Observation of hard tissue section of jaw bone of rabbits in experimental group 8 weeks after implantation (HE, ×20) |
|
|
| (n=9, η/%) | ||
| Group | Materials | Bone matrix |
| Positive control | 11.63 | 9.42 |
| Experimental | 29.82 | 31.16 |
口腔颌骨缺损理想的修复方法是自体骨移植,然而在自体骨不能满足需要时,负载细胞的支架材料被认为是骨移植的金标准[13]。理想的支架需要满足诸多条件,比如材料应具有良好的生物相容性、其表面应允许种子细胞的定植与生长、材料应具有适宜的机械强度和一定的孔隙率、材料在体内最终可降解消除等[14-15]。
羟基磷灰石又称碱式磷酸钙,是人体骨骼中主要成分,约占骨骼质量的60%~70%。人工合成的纳米级羟基磷灰石已经推广进入临床。Webster等[16]发现纳米级羟基磷灰石更能促进新骨形成。然而单一组分的nHA机械性能较差,负荷能力有限,与其他天然或是高分子材料复合能改善这一缺点。Mg是人体必需的微量元素之一,骨组织内Mg含量占人体总含量的50%~60%,研究[17-18]显示:适量Mg2+能够促进成骨细胞的增殖和分化,并且过量的Mg2+也均能排出体外,然而其成骨机制还未十分明确。PI3K/Akt信号通路广泛参与细胞的增殖、分化、凋亡以及迁移,对成骨细胞和破骨细胞同样具有调控作用[19-20],近来研究[9]显示:Mg2+在一定浓度范围内可以激活PI3K/Akt通路,上调磷酸化Akt的表达水平,增强成骨细胞活性和分化能力,从而达到促进成骨的作用。但Mg在体内降解速率较快,对Mg的控制曾一度成为难题,目前研究方向主要分开发新型Mg合金和表明涂层处理,研究[21]显示:PLGA涂层处理Mg合金可以延缓腐蚀速率,维持材料存留时间。
本系列研究的前期实验[12]中将nHA、Mg和碳酸氢铵按一定比例通过粉末冶金法复合,获得的nHA-Mg平均孔隙率达50%,孔径为50~120μm,具有良好的空间结构,表明采用PLGA涂层可以提高材料的耐腐蚀性。体外实验[22]发现:材料及其降解产物无细胞毒性,并且人骨肉瘤 (MG-63) 细胞在材料表面生长良好,同时材料对BMP-2蛋白的表达有促进作用,表明材料生物相容性和成骨分化良好。前期实验[12]结果说明:nHA-Mg复合材料不仅可以发挥出促进成骨的优势,同时增强了一定的机械强度,并且经过PLGA处理可以控制材料在体内存留的时间。
本实验分别从新生骨小梁面积、影像学和组织学3个方面对实验组、阳性对照组和空白对照组进行比较。新生骨小梁面积计量结果显示:实验组材料明显高于阳性对照组和空白对照组,表明实验组材料对骨形成的促进作用更显著;影像学结果显示:实验组材料最终可以与骨组织完全融合,而阳性对照组材料早期崩解,与骨组织分离, 表明实验组材料可以与骨组织结合修复缺损,并且有利于维持缺损区的空间,防止骨塌陷;组织学结果显示:实验组可见新生的骨小梁、成骨细胞和小血管等成分。随时间推移,骨小梁向成熟骨组织转变,即形成板层骨,表明成骨活跃,有新生骨组织形成。硬组织磨片结果显示:材料部分消失,并且实验组材料剩余量明显多于阳性对照组,表明材料在体内可降解,并且实验组材料降解速率低于阳性对照组。以上结果说明经PLGA涂层的多孔复合材料能够维持骨缺损空间,具有引导骨组织再生和促进骨组织修复的作用;而阳性对照组材料与空白对照组早期虽有不同,但后期成骨效果相差不大。可能是由于未经PLGA涂层处理的复合材料中Mg的降解速率较快,导致材料快速崩解,不能维持缺损空间,也不能与周围骨组织融合,最终成骨效果不理想。
与阳性对照组和空白对照组比较,PLGA表面处理的nHA-Mg多孔复合材料对颌骨缺损重建的促进作用明显,并且基本满足支架材料所应具备的诸多条件,有望作为优秀的骨替代材料,然而理想的组织工程支架材料还需要负载具有促进成骨作用的细胞因子,因此本研究中复合材料负载细胞因子方面需要进一步探讨。
| [1] | 卢晓蕾. 颌骨缺损修复方法的进展[J]. 黑龙江医药科学, 2012, 35(2): 89–90. |
| [2] | Crane GM, Ishaug SL, Mikos AG. Bone tissue engineering[J]. Nat Med, 1995, 1(12): 1322–1324. DOI:10.1038/nm1295-1322 |
| [3] | Venkatesan J, Kim SK. Nano-hydroxyapatite composite biomaterials for bone tissue engineering-a review[J]. Biomed Nanotechnol, 2014, 10(10): 3124–3140. DOI:10.1166/jbn.2014.1893 |
| [4] | 傅婷, 谷子芽, 李颖, 等. 纳米羟基磷灰石复合物在骨组织工程中的应用与挑战[J]. 医学研究杂志, 2016, 45(2): 153–155. |
| [5] | 朱阳, 李道伟, 方滕姣子, 等. 载EPO腺病毒的PLGA纳米纤维支架在体内促进骨缺损修复作用[J]. 吉林大学学报:医学版, 2015, 41(4): 711–715. |
| [6] | 袁景, 甄平. 骨组织工程支架的研究进展[J]. 医学综述, 2015, 21(12): 2126–2130. |
| [7] | 杨再清, 雷云坤, 孟增东. 纳米羟基磷灰石在骨科中的临床应用及作用机制[J]. 中国组织工程研究, 2012, 16(51): 9629–9634. |
| [8] | Tsao YP, Neiva R, Al-Shammari K, et al. Factors influencing treatment outcomes in mandibular Class Ⅱ furcation defects[J]. J Periodontol, 2006, 77(4): 641–646. DOI:10.1902/jop.2006.050133 |
| [9] | 王健, 马翔宇, 冯亚非, 等. 镁离子对成骨细胞活力和分化的促进作用及其机制研究[J]. 现代生物医学进展, 2015, 15(15): 2836–2839. |
| [10] | 杨俊宇, 徐永清, 何晓清. 镁及镁合金材料作为骨科内植物研究进展[J]. 中国修复重建外科杂志, 2016, 30(12): 1562–1566. |
| [11] | Liu YJ, Yang ZY, Tan LL, et al. An animal experimental study of porous magnesium scaffold degradation and osteogenesis[J]. Braz J Med Biol Res, 2014, 47(8): 715–720. DOI:10.1590/1414-431X20144009 |
| [12] | 何畔, 仲琦, 卢建忠, 等. nHA/Mg/壳聚糖膜复合材料的制备及耐腐蚀性研究[J]. 口腔医学, 2015, 35(6): 433–437. |
| [13] | Ewald A, Hösel D, Patel S, et al. Silver-doped calcium phosphate cements with antimicrobial activity[J]. Acta Biomater, 2011, 7(11): 4064–4070. DOI:10.1016/j.actbio.2011.06.049 |
| [14] | Chen G, Ushida T, Tateishi T. Scaffold design for tissue engineering[J]. Macromol Biosci, 2002, 2(2): 67–77. DOI:10.1002/(ISSN)1616-5195 |
| [15] | O'Brien FJ. Biomaterials & scaffolds for tissue engineering[J]. Material Today, 2011, 14(3): 88–95. DOI:10.1016/S1369-7021(11)70058-X |
| [16] | Webster TJ, Ergun C, Doremus RH, et al. Enhanced functions of osteoblasts on nanophase ceramics[J]. Biomaterials, 2000, 21(17): 1803–1810. DOI:10.1016/S0142-9612(00)00075-2 |
| [17] | Musso CG. Magnesium metabolism in health and disease[J]. Int Urol Nephrop, 2009, 41(2): 357–362. DOI:10.1007/s11255-009-9548-7 |
| [18] | 王树峰, 王程越, 姚玉胜, 等. AZ31镁合金修复兔下颌骨缺损的实验研究[J]. 口腔医学研究, 2013(1): 33–36. |
| [19] | Liang D, Yang M, Guo B, et al. Zinc inhibits H2O2-induced MC3T3-E1 cells apoptosis via MAPK and PI3K/AKT pathways[J]. Biol Trace Elem Res, 2012, 148(3): 420–429. DOI:10.1007/s12011-012-9387-8 |
| [20] | Rangaswami H, Schwappacher R, Tran T, et al. Protein kinase G and focal adhesion kinase converge on Src/Akt/β-catenin signaling module in osteoblast mechanotransduction[J]. J Biol Chem, 2012, 287(25): 21509–21519. DOI:10.1074/jbc.M112.347245 |
| [21] | 赵常利, 张绍翔, 何慈晖, 等. 生物医用镁合金表面PLGA涂层研究[J]. 功能材料, 2008, 39(6): 987–989. |
| [22] | 康文慧. nHA/Mg复合材料经CS及PLGA表面修饰后对MG-63细胞BMP-2蛋白表达的影响[D]. 长春: 吉林大学, 2015. |
 2017, Vol. 43
2017, Vol. 43


