扩展功能
文章信息
- 杨耀群, 谢淑丽, 吕国悦, 马强, 李开良, 王广义
- YANG Yaoqun, XIE Shuli, LYU Guoyue, MA Qiang, LI Kailiang, WANG Guangyi
- 肝癌SMMC7721细胞株P27RF-Rho mRNA基因沉默对5-Fu药物敏感性的影响
- Influence of P27RF-RhO mRNA gene silencing in drug sensitivity of 5-fluorouracil in liver cancer SMMC7721 cell line
- 吉林大学学报(医学版), 2017, 43(02): 271-275
- Journal of Jilin University (Medicine Edition), 2017, 43(02): 271-275
- 10.13481/j.1671-587x.20170212
-
文章历史
- 收稿日期: 2016-08-30
原发性肝细胞肝癌 (肝癌)(hepatic cell carcinoma,HCC) 是外科常见病、多发病,其病死率占恶性肿瘤的第2位,目前手术切除仍是根治肝癌的最佳方法[1]。但是由于肝癌具有极强的侵袭转移等恶性生物学行为,即使获得根治性切除,术后常发生转移及复发[2]。常规化疗,患者预后亦不很满意,因此寻找抑制术后复发转移的方法极其重要。5-氟脲嘧啶 (5-fluorouracil,5-Fu) 作为一种抗癌化疗药物,在肝切除术前术后均有广泛应用。5-Fu是一种常用的抗代谢药物,5-Fu在细胞内转变成5-氟脲嘧啶脱氧核苷酸 (5-FdUMP), 而抑制脱氧胸苷酸合成酶 (TS),阻止脱氧脲苷酸 (dUMP) 甲基转化为脱氧胸苷酸 (dTMP),从而影响DNA合成, 或在体内变成5-氟脲嘧啶核苷 (5-FuR) 以伪代谢物形式掺入RNA, 影响蛋白质的合成[3]。Rho即Ras相似物 (Ras homologue), 与Ras家族同属小G蛋白超家族成员, 主要包括Rho、Rac和cdc42 3个亚家族, 在细胞信号传导中具有重要的功能。目前Rho研究比较广泛的是RhoA和RhoC,两者在肿瘤发生发展过程中起重要作用[4]。5-Fu是一种重要的肝癌化疗药物,但是长期大量使用不良反应较大,并且有效剂量与中毒剂量接近,限制了其使用,因此寻找一种很好的化疗辅助用药显得格外重要[5]。本文作者应用病毒介导肝癌SMMC7721细胞P27RF-Rho基因沉默联合5-Fu,观察P27RF-Rho是否能够增强5-Fu对肝癌的杀伤效果,旨在为临床晚期肝癌的治疗提供理论依据。
1 材料与方法 1.1 细胞、主要试剂和仪器肝癌SMMC7721细胞株由吉林大学第一医院肝胆外科实验室保存,P27RF-Rho RNAi慢病毒及Scramble慢病毒由本实验室谢淑丽老师构建并赠送,各种抗体购于美国Santa Cruz公司。紫外分光光度计 (上海光学仪器厂),CO2孵箱 (日本SANYO公司), Transwell小室 (美国Sigma公司)。
1.2 SMMC7721细胞分组和慢病毒感染实验细胞分为Scramble-siRNA阴性对照组、5-Fu组、P27RF-Rho-siRNA组和P27RF-Rho siRNA+5-Fu组。实验所用SMMC7721细胞用含10%胎牛血清、1%双抗的细胞H-DMEM培养液,于37℃、5%CO2的孵育箱培养。取对数生长期的SMMC7721细胞以每孔4×105细胞接种于6孔板中,待细胞平铺6孔板底面积为80%~90%时,按实验设计的分组分别加入RNAi慢病毒进行细胞感染,待细胞感染36~48 h后观察绿色荧光表达,并进行后续实验。
1.3 Western blotting法检测P27RF-Rho基因沉默效果及肝癌相关蛋白表达水平刮板收集6孔板中细胞于1.5 mL EP管中,加入RIPA裂解液及蛋白酶抑制剂——苯甲基磺酰氟 (phenylmethanesulfonyl fluoride,PMSF),冰上孵育30 min,不断吹打,使细胞裂解彻底。然后置于低温离心机中,4℃、2 000 r·min-1离心30 min,将上清移至1个新的1.5 mL EP管中,用BCA法测定蛋白浓度,并分装。根据蛋白浓度,取相应体积的30 μg蛋白质样品,与5倍稀释的溴酚蓝上样缓冲液4:1混合,沸水浴煮5 min,行12%SDS-PAGE电泳。电泳完毕后,PAGE胶上的目的蛋白用Bio-Rad电转仪移至PVDF膜上。取出聚偏二氟乙烯 (polyvinylidene fluoride,PVDF) 膜用20 mL封闭液 (含5%脱脂奶粉的TBST溶液) 封闭20 min,弃去封闭液,加入一抗 (1:1 000稀释)4℃孵育过夜,取出过夜PVDF膜,20 mL TBST震荡洗膜3次,每次5 min,再加入二抗孵育2 h,TBST洗膜,方法同上。PVDF膜稍干后,将化学发光试剂 (ECL) 均匀涂抹于PVDF膜上表面,作用约1 min后迅速置于暗箱内曝光,曝光1 min后显影并拍照记录,β-actin为内参照。检测各组细胞中RhoC蛋白及P27蛋白表达,并以Image J图像处理软件进行蛋白条带灰度分析,以β-actin灰度值为分母,所测蛋白灰度值为分子,比值越大则相应蛋白表达水平越高。
1.4 MTT法检测各组细胞生长按以上实验分组,以3×104mL-1的细胞浓度接种于96孔板中,每孔接种200 μL细胞悬液,每组设3个复孔。共铺7块板,并置于孵箱中培养,慢病毒感染细胞及加药后24h起,每天随机取出一块板,MTT法检测各孔细胞吸光度 (A) 值, 取各组平均值。连续7d,绘制生长曲线,比较各组间每天的A值。
1.5 划痕实验检测细胞迁移能力胰酶消化各实验组细胞,弃去胰酶,用含10%胎牛血清、1%双抗的细胞H-DMEM培养液将细胞吹打成细胞悬液,细胞计数,于96孔板中按每孔2×104个细胞加入上述细胞悬液,待细胞生长铺满96孔板底表面时,用10 μL移液枪头在孔板底部按从上到下划“一”字形划痕。分别于划痕后0和24h观察不同实验组划痕区细胞的迁移情况,并进行比对和测量。
1.6 体外Transwell小室侵袭实验检测实验细胞侵袭能力铺胶:将Matrigel胶按1:1稀释后,每个小室底部均匀涂布30 μL,室温风干20 min。将上述6孔板中4组细胞用胰酶处理,制成细胞悬液,离心,弃去上清,加1 mL无血清培养液吹打,制备细胞悬液。上述细胞悬液200 μL,以3×105 mL-1的细胞浓度接种到上室中,下室加入500 μL含10%胎牛血清、1%双抗的细胞H-DMEM培养液,37℃、5%CO2条件下培养24 h。用棉签擦去小室上层的细胞及胶,并用无菌PBS冲洗2~3次,4%多聚甲醛固定20 min,0.1%龙胆紫染色30 min,蒸馏水冲洗小室下表面2~3次,风干,每组小室在显微镜下选取5个视野并拍照,计数,取平均值。
1.7 统计学分析应用SPSS13.0统计软件进行统计学分析。各组细胞中P27RF-Rho、P27和RhoC相对表达水平,Transwell细胞穿膜数和生长曲线相应A值以x±s表示;组间样本均数比较采用t检验。以P < 0.05为差异有统计学意义。
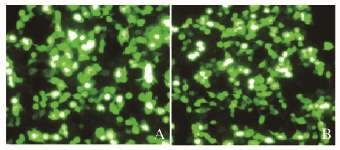
2 结果 2.1 病毒包装后感染SMMC 7721细胞的效果慢病毒感染SMMC7721细胞48h后,荧光显微镜下观察细胞转染效果并拍照,阴性质粒对照Scramble-siRNA组和P27RF-Rho siRNA组细胞出现明显的绿色荧光蛋白表达,病毒转染效果良好。见图 1(插页三)。
|
| A:Scramble RNAi; B:P27RF-Rho RNAi. 图 1 荧光显微镜检测基因沉默效果 Figure 1 Effect of gene silencing detected by fluorescence microscope |
|
|
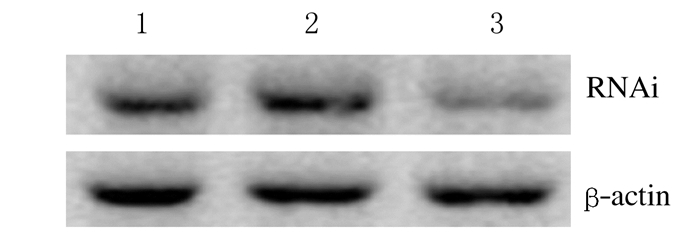
5-Fu组、Scramble-siRNA组和P27RF-Rho-siRNA组P27RF-Rho蛋白表达水平分别为0.879±0.150、0.906±0.120和0.476±0.170,P27RF-Rho-siRNA组P27RF-Rho蛋白表达水平明显低于其他2组,差异有统计学意义 (P < 0.05)。5-Fu组与Scramble-siRNA组P27RF-Rho蛋白表达水平比较差异无统计学意义 (P > 0.05)。见图 2。
|
| Lane 1:5-Fu group; Lane 2:Scramble-siRNA group; Lane 3:P27RF-Rho siRNA group. 图 2 Western blotting法检测基因沉默效果 Figure 2 Gene silencing effect detected by Western blotting method |
|
|
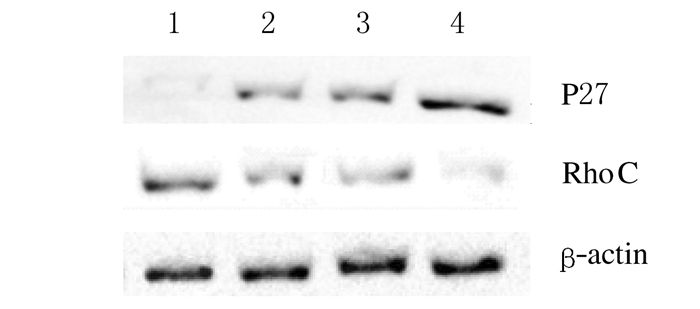
P27RF-Rho siRNA+5-Fu组P27蛋白表达水平 (0.849±0.140) 明显高于5-Fu组、P27RF-Rho siRNA组和Scramble-siRNA组 (0.614±0.130、0.621±0.160和0.340±0.090,P < 0.05)。与5-Fu组、P27RF-Rho siRNA组和Scramble-siRNA组 (0.519±0.230、0.516±0.170和0.818±0.110) 比较,P27RF-Rho siRNA+5-Fu组RhoC蛋白表达水平 (0.206±0.110) 明显降低 (P < 0.05)。5-Fu组与P27RF-Rho siRNA组P27、RhoC蛋白表达水平比较差异无统计学意义 (P > 0.05)。见图 3和表 1。
|
| Lane 1:Scramble-siRNA group; Lane 2: 5-Fu group; Lane 3:P27RF-Rho siRNA group; Lane 4: P27RF-Rho siRNA+5-Fu group. 图 3 各组细胞中P27和RhoC蛋白表达电泳图 Figure 3 Electrophoregram of expressions of P27 and RhoC in cells in various groups |
|
|
| (n=3, x±s) | ||
| Group | P27 | RhoC |
| Scramble-siRNA | 0.34±0.09 | 0.818±0.11 |
| 5-Fu | 0.614±0.13 | 0.519±0.08 |
| P27RF-Rho siRNA | 0.621±0.16 | 0.516±0.12 |
| P27RF-Rho siRNA+5-Fu | 0.849±0.14*△# | 0.206±0.11*△# |
| *P < 0.05 compared with Scramble-siRNA group; △P < 0.05 compared with 5-Fu group; #P < 0.05 compared with P27RF-Rho siRNA group. | ||
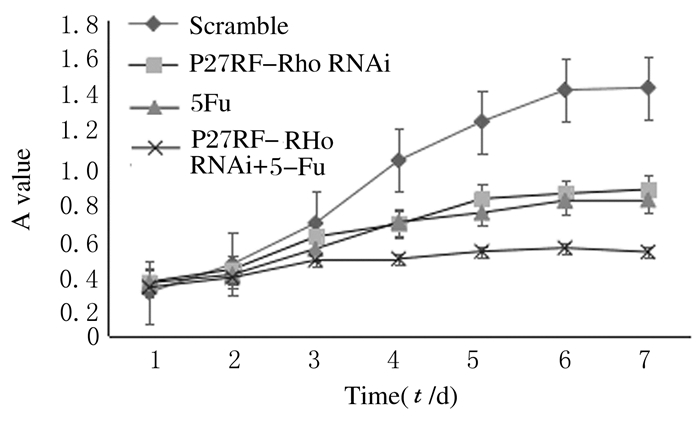
实验前2d,各组细胞生长速度无明显差异; 第3天开始,P27RF-Rho siRNA+5-Fu组细胞生长速度 (0.437±0.070) 逐渐低于5-Fu组、P27RF-Rho siRNA和Scramble-siRNA组; 第4天P27RF-Rho siRNA+5-Fu组细胞生长速度明显低于其他3组 (0.646±0.100、0.634±0.090和0.997±0.050),组间比较差异有统计学意义 (P < 0.05);第5~7天P27RF-Rho siRNA+5-Fu组细胞生长速度明显低于5-Fu组、P27RF-Rho siRNA组和Scramble-siRNA组 (P < 0.05)。见图 4。
|
| 图 4 各组细胞生长曲线 Figure 4 Growth curves of cells in various groups |
|
|
划痕实验中P27RF-Rho siRNA+5-Fu组细胞迁移距离最小,小于5-Fu组、P27RF-Rho siRNA组和Scramble-siRNA组,组间比较差异有统计学意义 (P<0.01)。见图 5(插页三)。
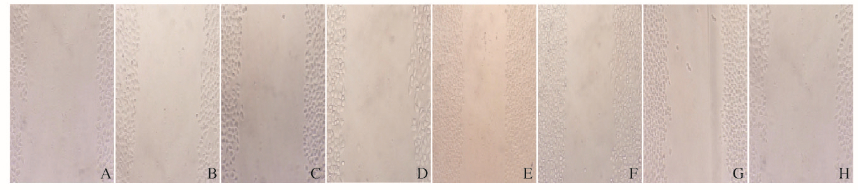
|
| A:Scramble-siRNA group; B:5-Fu group; C:P27RF-Rho siRNA group; D:P27RF-Rho siRNA+5-Fu group. A-D:0 h; E-H:24 h. 图 5 各组细胞划痕距离 Figure 5 Scratching distances of cells in various groups |
|
|
Transwell小室实验显示:P27RF-Rho siRNA+5-Fu联合用药组穿过基底膜的细胞数 (41±4) 明显少于5-Fu组、P27RF-Rho siRNA组和Scramble-siRNA组 (81±6、78±5、127±4),组间比较差异有统计学意义 (P < 0.01)。见图 6(插页三)。

|
| A:Scramble-siRNA group; B:5-Fu group; C:P27RF-Rho siRNA group; D:P27RF-Rho siRNA+5-Fu group. 图 6 各组细胞Transwell实验结果 Figure 6 Results of Transwell test of cells in various groups |
|
|
5-Fu是一种常见的抗肿瘤药物,于1950年开发后最常应用于治疗胃肠道肿瘤,5-Fu主要是通过抑制细胞生长以及合成伪代谢物、掺入DNA及RNA中进而影响胸苷酸合酶 (TS) 的合成[6]。5-Fu耐药机制包括TS高表达、细胞内药物富集减少、凋亡相关蛋白表达异常,细胞凋亡减少、DNA损伤修复和细胞周期相关蛋白表达异常等[7-8]。然而,其耐药性限制了使用效果,许多晚期肝癌患者均对5-Fu天然耐药,或者是治疗过程中产生耐药,这也是目前临床上未单用5-Fu治疗而是多药联合治疗晚期肝癌的原因[9]。因此,从这些方面着手,寻找增加5-Fu药效的方法,提高肝癌治疗效果,显得尤为重要。
P27RF-Rho是目前新发现的Rho上游调控因子,其能通过抑制P27kip1从而释放RhoA, P27kip1是一种细胞周期相关蛋白[10],在黑色素瘤小鼠B16中P27RF-Rho和RhoC高表达[11]。研究[12]表明:P27RF-Rho基因沉默能够增加抑癌基因P53、Pten以及降低侵袭相关蛋白RhoC、RhoA表达,因此P27RF-Rho在细胞的侵袭及转移中起重要作用,也可能是一种新的促癌因子,与抑癌基因发挥拮抗作用。另外,基因沉默也可以使CyclinE及CDK5等细胞周期相关基因表达异常,细胞阻滞于G1期,从而降低癌细胞增殖能力[13]。本实验中通过慢病毒介导P27RF-Rho基因沉默,同时联合应用5-Fu,显著降低细胞增殖、迁移和侵袭能力,增强了5-Fu的药物敏感性。
RhoC是RhoGTPase家族重要组成部分,参与了细胞侵袭转移、细胞骨架形成、细胞凋亡和生长增殖等过程[14]。研究[15]显示:RhoC基因沉默能够使Cyclin D1、CDK4表达减少,P16、P21表达增加,从而发生G1-S期阻滞,另外RhoC基因沉默能够下调凋亡抑制基因Bcl-2,并且上调凋亡基因Bax,使细胞色素C从线粒体释放,促进细胞凋亡。本实验结果显示:P27RF-Rho siRNA+5-Fu组细胞中RhoC蛋白表达水平明显低于其他3组,说明P27RF-Rho siRNA联合5-Fu可以明显地减少RhoC表达,可能引起细胞凋亡增加、细胞周期阻滞。Transwell小室实验和细胞划痕实验结果显示:P27RF-Rho siRNA+5-Fu组细胞穿膜数少于其他3组,划痕距离明显多于其他对照组,进一步说明联合用药能够明显降低肝癌细胞迁移和侵袭能力,增强药效。
P27是1994年发现的调控细胞周期、抑制细胞分裂的重要基因, P27蛋白水平与肿瘤恶性程度呈负相关关系, 其是一种广谱的cyclin/CDK抑制剂,可以抑制多种cyclin/CDK激酶活性[16-17]。P27通过与CyclinE-CDK2复合体结合,从而限制细胞由G1期向S期转变[18],因此P27过表达会引起细胞G1期阻滞,细胞增殖减少。本实验结果显示:P27RF-Rho siRNA+5-Fu组P27蛋白条带明显强于其他3组,说明P27RF-Rho联合5-Fu能够增加P27蛋白表达,从而抑制细胞增殖,增强5-Fu杀伤肝癌细胞的敏感性。
综上所述,P2RF-Rho基因沉默能够明显增加5-Fu的药物敏感性,可从细胞增殖与凋亡、侵袭迁移等方面对肝癌5-Fu的耐药性进行逆转,因此,P27RF-Rho可能是增强5-Fu耐药性的新靶点,本研究为临床晚期肝癌治疗提供了新的思路和可能。
| [1] | 院存珍, 樊晨. 原发性肝癌的外科治疗进展[J]. 中国现代普通外科进展, 2016, 19(2): 155–157. |
| [2] | Center MM, Jemal A. International trends in liver cancer incidence rates[J]. Cancer Epidemiol Biomarkers Prev, 2011, 20(11): 2362–2368. DOI:10.1158/1055-9965.EPI-11-0643 |
| [3] | Zhang H, Ozaki I, Hamajima H, et al. Vitamin K2 augments 5-fluorouracil-induced growth inhibition of human hepatocellular carcinoma cells by inhibiting NF-κB activation[J]. Oncol Rep, 2011, 25(1): 159–166. |
| [4] | Hanna S, El-Sibai M. Signaling networks of Rho GTPases in cell motility[J]. Cell Signal, 2013, 25(10): 1955–1961. DOI:10.1016/j.cellsig.2013.04.009 |
| [5] | Zhou S, Ye W, Zhang Y, et al. miR-144 reverses chemoresistance of hepatocellular carcinoma cell lines by targeting Nrf2-dependent antioxidant pathway[J]. Am J Transl Res, 2016, 8(7): 2992–3002. |
| [6] | Longley DB, Harkin DP, Johnston PG. 5-Fluorouracil:mechanisms of action and clinical strategies[J]. Nat Rev Cancer, 2003, 3(5): 330–338. DOI:10.1038/nrc1074 |
| [7] | Guo X, Goessl E, Jin G, et al. Cell cycle perturbation and acquired 5-fluorouracil chemoresistance[J]. Anticancer Res, 2008, 28(1A): 9–14. |
| [8] | Zhang N, Yin Y, Xu SJ, et al. 5-Fluorouracil:mechanisms of resistance and reversal strategies[J]. Molecules, 2008, 13(8): 1551–1569. DOI:10.3390/molecules13081551 |
| [9] | Cao LQ, Wang XL, Wang Q, et al. Rosiglitazone sensitizes hepatocellular carcinoma cell lines to 5-fluorouracil antitumor activity through activation of the PPARgamma signaling pathway[J]. Acta Pharmacol Sin, 2009, 30(9): 1316–1322. DOI:10.1038/aps.2009.119 |
| [10] | Sharma SS, Pledger WJ. The non-canonical functions of p27(Kip1) in normal and tumor biology[J]. Cell Cycle, 2016, 15(9): 1189–1201. DOI:10.1080/15384101.2016.1157238 |
| [11] | Hoshino D, Koshikawa N, Seiki M. A p27(kip1)-binding protein, p27RF-Rho, promotes cancer metastasis via activation of RhoA and RhoC[J]. J Biol Chem, 2011, 286(4): 3139–3148. DOI:10.1074/jbc.M110.159715 |
| [12] | 马强, 谢淑丽, 王广义, 等. 慢病毒介导靶向P27RF-Rho基因沉默对肝癌细胞侵袭性的影响[J]. 吉林大学学报:医学版, 2016, 42(2): 260–265. |
| [13] | 邢光远, 谢淑丽, 邱伟, 等. P27RF-Rho基因沉默对肝癌Bel7402细胞增殖的影响[J]. 吉林大学学报:医学版, 2015, 41(3): 542–547. |
| [14] | Tseliou M, Al-Qahtani A, Alarifi S, et al. The role of RhoA, RhoB and RhoC GTPases in cell morphology, proliferation and migration in human cytomegalovirus (HCMV) infected glioblastoma cells[J]. Cell Physiol Biochem, 2016, 38(1): 94–109. DOI:10.1159/000438612 |
| [15] | Xie S, Zhu M, Lv G, et al. The role of RhoC in the proliferation and apoptosis of hepatocellular carcinoma cells[J]. Med Oncol, 2012, 29(3): 1802–1809. DOI:10.1007/s12032-011-0003-0 |
| [16] | Toyoshima H, Hunter T. p27, a novel inhibitor of G1 cyclin-Cdk protein kinase activity, is related to p21[J]. Cell, 1994, 78(1): 67–74. DOI:10.1016/0092-8674(94)90573-8 |
| [17] | 谢启超, 胡义德. p27研究进展[J]. 国外医学:肿瘤学分册, 2003, 30(1): 48–50. |
| [18] | Satoh T, Kaida D. Upregulation of p27 cyclin-dependent kinase inhibitor and a C-terminus truncated form of p27 contributes to G1 phase arrest[J]. Sci Rep, 2016, 6: 27829. DOI:10.1038/srep27829 |
 2017, Vol. 43
2017, Vol. 43


