扩展功能
文章信息
- 于洋, 于丽娜, 谢萍, 王福启, 麻薇, 施维
- YU Yang, YU Lina, XIE Ping, WANG Fuqi, MA Wei, SHI Wei
- 人源极光激酶A在毕赤酵母和MCF-7细胞中的表达及纯化
- Expression and purification of human Aurora A in Pichia pastoris and MCF-7 cells
- 吉林大学学报(医学版), 2017, 43(02): 266-270
- Journal of Jilin University (Medicine Edition), 2017, 43(02): 266-270
- 10.13481/j.1671-587x.20170211
-
文章历史
- 收稿日期: 2016-07-15
2. 吉林大学生命科学学院分子酶学 工程教育部重点实验室, 吉林 长春 130012;
3. 广州医科大学附属口腔医院牙周病科广州口腔病研究所口腔 医学重点实验室, 广东 广州 510140;
4. 吉林出入境检验检疫局技术中心, 吉林 长春 130062;
5. 吉林大学 中日联谊医院心血管内科, 吉林 长春 130033
2. Key Laboratory for Molecular Enzymology and Engineering, Ministry of Education, School of Life Sciences, Jilin University, Changchun 130012, China;
3. Department of Periodontics, Stomatology Hospital, Guangzhou Medical University, Key Laboratory of Oral Medicine, Guangzhou Institute of Oral Disease, Guangzhou 510140, China;
4. Center of Technology, Jilin Entry-Exit Inspection and Quarantine Bureau, Changchun 130062, China;
5. Department of Cardiology, China-Japan Union Hospital, Jilin University, Changchun 130033, China
极光激酶A被认为是癌基因[1-2],其过表达可导致细胞中心体异常增加,从而出现非整倍体细胞而形成肿瘤[3]。研究[4-5]显示:人源极光激酶A (AURKA) 能够在昆虫杆状病毒和大肠杆菌中表达及纯化,但对其在真核生物中的表达和纯化的研究较少。AURKA在真核细胞中的表达和纯化是研究其过表达诱发肿瘤的分子机制、设计筛选肿瘤靶向药物的前提。因此本研究构建2种AURKA真核表达载体,检测其在毕赤酵母X33和MCF-7细胞中的表达和纯化,旨在为阐明极光激酶A诱导肿瘤发生的分子机制提供理论基础,为设计和筛选抗肿瘤新型药物提供新的靶点。
1 材料与方法 1.1 主要试剂和仪器AURKAcDNA由加拿大多伦多大学徐建华教授提供。pcDNA3.1(+)、引物合成和Ni-NTA柱 (上海生工公司),毕赤酵母X33、pPICZαA和Zeocin抗菌素 (美国Invitrogen公司),Pfu DNA聚合酶、dNTP、T4 DNA连接酶、DNA Marker和各种限制性内切酶 (日本TaKaRa公司),[γ-32P]-ATP (北京福瑞生物公司),G418(北京生物工程公司),Brij-35(美国Amresco公司),AURKA抗体和二抗 (美国Cell Signaling Technology公司)。PCR仪和电转仪 (美国Bio-Rad公司)。
1.2 2种真核载体的构建和鉴定pPICZαA-AURKA上游引物:5′-GATCGTCTCGAGAAA-AGAATGGACCGATCTAAAGAAAACTGC-3′,下游引物:5′-GATCGTTCTAGATTACTAAGACTGTTTGCTAGCTGATTC-3′,下划线分别是XhoⅠ和XbaⅠ酶切位点。pcDNA3.1(+)-AURKA上游引物:5′-GATCGTAGATCTGCCACCATGGACCGATCTAAAGAAAAC-3′,下游引物:5′-GATCGTCTCGAGCAGACTGTTTGCTAGCTGATTC-3′,下划线分别是BglⅡ和XhoⅠ酶切位点。PCR产物鉴定后进行双酶切,T4连接酶连接,分别转入大肠杆菌TOP10 Zeocin和DH5α 50 mg·L-1氨苄青霉素平板筛选,对阳性克隆进行PCR鉴定。
1.3 AURKA在毕赤酵母中的表达重组质粒经SalⅠ线性化后电转入毕赤酵母X33中,在2000 mg·L-1 Zeocin的YPD平板培养基进行筛选,阳性克隆转入5mL BMGY培养基中,28℃下振荡培养至600 nm处吸光度 (A) 值为2~6;然后经离心后转入25 mL BMMY培养基中,甲醇诱导培养至A (600) 为1,定期收集诱导物。
1.4 SDS-PAGE分析离心收集诱导后的酵母细胞,冰浴超声裂解,然后离心获得总蛋白进行SDS-PAGE,最后用考马斯亮蓝进行染色观察。
1.5 重组蛋白的纯化提取诱导后酵母细胞总蛋白,加入经预平衡处理的Ni-NTA柱结合1 h后,用含有50 mol·L-1咪唑洗脱液洗脱,之后再用含有150 mol·L-1咪唑的洗脱液洗脱。分别收集洗脱样品,行SDS-PAGE分析。
1.6 重组AURKA活性分析采用放射自显影方法检测AURKA的活性[6]。将重组AURKA、底物组蛋白H3和100 mol·L-1 [γ-32P]-ATP加入激酶缓冲液中,30℃反应20 min;然后进行SDS-PAGE,将放射性同位素标记的组蛋白H3条带切下,并附上X线胶片,-80℃条件下在暗盒中显影4 h。
1.7 MCF-7细胞中AURKA的表达重组质粒经BglⅡ线性化后电转入MCF-7细胞中,400 mg·L-1G418细胞培养基筛选12~15 d;阳性细胞采用含10%新生牛血清的DMEM细胞培养基于37℃、5% CO2培养箱中培养扩增。
1.8 Western blotting法分析提取重组的MCF-7细胞总蛋白,采用BCA蛋白分析试剂盒进行定量分析,取等量蛋白进行SDS-PAGE,之后转PVDF膜,5%牛奶封闭,4℃下一抗孵育过夜;第2天洗膜后室温孵育二抗1 h,洗膜,最后通过ECL法显色。
1.9 MCF-7细胞增殖分析转染pcDNA3.1(+)-AURKA的MCF-7细胞、转染pcDNA3.1(+) 的MCF-7细胞以及野生型MCF-7细胞分别以7×103细胞/孔接种于6孔板中,于37℃、5% CO2培养箱中分别培养24和48 h后,制成单细胞悬液,经0.4%台盼蓝染色后用自动细胞计数器计算活细胞数量。
1.10 统计学分析采用SPSS 16.0统计软件进行统计学分析。每组实验重复3次,各组MCF-7活细胞数量以x±s表示,组间比较采用Student’s t检验法。以P < 0.05为差异有统计学意义。
2 结果 2.1 2种真核载体的构建和鉴定以AURKA cDNA为模板,经PCR扩增得到1212 bp的产物 (图 1A),与目的基因大小一致。将目的基因分别插入pPICZαA和pcDNA3.1(+) 载体,得到2种重组质粒。经筛选后的2种重组质粒PCR均扩增出1212 bp的产物 (图 1B和C)。

|
| A: AURKA as template; Lane 1: AURKA; B:pPICZaA as target gene; Lane 1, 3: Recombinant plasmid; Lane 2: pPICZαA; C:pcDNA3.1(+) as target gene; Lane 1: pcDNA3.1(+); Lane 2: Recombinant plasmid; M: DNA marker. 图 1 重组质粒的构建和鉴定 Figure 1 Construction and identification of recombinant plasmids |
|
|
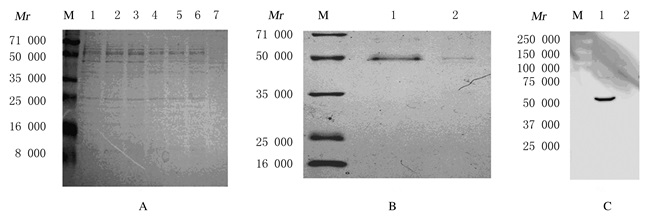
重组质粒经筛选并诱导4 d后在50000处有蛋白表达 (图 2A)。蛋白经含有50 mol·L-1咪唑洗脱液洗脱后获得了单一蛋白条带,相对分子质量约为50000;而后经含有150 mol·L-1咪唑洗脱液洗脱后无蛋白条带 (图 2B)。Western blotting法鉴定纯化蛋白,50000处有AURKA蛋白表达 (图 2C)。
|
| A: AURKA protein expression; Lane 1-6: Positive clones of recombinant plasmids; Lane 7: pPICZαA; B, C: Purification and identification of AURKA protein; Lane 1: Purified recombinant protein from first eluted with buffer containing 50 mol·L-1 imidazole; Lane 2: Purified recombinant protein from first eluted with buffer containing 150 mol·L-1 imidazole; M: Protein marker. 图 2 AURKA在毕赤酵母中的表达和纯化 Figure 2 Expression and purification of AURKA protein in Pichia pastoris X33 |
|
|
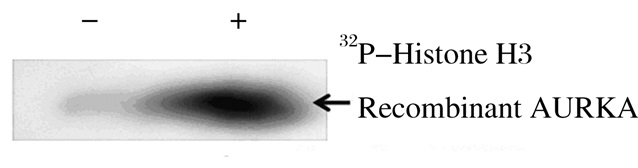
放射自显影法检测显示:加入重组AURKA的底物组蛋白H3被磷酸化,而未重组AURKA的底物蛋白无磷酸化。见图 3。
|
| 图 3 重组AURKA的活性 Figure 3 Activity of recombinant AURKA |
|
|
与野生型MCF-7细胞比较,转染重组质粒细胞中AURKA蛋白表达水平升高,而转染空质粒细胞AURKA蛋白表达无明显差异。见图 4。

|
| Lane 1: WT MCF-7 cells; Lane 2: MCF-7 cells transfected with pcDNA3.1(+); Lane 3: MCF-7 cells transfected with pcDNA3.1(+)-AURKA. 图 4 AURKA在MCF-7细胞中的表达 Figure 4 Expressions of AURKA in MCF-7 cells |
|
|
重组质粒和空质粒分别转染MCF-7细胞24和48 h后,转染空质粒细胞与野生型MCF-7细胞生长较为相似,活细胞数量无明显差异 (P > 0.05);转染重组质粒细胞生长相对较快,活细胞数量明显增加 (P < 0.01)。见表 1。
| (x±s) | ||
| Group | No. of cells | |
| (t/h) 24 | 48 | |
| WT MCF-7 cells | 6 986±52 | 7 512±61 |
| Cells transfected with pcDNA3.1(+) | 7 060±65 | 7 683±76 |
| Cells transfected with AURKA | 7 824±74* | 8 577±92* |
| * P < 0.01 vs WT MCF-7 cells. | ||
极光激酶是负责调控细胞有丝分裂的一类重要丝/苏氨酸激酶,在细胞有丝分裂中参与中心体成熟分离、染色体固缩、纺锤体组装和维持、染色体分离以及胞质分裂等多个过程,而这些过程正是细胞生长和存活的关键步骤,若其发生错误,就会导致基因的不稳定,诱发形成肿瘤。人类极光激酶有3个家族成员,即极光激酶A、B和C。
AURKA基因位于染色体20q13.2位点,在许多肿瘤中呈过表达[7-12],在乳腺癌中可通过活化YAP蛋白信号通路从而诱发癌症[13]。最新研究[14]显示:AURKA在口腔鳞状细胞癌中也呈高表达,且与肿瘤分期和发展相关。另有研究[15]显示:敲除AURKA可使miR-129-3p过表达,肝癌转移和浸润率增加。AURKA与诱发肿瘤的机制以及利用计算机辅助设计靶向药物成为研究热点[16]。而AURKA在真核细胞的表达和纯化是上述研究的前提。目前多见AURKA在原核细胞中表达的研究,而在真核细胞中表达的研究甚少。因此本研究构建2种人源AURKA真核表达载体,检测其表达和纯化。本研究结果显示:经PCR扩增后,2种重组质粒均有目的基因表达,表明2种真核表达载体构建成功。经纯化得到相对分子质量为50000重组蛋白,大于目的蛋白的相对分子质量 (48 000),分析其原因可能有2点:第一,重组质粒中有6个组氨酸尾 (His-tagged);第二,N末端蛋白发生糖基化。纯化重组蛋白可磷酸化其底物组蛋白H3,表明其具有生物活性,进而将重组质粒转染至乳腺癌MCF-7细胞,使AURKA高表达,发现高表达者细胞增殖明显增加,提示抑制AURKA位点扩增可抑制肿瘤发生。在此研究基础上,还需进行动物实验,设计和筛选乳腺癌抑制剂靶点。
| [1] | Kitzen JJ, de Jonge MJ, Verweij J. Aurora kinase inhibitors[J]. Crit Rev Oncol Hematol, 2010, 73(2): 99–110. DOI:10.1016/j.critrevonc.2009.03.009 |
| [2] | Yan M, Wang C, He B, et al. Aurora-A kinase:A potent oncogene and target for cancer therapy[J]. Med Res Rev, 2016, 36(6): 1036–1079. DOI:10.1002/med.2016.36.issue-6 |
| [3] | Meraldi P, Honda R, Nigg EA. Aurora-A overexpression reveals tetraploidization as a major route to centrosome amplification in p53-/- cells[J]. EMBO J, 2002, 21(4): 483–492. DOI:10.1093/emboj/21.4.483 |
| [4] | Elling RA, Tangonan BT, Penny DM, et al. Mouse Aurora A:expression in Escherichia coli and purification[J]. Protein Expr Purif, 2007, 54(1): 139–146. DOI:10.1016/j.pep.2007.03.002 |
| [5] | Cheetham GM, Knegtel RM, Coll JT, et al. Crystal structure of aurora-2, an oncogenic serine/threonine kinase[J]. J Biol Chem, 2002, 277(45): 42419–42422. DOI:10.1074/jbc.C200426200 |
| [6] | Eyers PA, Churchill ME, Maller JL. The Aurora A and Aurora B protein kinases:a single amino acid difference controls intrinsic activity and activation by TPX2[J]. Cell Cycle, 2005, 4(6): 784–789. DOI:10.4161/cc.4.6.1693 |
| [7] | Marumoto T, Hirota T, Morisaki T, et al. Roles of aurora-A kinase in mitotic entry and G2 checkpoint in mammalian cells[J]. Genes Cells, 2002, 7(11): 1173–1182. DOI:10.1046/j.1365-2443.2002.00592.x |
| [8] | Satinover DL, Leach CA, Stukenberg PT, et al. Activation of Aurora-A kinase by protein phosphatase inhibitor-2, a bifunctional signaling protein[J]. Proc Natl Acad Sci USA, 2004, 101(23): 8625–8630. DOI:10.1073/pnas.0402966101 |
| [9] | Castro A, Arlot-Bonnemains Y, Vigneron S, et al. APC/fizzy-related targets Aurora-A kinase for proteolysis[J]. EMBO Rep, 2002, 3(5): 457–462. DOI:10.1093/embo-reports/kvf095 |
| [10] | Fu J, Bian M, Jiang Q, et al. Roles of Aurora kinases in mitosis and tumorigenesis[J]. Mol Cancer Res, 2007, 5(1): 1–10. DOI:10.1158/1541-7786.MCR-06-0208 |
| [11] | Hascoet P, Chesnel F, Le Goff C, et al. Unconventional functions of mitotic kinases in kidney tumorigenesis[J]. Front Oncol, 2015, 5: 241. |
| [12] | Willems E, Lombard A, Dedobbeleer M, et al. The unexpected roles of aurora A kinase in gliobastoma recurrences[J]. Targ Oncol, 2017, 12(1): 11–18. DOI:10.1007/s11523-016-0457-2 |
| [13] | Chang SS, Yamaguchi H, Xia W, et al. Aurora A kinase activates YAP signaling in triple-negative breast cancer[J]. Oncogene, 2017, 36(9): 1265–1275. DOI:10.1038/onc.2016.292 |
| [14] | 邹苑, 陈浩, 马洪. AURKA基因在口腔鳞癌中的表达及意义[J]. 贵州医药, 2016, 40(4): 358–359. |
| [15] | Cui S, Zhang K, Li C, et al. Methylation-associated silencing of microRNA-129-3p promotes epithelial-mesenchymal transition, invasion and metastasis of hepatocelluar cancer by targeting Aurora-A[J]. Oncotarget, 2016, 7(47): 78009–78028. |
| [16] | 孔越, 阎爱侠. 基于极光激酶A抑制剂的计算机辅助药物设计的研究[A]. 中国化学会第29届学术年会摘要集—第19分会: 化学信息学与化学计量学[C]. 北京: 2014. |
 2017, Vol. 43
2017, Vol. 43


