扩展功能
文章信息
- 孙维琦, 张晶, 靳曙光, 王洪艳, 李环, 孙志伟
- SUN Weiqi, ZHANG Jing, JIN Shuguang, WANG Hongyan, LI Huan, SUN Zhiwei
- 磁性Fe3O4纳米颗粒对大鼠脏器组织中Caveolin-1和Clathrin Heavy Chain蛋白表达的影响
- Influence of magnetic Fe3O4 nanoparticles in expressions of Caveolin-1 and Clathrin Heavy Chain proteins in organ tissues of rats
- 吉林大学学报(医学版), 2017, 43(02): 260-265
- Journal of Jilin University (Medicine Edition), 2017, 43(02): 260-265
- 10.13481/j.1671-587x.20170210
-
文章历史
- 收稿日期: 2016-10-10
2. 北华大学公共卫生学院卫生毒理学教研室, 吉林 吉林 132013;
3. 首都医科大学公共卫生学院卫生化学与毒理学系, 北京 100069
2. Department of Health Toxicology, School of Public Health, Beihua University, Jilin 132013, China;
3. Department of Sanitary Chemistry and Toxicology, School of Public Health, Capital Medical University, Beijing 100069, China
磁性Fe3O4纳米颗粒作为纳米材料的一种,具有良好的磁性和高比表面活性等特性,在很多领域被应用 (诸如防伪识别和微波吸收等)。近年来,随着医药卫生的发展,磁性Fe3O4纳米颗粒在医药卫生领域应用也比较广泛,其可用作核磁共振造影剂和载药体系,用于靶向治疗肿瘤和磁热方法治疗肿瘤等。由于Fe3O4纳米颗粒的大量使用,人体接触其机会增加,其生物安全性越来越引起重视,Fe3O4纳米颗粒在机体内的吸收、转运是其生物相容性与生物安全性研究的内容之一。
纳米材料进入机体后经过生物膜的过程中主要以扩散方式、胞饮方式或内吞方式进行,在内吞过程中主要参与蛋白有小窝蛋白 (Caveolin) 和网格蛋白 (Clathrin),其中网格蛋白包括网格轻链蛋白 (Clathrin Light Chain) 和网格重链蛋白 (Clathrin Heavy Chain),参与吞噬作用以网格重链蛋白为主[1];小窝蛋白有3种,即Caveolin-1、Caveolin-2和Caveolin-3,其在机体中表达位置不同[2-4]。由于Caveolin-1在内皮细胞等部位表达较多,因此近年通过检测Caveolin-1的吞噬作用来探讨纳米材料进入细胞途径的研究[5-6]比较多。在体内实验中,磁性Fe3O4纳米颗粒进入机体后通过细胞膜的方式受体内内环境等复杂因素的影响,有很多不确定性,国内外研究比较少。本实验通过动物体内实验,测定磁性Fe3O4纳米颗粒对参与内吞作用的主要蛋白Caveolin-1及Clathrin Heavy Chain表达的影响,了解机体细胞内吞Fe3O4纳米颗粒的主要通路,旨在为Fe3O4纳米颗粒的生物安全性研究提供依据。
1 材料与方法 1.1 实验动物、主要试剂和仪器Wistar大鼠由吉林大学基础医学院动物室提供,体质量180~220g, 动物合格证号:SCXK (吉)2007-0003。FeCl3·6H2O及FeCl2·4H2O (美国ACROS公司),PVDF膜 (0.45μm孔径)(美国Biomiga公司),蛋白Marker、兔抗CHC多克隆抗体、兔抗Caveolin-1多克隆抗体、羊抗兔HRP和鼠抗β-actin抗体 (美国Santa Cruz公司),质粒提取试剂盒和Total RNA纯化试剂盒 (日本TaKaRa公司),T4噬菌体GP32蛋白 (美国Roche公司)。透射电镜 (日本JEOL公司),PCR扩增仪 (美国ABI公司),电泳仪 (JY600C,北京君意东方电泳设备有限公司),荧光定量PCR仪 (7500型,美国ABI公司),核酸/蛋白定量分析仪 (美国Bio Rad公司),高速冷冻离心机 (美国Sigma公司),Ni-U荧光显微镜 (日本尼康公司)。
1.2 磁性Fe3O4纳米颗粒的制备磁性Fe3O4纳米颗粒的制备:采用水相化学共沉淀法,用高纯氮去除150 mL含有11.2 mmol·L -1FeCl3和5.6 mmol·L-1 FeCl2溶液中的氧,保持溶液温度50℃,在转速500 r·min-1下搅拌,同时在高纯氮气的条件下将NH3·H2O迅速加入12.5 mL,在50℃的环境中保持30 min (水浴)。用磁铁吸附黑色的Fe3O4纳米颗粒,去除上清液,再用去氧水洗涤3次,制成50 g·L-1浓度的溶液,加入铜网,透射电镜下观察其粒径大小。
1.3 实验动物分组和处理24只Wistar大鼠按照随机法进行分组,每组6只,雌雄各半,分别为高剂量磁性纳米Fe3O4颗粒组 (56mg·kg -1)、中剂量磁性纳米Fe3O4颗粒组 (28 mg·kg-1)、低剂量磁性纳米Fe3O4颗粒组 (14 mg·kg-1) 和对照组。将不同剂量的磁性纳米Fe3O4颗粒溶液在注射前超声3 min,经大鼠尾静脉注射,对照组大鼠注射等量的生理盐水。24h后取大鼠肝脏、肺脏、肾脏和脾脏,-80℃超低温保存。
1.4 Western blotting法检测Caveolin-1和Clathrin Heavy Chain蛋白表达水平取脏器组织于研钵内充分研磨成匀浆,按照蛋白提取试剂盒操作说明提取和测量蛋白。经聚丙烯酰胺凝胶电泳、转膜、封闭、抗体孵育、发光试剂显色、采用Image-proplus图像分析系统进行定量分析,以吸光度 (A) 值计算Caveolin-1和Clathrin Heavy Chain蛋白的相对表达水平。Caveolin-1或Clathrin Heavy Chain蛋白的相对表达水平=Caveolin-1或Clathrin Heavy Chain的A值/β-actin的A值。
1.5 荧光实时定量PCR检测Caveolin-1和Clathrin Heavy Chain mRNA的表达引物设计:Clathrin Heavy Chain引物,上游引物,5′-acagctaccactggtgaaacc-3′;下游引物,5′-ctattgatgttcgcagagcctg-3′,扩增片段长度为126 bp。Caveolin-1引物,上游引物,5′-tggtcaaccgcgaccccaagc-3′;下游引物,5′-tgaagctggccttccagatgc-3′,扩增片段长度为118 bp。GAPDH内对照引物,上游引物,5′-agggcatcctgggctacactg-3′;下游引物,5′-actccttggaggccatgtagg-3′,扩增片段长度为196 bp。Total RNA纯化:将样本在液氮中研磨,Total RNA的纯化按Total RNA纯化试剂盒说明书进行,然后使用核酸分析仪进行浓度分析。标准品质粒构建及一步法Real time PCR扩增:反应条件,55℃、20 min,95℃、5 min,94℃、10 s,60℃、30 s,35个循环。
1.6 统计学分析采用SPSS16.0统计软件进行统计学分析。各组Caveolin-1和Clathrin Heavy Chain蛋白表达水平以x±s表示,组间比较采用单因素方差分析。以α=0.05为检验水准。
2 结果 2.1 磁性Fe3O4纳米颗粒表征透射电子显微镜 (TEM) 观察结果显示:Fe3O4纳米颗粒主要为球形结构,粒子大小比较均匀,平均尺寸为9 nm。见图 1。

|
| 图 1 Fe3O4纳米颗粒的TEM图像 (×15000) Figure 1 TEM image of Fe3O4 nanoparticles (×15000) |
|
|
各组大鼠不同脏器组织中Caveolin-1和Clathrin Heavy Chain蛋白表达电泳图见图 2。与对照组比较,中和高剂量组大鼠肝脏和脾脏组织中Clathrin Heavy Chain蛋白表达水平明显升高 (P < 0.05);与低剂量组比较,高剂量组Clathrin Heavy Chain蛋白表达水平明显升高 (P < 0.05)。与对照组比较,低、中和高剂量组大鼠肺脏组织中Clathrin Heavy Chain蛋白表达水平明显升高 (P < 0.05);且高剂量组与其他3组比较表达水平明显升高 (P < 0.05)。各剂量组肾脏组织中Clathrin Heavy Chain蛋白表达水平比较差异无统计学意义 (P > 0.05)。见表 1。各剂量组大鼠各脏器组织中Caveolin-1蛋白表达水平比较差异无统计学意义 (P > 0.05)。见表 2。
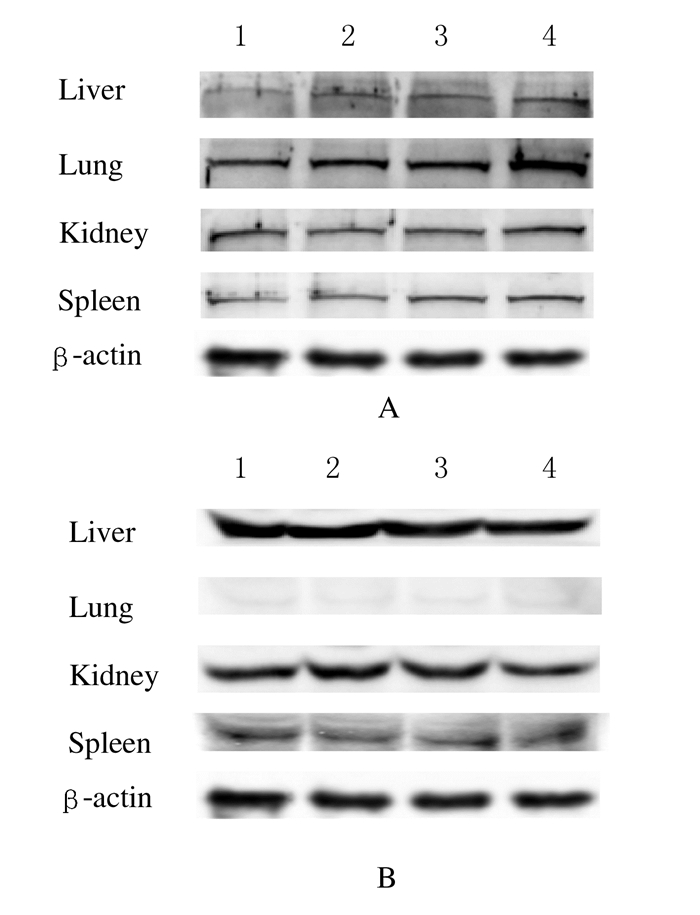
|
| Lane 1:Control group; Lane 2:Low dose of magnetic Fe3O4 nanoparticle group; Lane 3:Medium dose of magnetic Fe3O4 nanoparticle group; Lane 4:High dose of magnetic Fe3O4 nanoparticle group. 图 2 各组大鼠不同脏器组织中Clathrin Heavy Chain蛋白 (A) 和Caveolin-1蛋白 (B) 表达电泳图 Figure 2 Electrophoregram of Clathrin Heavy Chain (A) and Caveolin-1(B) proteins in different organ tissues of rats in various groups |
|
|
| (n=6, x±s) | ||||
| Group | Clathrin Heavy Chain protein | |||
| Liver | Lung | Kidney | Spleen | |
| Control | 1.000±0.116 | 1.000±0.032 | 1.000±0.024 | 1.000±0.027 |
| Magnetic Fe3O4 nanoparticle | ||||
| Low dose | 1.197±0.128 | 1.318±0.007* | 1.124±0.036 | 1.234±0.033 |
| Medium dose | 1.838±0.185* | 1.485±0.007* | 1.309±0.045 | 1.347±0.028* |
| High dose | 2.261±0.221*△ | 2.004±0.045*△# | 1.360±0.030 | 1.423±0.034*△ |
| *P < 0.05 vs control group; △P < 0.05 vs low dose group; #P < 0.05 vs medium dose group | ||||
| (n=6, x±s) | ||||
| Group | Caveolin-1 protein | |||
| Liver | Lung | Kidney | Spleen | |
| Control | 1.000±0.021 | 1.000±0.057 | 1.000±0.027 | 1.000±0.025 |
| Magnetic Fe3O4 nanoparticle | ||||
| Low dose | 1.028±0.035 | 1.061±0.064 | 1.219±0.044 | 0.990±0.042 |
| Medium dose | 1.048±0.056 | 1.124±0.029 | 1.201±0.038 | 1.031±0.032 |
| High dose | 1.066±0.048 | 1.391±0.049 | 1.050±0.052 | 1.239±0.057 |
在图 3中横坐标代表基因拷贝数的对数值,纵坐标代表Ct值;从图 3可见:标准曲线线性非常好,扩增的效率接近100%,因此,可以实验设置的标准品 (Standard) 为基准,检测未知样本 (X Unknown)。荧光定量PCR测得各样本的Ct值,经过换算及统计分析显示:Clathrin Heavy Chain mRNA在脾脏和肝脏组织中的表达水平随Fe3O4纳米颗粒剂量的增加而升高,且各组之间表达水平差异有统计学意义 (P < 0.05);高剂量组大鼠肾脏组织中Clathrin Heavy Chain mRNA表达水平高于其他3组 (P < 0.05);对照组、低剂量组和中剂量组之间比较差异无统计学意义 (P > 0.05)。中和高剂量组大鼠肺脏组织中Clathrin Heavy Chain mRNA表达水平高于低剂量组和对照组 (P < 0.05),中和高剂量组之间、低剂量组和对照组之间表达水平比较差异无统计学意义 (P > 0.05)。见表 3。中和高剂量组大鼠脾脏和肺脏组织中Caveolin-1 mRNA表达水平高于对照组和低剂量组 (P < 0.05),其中高和中剂量组之间、低剂量组和对照组之间差异无统计学意义 (P > 0.05)。与对照组比较,低、中和高剂量组大鼠肝脏组织中Caveolin-1 mRNA表达水平明显升高 (P < 0.05);且中和高剂量组Caveolin-1 mRNA表达水平明显高于低剂量组 (P < 0.05)。各组大鼠肾脏组织中Caveolin-1 mRNA的表达水平比较差异无统计学意义 (P > 0.05)。见表 4。
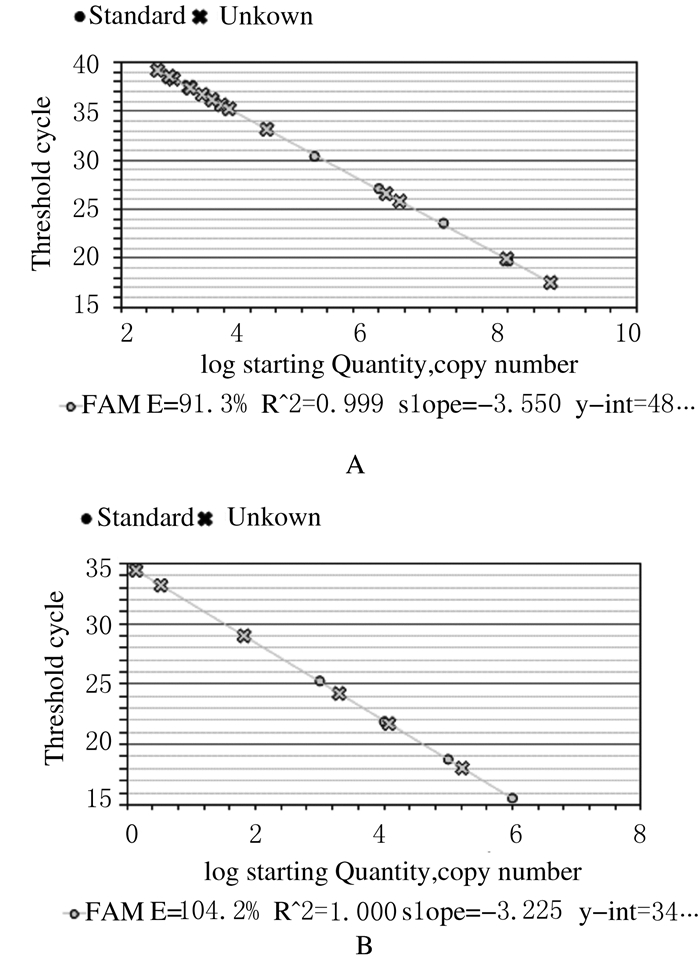
|
| 图 3 各组大鼠不同脏器组织中Clathrin Heavy Chain (A) 和Caveolin-1(B) mRNA表达水平的荧光定量PCR曲线 Figure 3 Fluorescent quantitative PCR curves of Clathrin Heavy Chain (A) and Caveolin-1(B) mRNA expression levels in different organ tissues of rats in various groups |
|
|
| (n=6, x±s) | ||||
| Group | Clathrin Heavy Chain mRNA | |||
| Liver | Lung | Kidney | Spleen | |
| Control | 1.000±0.201 | 1.000±0.162 | 1.000±0.206 | 1.000±0.177 |
| Magnetic Fe3O4 nanoparticle | ||||
| Low dose | 3.946±0.283* | 1.085±0.314 | 0.998±0.185 | 2.045±0.493* |
| Medium dose | 6.233±0.528*△ | 2.081±0.310*△ | 1.018±0.236 | 2.390±0.369*△ |
| High dose | 7.925±0.718*△# | 2.218±0.301*△ | 3.803±0.327*△# | 5.778±0.393*△# |
| *P < 0.05 vs control group; △P < 0.05 vs low dose group; #P < 0.05 vs medium dose group. | ||||
| (n=6, x±s) | ||||
| Group | Caveolin-1 mRNA | |||
| Liver | Lung | Kidney | Spleen | |
| Control | 1.000±0.208 | 1.000±0.221 | 1.000±0.164 | 1.000±0.161 |
| Magnetic Fe3O4 nanoparticle | ||||
| Low dose | 2.373±0.432* | 1.028±0.167 | 1.020±0.188 | 1.028±0.230 |
| Medium dose | 6.548±0.389*△ | 4.698±0.404*△ | 1.058±0.231 | 2.923±0.212*△ |
| High dose | 6.755±0.343*△ | 4.775±0.438*△ | 1.110±0.242 | 2.948±0.258*△ |
| * P < 0.05 vs control group; △P < 0.05 vs low dose group. | ||||
本研究结果显示:在大鼠肝脏、肺脏和脾脏组织中Clathrin Heavy Chain蛋白及其mRNA的表达水平随Fe3O4纳米颗粒剂量的增加而改变,肾脏组织中的表达水平无明显改变。这与以往研究的Fe3O4纳米颗粒在体内的分布[7]相一致,经大鼠尾静脉注射后Fe3O4纳米颗粒进入到机体内,易被吞噬细胞识别摄入并集中在诸如肝脏、脾脏等网状内皮细胞丰富的器官和组织中[8-9]。研究[10]显示:纳米颗粒进入机体后易聚集在脏器组织的巨噬细胞中,Clathrin Heavy Chain是参与细胞内吞作用的主要蛋白之一,本实验中在大鼠尾静脉给予Fe3O4纳米颗粒后,其肝脏、肺脏和脾脏组织中Clathrin Heavy Chain的表达增强,由此可见Fe3O4纳米颗粒进入机体后主要聚集在肝脏和脾脏等,且进入这些脏器组织细胞的过程与Clathrin Heavy Chain参与的吞噬作用有关。
Western blotting法检测Caveolin-1蛋白结果显示:Caveolin-1在各个脏器的不同剂量组之间的表达无明显差异,说明Fe3O4纳米颗粒未引起Caveolin-1表达的增强,推测Fe3O4纳米颗粒进入脏器组织细胞与Caveolin-1参与的内吞作用无关。荧光实时定量PCR法检测Caveolin-1 mRNA表达水平结果显示:Caveolin-1 mRNA在大鼠肝脏组织中的表达水平随剂量增加而改变,中和高剂量组大鼠肺脏和脾脏组织中表达增加,这与其蛋白表达的结果略有不同,分析可能与mRNA经转录、翻译合成蛋白的过程受到一些因素的影响所致,其机制有待研究。
体外实验研究[11]表明:加入阻断剂氯丙嗪和β-甲基环糊精对Clathrin Heavy Chain和Caveolin-1参与的内吞作用进行阻断,结果纳米粒子顺利进入细胞内,进而推论出不经过Clathrin Heavy Chain、Caveolin-1参与的内吞作用,纳米粒子仍然可以直接进入细胞,另外一些体外实验研究[12-15]表明:纳米粒子进入各种细胞很容易。本研究通过大鼠体内实验,在大鼠尾静脉注射Fe3O4纳米颗粒后,检测了参与细胞吞噬作用的主要蛋白Clathrin Heavy Chain和Caveolin-1的表达情况,结果显示:在大鼠体内Fe3O4纳米颗粒进入机体组织细胞与Clathrin Heavy Chain参与的吞噬作用有关,在活的机体中,除了一些特殊情况,不可能有一些阻断剂诸如氯丙嗪、β-甲基环糊精的作用,说明由一些体外实验推测到体内的结果还有待商榷。纳米颗粒进入机体后再到组织细胞是一个复杂的过程,在无Caveolin-1和Clathrin Heavy Chain阻断剂的情况下,有可能经过单纯扩散进入、也有可能经过Clathrin Heavy Chain介导的吞噬作用进入到组织的吞噬细胞中,这又涉及到免疫调节作用,其具体机制及途径有待研究。
综上所述,磁性Fe3O4纳米颗粒经大鼠尾静脉注射后,在大鼠肝脏、脾脏和肺脏组织中,参与细胞内吞作用的Clathrin Heavy Chain蛋白及其mRNA表达增强,可见Fe3O4纳米颗粒进入脏器组织细胞的途径之一是Clathrin Heavy Chain参与的内吞作用。
[本文为孙维琦博士研究生毕业论文的一部分]
| [1] | Marsh M, Mcmahon HT. The structural era of endocytosis[J]. Science, 1999, 285(5425): 215–220. DOI:10.1126/science.285.5425.215 |
| [2] | Scherer PE, Lewis RY, Volonte D, et al. Cell-type and tissue-specific expressionof caveolin-2. Caveolins 1 and 2 co-localize and forma stable hetero-oligomeric complex in vivo[J]. J Biol Chem, 1997, 272(46): 29337–29346. DOI:10.1074/jbc.272.46.29337 |
| [3] | Song KS, Scherer PE, Tang Z, et al. Expression of caveolin-3 in skeletal, cardiac, and smooth muscle cells.Caveolin-3 is a component of the sarcolemma and co-fractionates with dystrophin and dystrophin-associated glycoproteins[J]. J Biol Chem, 1996, 271(25): 15160–15165. DOI:10.1074/jbc.271.25.15160 |
| [4] | Tang Z, Scherer PE, Okamoto T, et al. Molecular cloning of caveolin-3, a novel member of the caveolin gene family expressed predominantly in muscle[J]. J Biol Chem, 1996, 271(4): 2255–2261. DOI:10.1074/jbc.271.4.2255 |
| [5] | Bertino EM, Williams TM, Nana-Sinkam SP, et al. Stromal caveolin-1 is associated with response and survival in a phase Ⅱ trial of nab-paclitaxel with carboplatin for advanced NSCLC patients[J]. Clin Lung Cancer, 2015, 16(6): 466–474. DOI:10.1016/j.cllc.2015.05.004 |
| [6] | Bohmer N, Jordan A. Caveolin-1 and CDC42 mediated endocytosis of silica-coated iron oxide nanoparticles in HeLa cells[J]. Beilstein J Nanotechnol, 2015, 14(6): 167–176. |
| [7] | Smuldes S, Ketkar-Atre A, Luyts K, et al. Body distribution of SiO2-Fe3O4 core-shell nanoparticles after intravenous injection and intratracheal instillation[J]. Nanotoxicology, 2016, 10(5): 567–574. DOI:10.3109/17435390.2015.1100761 |
| [8] | Jarockyte G, Daugelaite E, Stasys M, et al. Accumulation and toxicity of superparamagnetic iron oxide nanoparticles in cells and experimental Animals[J]. Int J Mol Sci, 2016, 17(8): 1193–1197. DOI:10.3390/ijms17081193 |
| [9] | Chen Z, Chen H, Meng H, et al. Bio-distribution and metabolic paths of silica coated CdSeS quantum dots[J]. Toxicol Appl Pharmacol, 2008, 230(3): 364–371. DOI:10.1016/j.taap.2008.03.022 |
| [10] | Fazlollahi F, Kim YH, Sipos A, et al. Nanoparticle translocation across mouse alveolar epithelial cell monolayers:species-specific mechanisms[J]. Nanomedicine, 2013, 9(6): 786–794. DOI:10.1016/j.nano.2013.01.007 |
| [11] | Fazlollahi F, Sipos A, Kim YH, et al. Translocation of PEGylated quantum dots across rat alveolar epithelial cell monolayers[J]. Int J Nanomed, 2011, 6(5): 2849–2857. |
| [12] | Xue J, Chen H, Diao L, et al. Expression of Caveolin-1in tongue squamous cell carcinoma by quantum dots[J]. Eur J Histochem, 2010, 54(2): e20. DOI:10.4081/ejh.2010.e20 |
| [13] | Xu Y, Liu BR, Lee HJ, et al. Nona-arginine facilitates delivery of quantum dots into cells via multiple pathways[J]. J Biomed Biotechnol, 2010, 10(9): 94853–94864. |
| [14] | Kuhn DA, Vanhecke D, Michen B, et al. Different endocytotic uptake mechanisms for nanoparticles in epithelial cells and macrophages[J]. Beilstein J Nanotechnol, 2014, 24(5): 1625–1636. |
| [15] | Perez AP, Cosaka ML, Romero EL, et al. Uptake and intracellular traffic of siRNA dendriplexes in glioblastoma cells and macrophages[J]. Int J Nanomed, 2011, 6(3): 2715–2728. |
 2017, Vol. 43
2017, Vol. 43


