扩展功能
文章信息
- 王立岩, 张贝贝, 赫东芸, 盛敏佳, 王雪
- WANG Liyan, ZHANG Beibei, HE Dongyun, SHENG Minjia, WANG Xue
- 二甲双胍和紫杉醇对卵巢癌SKOV3细胞体外增殖和凋亡的影响
- Influence of metformin and paclitaxel in proliferation and apoptosis of ovarian cancer SKOV3 cellsin vitro
- 吉林大学学报(医学版), 2017, 43(02): 255-259
- Journal of Jilin University (Medicine Edition), 2017, 43(02): 255-259
- 10.13481/j.1671-587x.20170209
-
文章历史
- 收稿日期: 2016-11-01
2. 山东省潍坊市临朐县人民医院, 山东 潍坊 262600
2. People's Hospital, Linqu County, Weifang City, Shandong Province, Weifang 262600, China
卵巢癌为妇科常见的恶性肿瘤之一,目前对于卵巢癌的治疗主要为手术联合以紫杉醇、铂类为主的化疗,但研究[1]显示其5年生存率无明显改善。很多学者致力于开发新的抗肿瘤药物,然而新型药物的研制耗时长、花费高、获得应用于临床的药物许可率低。因此,目前部分学者倾向于应用已被许可的非肿瘤适应证但却具有抗肿瘤作用的药物,以提高化疗敏感性,逆转化疗药物的耐药性。二甲双胍作为胰岛素增敏剂,临床主要用于糖尿病患者的治疗。近年来,研究[2]表明:二甲双胍和经典化疗药物联用可以增强化疗药物的敏感性, 有益于肿瘤的治疗。与单独使用化疗药物比较,二甲双胍能明显增强紫杉醇和顺铂等对乳腺癌、肺癌等细胞的抗增殖作用[2]。但二甲双胍联合紫杉醇对卵巢癌SKOV3细胞的体外抑瘤作用国内外研究较少。本研究以卵巢癌SKOV3细胞为主要研究对象,采用四甲基偶氮唑蓝 (MTT) 法和流式细胞术等方法观察不同浓度二甲双胍对卵巢癌SKOV3细胞增殖和凋亡的作用,并探讨二甲双胍是否能够增强紫杉醇对卵巢癌SKOV3细胞增殖的抑制作用、能否增强化疗药物的敏感性,以期为临床预防及治疗卵巢癌提供理论依据。
1 材料与方法 1.1 细胞和主要试剂卵巢癌SKOV3细胞由吉林大学中日联谊医院中心实验室提供。二甲双胍原药粉剂及紫杉醇、胰蛋白酶和碘化丙啶购自美国Sigma公司,胎牛血清和MTT购自上海拜力生物科技有限公司,DMED培养基购自美国Gibco公司,二甲亚砜 (DMSO) 购自上海源叶生物科技有限公司。
1.2 细胞培养卵巢癌SKOV3细胞加入到含10%胎牛血清的DMEMF12复合培养基中,于37℃、5%CO2的细胞培养箱中培养,每24h换液1次。待细胞融合度达90%时用0.25%含EDTA的胰酶对贴壁的SKOV3细胞消化,取处于对数生长期的细胞用于实验。
1.3 MTT法检测细胞增殖抑制率将处于对数生长期的SKOV3细胞稀释成1×104mL-1,之后将其加入96孔板中,每个孔中加入200 μL稀释液。当卵巢癌细胞贴壁生长24h后,更换含有二甲双胍浓度分别为0、0.01、0.50、1.00、5.00和10.00 mmol·L-1的复合培养基,继续培养24、48和72 h后,每孔中再加入MTT溶液20 μL,继续培养4h。之后弃掉培养基液体,每孔再加入DMSO 150 μL,震荡混匀使结晶物充分溶解。选择波长为490 nm,于酶联免疫吸附仪上测定各孔吸光度 (A) 值,计算细胞增殖抑制率。细胞增殖抑制率=(1-实验组A值/对照组A值)×100%。
1.4 流式细胞术检测细胞凋亡将处于对数生长期的SKOV3细胞按密度5×105mL-1接种于25 cm2培养瓶中,置于37℃、5% CO2细胞培养箱中培养,24 h后更换含有二甲双胍浓度为0、1、5和10 mmol·L-1的DMEMF12复合培养基,将其培养48 h后,用胰酶消化,1 500 r·min-1离心5 min,用PBS缓冲液冲洗2次后收集SKOV3细胞。细胞内加入1 mL冰浴预冷70%乙醇中,4℃固定24 h。1 000 r·min-1离心3~5 min,弃除上清,加入约1 mL冰浴预冷的PBS,重悬细胞。每管细胞样品中加入0.5 mL碘化丙啶染色液,将细胞沉淀缓慢并充分地重悬,37℃避光温浴30 min。采用流式细胞仪在激发波长488 nm处检测其红色荧光,同时检测光散射情况。分析各组细胞凋亡率。细胞凋亡率=凋亡细胞数/(凋亡细胞数+正常细胞数)×100%。
1.5 流式细胞术检测细胞周期按1.4中方法处理细胞后,流式细胞仪检测波长488nm处检测红色荧光,采用ModFit分析软件进行细胞DNA含量分析,根据各组细胞周期的细胞DNA含量计算各组细胞周期各时相细胞的百分率。
1.6 二甲双胍联合紫杉醇作用下SKOV3细胞的增殖率检测将SKOV3细胞悬液以1×104mL-1密度接种于96孔培养板中,每孔中加入200 μL细胞稀释液,置于37℃、5%CO2培养箱中培养24 h。分别将0.5和1.0 mmol·L-1的二甲双胍与600和1200 μg·L-1紫杉醇联合干预SKOV3细胞,以各浓度单纯二甲双胍、单纯紫杉醇和空白组做对照。每孔加入200 μL不同浓度二甲双胍与紫杉醇混合液,干预48h后,避光下每孔加入50g·L-1的MTT溶液20 μL,继续培养4h,避光下小心吸弃培养液,每孔中再加入150 μL DMSO溶液,震荡均匀,使结晶物充分溶解,酶标仪上490nm波长处检测各孔A值,计算细胞增殖抑制率。细胞增殖抑制率=(1-实验组A值/对照组A值)×100%。
1.7 统计学分析采用SPSS17.0统计软件进行统计学分析。各组细胞增殖抑制率和凋亡率均以x±s表示,多组间比较采用单因素方差分析,各组间均数两两比较采用SNK-q检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 不同浓度二甲双胍作用下卵巢癌SKOV3细胞增殖抑制率随着二甲双胍浓度的增加,卵巢癌SKOV3细胞增殖抑制率呈上升趋势。作用24 h,当二甲双胍浓度≥1 mmol·L-1时,各组SKOV3细胞增殖抑制率与其他组比较差异均有统计学意义 (P < 0.05);当二甲双胍浓度 < 1 mmol·L-1时,0.01 mmol·L-1与0.50 mmol·L-1组SKOV3细胞增殖抑制率比较差异无统计学意义 (P > 0.05)。作用48 h,与0.01 mmol·L-1组比较,0.50、1.00、5.00和10.00mmol·L-1组SKOV3细胞增殖抑制率明显升高,差异有统计学意义 (P < 0.05)。当作用72 h后,卵巢癌SKOV3细胞在药物作用后的增殖抑制率呈明显升高趋势,各浓度组间比较差异均有统计学意义 (P < 0.05)。随着药物干预时间的延长,细胞的增殖抑制率逐渐升高。不同时间各浓度组SKOV3细胞增殖抑制率比较:当浓度为0.01 mmol·L-1时,与作用24h时比较,作用72h时SKOV3细胞增殖抑制率明显升高,差异有统计学意义 (P < 0.05);当浓度> 0.50 mmol·L-1时,与作用24h时比较,各组作用48h时SKOV3细胞增殖抑制率明显升高,差异均有统计学意义 (P < 0.05)。见图 1。
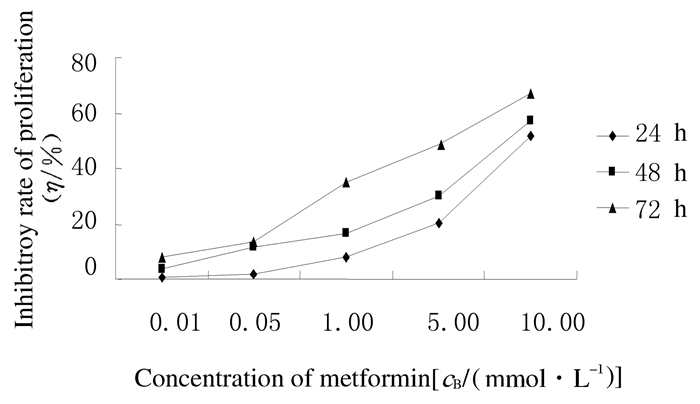
|
| 图 1 各组不同时间卵巢癌SKOV3细胞的增殖抑制率 Figure 1 Inhibitory rates of proliferation of SKOV3 cells at different time in various groops |
|
|
二甲双胍作用于卵巢癌SKOV3细胞48 h的流式细胞术结果显示:空白对照组和1.00、5.00、10.00mmol·L-1二甲双胍组卵巢癌SKOV3细胞的凋亡率分别为 (4.31±0.32)%、(11.81±0.58)%、(18.13±0.26)%和 (30.89±0.31)%;与空白对照组比较,随着二甲双胍浓度的增加,各实验组SKOV3细胞凋亡率均明显升高 (P < 0.05)。见图 2。
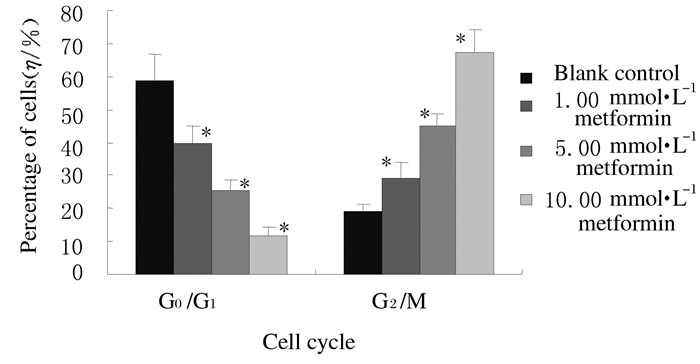
|
| 图 2 不同浓度二甲双胍作用48h后SKOV3细胞的凋亡率 Figure 2 Apoptotic rates of SKOV3 cells at 48h after treated with different concentrations of metformin |
|
|
流式细胞术结果显示:二甲双胍干预卵巢癌SKOV3细胞48h后,随着二甲双胍浓度的增加,G0/G1期细胞百分率逐渐下降 (P < 0.05),而G2/M期细胞百分率升高 (P < 0.05),表明二甲双胍干预卵巢癌SKOV3细胞导致细胞周期发生G2/M期阻滞,在G2/M期阻断细胞增殖。见图 3。
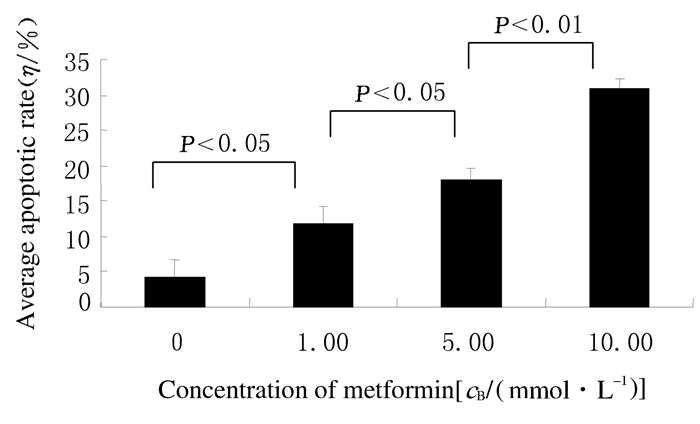
|
| * P < 0.05 compared with blank control group. 图 3 二甲双胍作用48h后各组SKOV3细胞周期 Figure 3 Cell cycle of SKOV3 cells at 48 h after treated with metformin in various groups |
|
|
将0.50和1.00 mmol·L-1二甲双胍与紫杉醇联合干预SKOV3细胞,48 h后MTT检测细胞增殖情况,结果显示:紫杉醇与不同浓度二甲双胍联合后,随着二甲双胍浓度的增加,SKOV3细胞增殖抑制率增加。1.00 mmol·L-1二甲双胍与紫杉醇联合用药组SKOV3细胞增殖抑制率高于0.50 mmol·L-1二甲双胍与紫杉醇联合用药组 (P < 0.05)。二甲双胍与紫杉醇联合用药组SKOV3细胞增殖抑制率高于单独紫杉醇组 (P < 0.05)。见图 4。
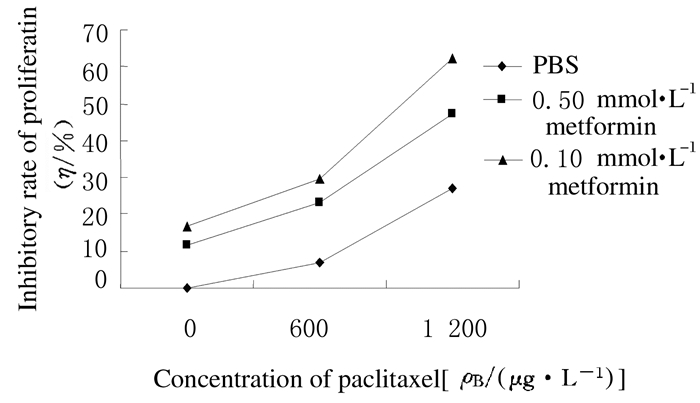
|
| 图 4 二甲双胍联合紫杉醇作用下卵巢癌SKOV3细胞增殖抑制率 Figure 4 Inhibitory rates of proliferation of SKOV3 cells after treated with metformin and paclitaxel |
|
|
近些年来,晚期和复发型卵巢癌在治疗过程中所面临的最主要问题是化疗耐药及化疗敏感性差。因此,寻找化疗增敏剂、增强化疗敏感性、同时降低化疗药物剂量是临床医师有待攻克的课题。二甲双胍是胰岛素增敏剂,其具有疗效性好、安全性高的特点,长期给药不良反应少。临床多用于降低血糖、改善脂代谢和治疗多囊卵巢综合征等[3-4]。在妇科肿瘤方面,一些临床前研究也表明二甲双胍对于子宫内膜癌、卵巢癌及宫颈癌均有抑制其肿瘤细胞生长的作用;临床研究[5]表明:对于口服二甲双胍的糖尿病患者,其肿瘤发生率低,当并发有卵巢癌及子宫内膜癌时,其预后也较好。所以临床上二甲双胍长期给药治疗肿瘤会有较高的临床价值及广阔的应用前景。
二甲双胍对肿瘤细胞增殖的抑制作用机制尚不明确。学者[6-8]认为:二甲双胍的抗卵巢癌作用是多面性的。二甲双胍能够激活AMPK信号转导通路及下游靶点,包括抑制mTOR通路,且能够调节细胞周期、诱导细胞周期停滞、上调促凋亡基因和下调抑凋亡基因等。同时,二甲双胍被认为能够抑制卵巢癌细胞黏附、侵袭和转移[9],抑制脂肪细胞诱导的肿瘤细胞增殖及转移[10]。在卵巢癌的小鼠模型实验[8-9]中,二甲双胍能够降低肿瘤负荷,与应用安慰剂组小鼠比较,二甲双胍组小鼠的肿瘤质量降低60%。最近的一项研究[8]表明:二甲双胍能够通过诱导细胞周期停滞及增强肿瘤对紫杉醇的敏感性来预防肿瘤生长。Shank等[11]在一项体内、体外实验中证实:单独使用二甲双胍及二甲双胍联合顺铂能够抑制卵巢癌干细胞的生长。
在临床应用方面,一项针对1611例卵巢癌患者的病例对照研究[12]显示:长期应用二甲双胍能够降低卵巢癌风险。有文献[13-14]评价了二甲双胍对卵巢癌患者生存率的影响,均认为二甲双胍能够提高卵巢癌患者的生存率。一项卵巢癌患者回顾性分析[13]中,发现并发糖尿病并口服二甲双胍的患者5年无进展生存率为51%,而无糖尿病患者为23%、并发糖尿病未口服二甲双胍者生存率为8%。5年总体生存率分别为63%、37%和23%。另一独立研究[14]发现:服用二甲双胍的卵巢癌患者其生存率明显改善。并发糖尿病并口服二甲双胍的卵巢癌患者与非糖尿病卵巢癌患者相比预后较好。研究[15]表明:紫杉醇可以引起血糖异常升高,诱发或加重糖尿病的细胞毒性药物,并能够损害胰腺β细胞,抑制合成及分泌胰岛素,因此并发糖尿病的卵巢癌患者预后较差。
综上所述,二甲双胍能够抑制卵巢癌SKOV3细胞的增殖,诱导卵巢癌细胞凋亡,并能够增强紫杉醇的化疗敏感性。二甲双胍的抗肿瘤作用需进一步研究,二甲双胍联合紫杉醇治疗卵巢癌具有较高的临床价值及广阔的应用前景。
[本文为张贝贝硕士研究生毕业论文的一部分]
| [1] | 丰有吉. 卵巢癌初始治疗现状与挑战[J]. 中国实用妇科与产科杂志, 2012, 28(3): 161–162. |
| [2] | Cazzaniga M, Bonanni B. Relationship between metabolic reprogramming and mitochondrial activity in cancer cells. Understanding the anticancer effect of metformin and its clinical implications[J]. Anticancer Res, 2015, 35(11): 5789–5796. |
| [3] | Tseng CH. Metformin reduces gastric cancer risk in patients with type 2 diabetes mellitus[J]. Aging (Albany NY), 2016, 8(8): 1636–1649. |
| [4] | Fujita K, Iwama H, Miyoshi H, et al. Diabetes mellitus and metformin in hepatocellular carcinoma[J]. World J Gastroenterol, 2016, 22(27): 6100–6113. DOI:10.3748/wjg.v22.i27.6100 |
| [5] | Febbraro T, Lengyel E, Romero IL. Old drug, new trick:repurposing metformin for gynecologic cancers[J]. Gynecol Oncol, 2014, 135(3): 614–621. DOI:10.1016/j.ygyno.2014.10.011 |
| [6] | Poli G, Cantini G, Armignacco R, et al. Metformin as a new anti-cancer drug in adrenocortical carcinoma[J]. Oncotarget, 2016, 7(31): 49636–49648. |
| [7] | Vallianou NG, Evangelopoulos A, Kazazis C. Metformin and cancer[J]. Rev Diabet Stud, 2013, 10(4): 228–235. DOI:10.1900/RDS.2013.10.228 |
| [8] | Lengyel E, Litchfield LM, Mitra AK, et al. Metformin inhibits ovarian cancer growth and increases sensitivity to paclitaxel in mouse models[J]. Am J Obstet Gynecol, 2015, 212(4): 479e1–479e10. DOI:10.1016/j.ajog.2014.10.026 |
| [9] | Wu B, Li S, Sheng L, et al. Metformin inhibits the development and metastasis of ovarian cancer[J]. Oncol Rep, 2012, 28(3): 903–908. |
| [10] | Tebbe C, Chhina J, Dar SA, et al. Metformin limits the adipocyte tumor-promoting effect on ovarian cancer[J]. Oncotarget, 2014, 5(13): 4746–4764. DOI:10.18632/oncotarget |
| [11] | Shank JJ, Yang K, Ghannam J, et al. Metformin targets ovarian cancer stem cells in vitroand in vivo[J]. Gynecol Oncol, 2012, 127(2): 390–397. DOI:10.1016/j.ygyno.2012.07.115 |
| [12] | Bodmer M, Becker C, Meier C, et al. Use of metformin and the risk of ovarian cancer:a case-control analysis[J]. Gynecol Oncol, 2011, 123(2): 200–204. DOI:10.1016/j.ygyno.2011.06.038 |
| [13] | Romero IL, McCormick A, McEwen KA, et al. Relationship of type Ⅱ diabetes and metformin use to ovarian cancer progression, survival, and chemosensitivity[J]. Obstet Gynecol, 2012, 119(1): 61–67. DOI:10.1097/AOG.0b013e3182393ab3 |
| [14] | Kumar S, Meuter A, Thapa P, et al. Metformin intake is associated with better survival in ovarian cancer:a case-control study[J]. Cancer, 2013, 119(3): 555–562. |
| [15] | Anisimov VN, Berstein LM, Egormin PA, et al. Effect of metformin on life span and on the development of spontaneous mammary tumors in HER-2/neu transgenic mice[J]. Exp Gerontol, 2005, 40(8/9): 685–693. |
 2017, Vol. 43
2017, Vol. 43


