扩展功能
文章信息
- 柳康, 王敬龙, 杨军星, 宋立杰, 徐一驰, 赵楚翘, 王瑶, 刘志辉, 王博蔚
- LIU Kang, WANG Jinglong, YANG Junxing, SONG Lijie, XU Yichi, ZHAO Chuqiao, WANG Yao, LIU Zhihui, WANG Bowei
- 载VEGF/万古霉素的多层缓释微球对人胎盘源间充质干细胞增殖与成骨分化的影响
- Influence of multilayersustained-release microspheres loading VEGF and vancomycin in proliferation and osteogenic differentiation of HPMSCs
- 吉林大学学报(医学版), 2017, 43(02): 250-254
- Journal of Jilin University (Medicine Edition), 2017, 43(02): 250-254
- 10.13481/j.1671-587x.20170208
-
文章历史
- 收稿日期: 2016-10-25
2. 温州医科大学口腔医学院附属口腔医院牙周病科, 浙江 温州 325000;
3. 吉林大学第二医院妇产科, 吉林 长春 130041
2. Department of Periodontics, Affiliated Stomatology Hospital, School of Stomatology, Wenzhou Medical Univensity, Wenzhou 325000, China;
3. Department of Obstetrics and Gynecology, Second Hospital, Jilin University, Changchun 130041, China
由于感染、外伤、肿瘤或先天性疾病等原因导致的大段骨缺损的修复是亟待解决的临床难题。目前,自体骨移植是骨缺损修复的金标准,但自体骨来源有限且会增加患者痛苦。组织工程学的发展为骨缺损修复开辟了新的道路[1],其关键是促进移植后中心骨段血管化以保证血供[2-3],并控制局部微生物感染[4-5]。本课题组前期研究[6-7]所制备的多层海藻酸盐壳聚糖缓释微球,体外释放平稳持续,同时负载血管内皮生长因子 (vascular endothelial growth factor, VEGF) 和万古霉素 (vancomycin),兼具促血管生成和控制感染2种潜能。载VEGF/万古霉素的多层缓释微球是否影响人胎盘源间充质干细胞 (human placenta-derived mesenchymal stem cells, HPMSCs) 增殖与成骨分化尚未见报道。本研究探讨双重载药缓释微球对与之共培养的HPMSCs增殖活性、碱性磷酸酶 (alkalin phosphatase, ALP) 活性和钙盐沉积的影响,以期为载有VEGF/万古霉素的多层海藻酸盐壳聚糖缓释微球在组织工程骨修复大段骨缺损中的临床应用提供理论基础。
1 材料与方法 1.1 组织来源经产妇及家属知情同意,自吉林大学第二医院妇产科获取健康孕妇产后遗弃的足月胎盘组织。
1.2 HPMSCs培养在超净台内,用PBS清洗胎儿面胎盘组织至无血液残留,剪碎至约1 mm3大小,移入培养瓶,组织块间距约5 mm。翻转培养瓶并加5 mL含20%胎牛血清 (以色列BI公司) 的低糖DMEM培养基 (美国Hyclone公司) 中, 放入孵箱,倾斜静置2 h后正置培养瓶。每3 d更换培养液,细胞达到80%融合时用0.25%胰酶 (北京Biotopped公司) 消化至单个细胞传代培养,第3代细胞用于与缓释微球共培养。
1.3 缓释微球的制备采用前期实验[6-7]制备载有VEGF/万古霉素的多层海藻酸盐壳聚糖缓释微球及不含任何药物的空载微球,冻干后-20℃冷藏备用。为检测微球是否有菌,分别将开放环境与无菌环境制得的空载微球放入琼脂培养皿中于37℃细菌培养箱中培养3 d,观察微球染菌情况。
1.4 共培养后HPMSCs增殖率检测HPMSCs以每孔2×103个细胞的密度接种于96孔板中。分为载药微球组 (载药微球+HPMSCs)、空载微球组 (空载微球+HPMSCs) 和无球组 (仅HPMSCs),每组3复孔,分别于24、48和72h取出孔板,参照细胞增殖与活性检测试剂盒 (Cell Counting Kit-8, CCK-8) 说明书每孔加10 μL CCK-8试剂,孵育2 h后,全自动酶标仪 (美国Bio-Tek公司) 于450 nm处测定各孔吸光度 (A) 值, 以A值计算细胞增殖率。细胞增殖率=实验组A值/对照组A值。
1.5 共培养后HPMSCs成骨诱导分化检测HPMSCs以每孔2×104个细胞的密度接种于12孔板中。分为载药微球诱导组 (载药微球+HPMSCs+成骨诱导液)、空载微球诱导组 (空载微球+HPMSCs+成骨诱导液)、无球诱导组 (HPMSCs+成骨诱导液) 和非诱导组 (HPMSCs+PBS),每组设3复孔。细胞达70%融合时除非诱导组其他3组均更换成骨诱导液[8],每3d换液。连续诱导21d后弃诱导液,95%乙醇4℃固定20 min,每孔加1 mL茜素红染液,孵育30 min,PBS冲洗后倒置显微镜下观察钙盐沉积情况。连续诱导21d后取另一块12孔板弃诱导液,每孔加100 μL细胞裂解液,吹打混匀,参照ALP试剂盒说明书各孔加入双蒸水、酚标准品、待测样本,缓冲液及基质液混匀,孵育15 min后加显色剂震荡混匀,于529 nm处检测A值。以A值表示ALP活性,A值越大,ALP活性越高。
1.6 统计学分析采用SPSS16.0统计软件进行统计学分析。各组HPMSCs细胞增殖活性和ALP活性以x±s表示,组间比较采用单因素方差分析。以P < 0.05为差异有统计学意义。
2 结果 2.1 倒置显微镜下观察HPMSCs形态表现原代培养约5d时有细胞开始从组织块中爬出,约14d时组织块周围细胞聚集成簇,细胞呈长梭形或多角形 (图 1A)。传代后细胞增殖速度较快,至第3代HPMSCs细胞呈长梭形,细胞聚集成旋涡状或栅栏状 (图 1B)。

|
| A:Primary cells cultured for 14 d; B:HPMSCs at passage3. 图 1 倒置显微镜观察HPMSCs形态表现 Figure 1 Morphology of HPMSCs observed under inverted microscope |
|
|
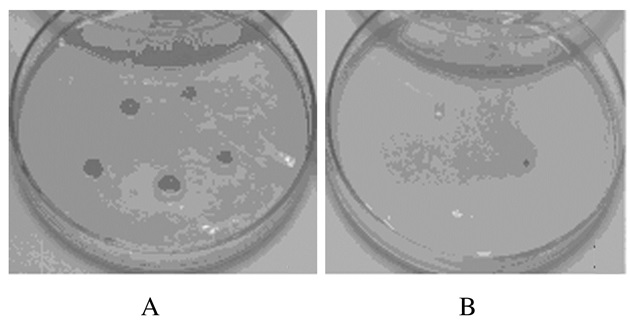
微球大小均匀,光滑圆整,直径900~1100 μm。开放环境制备的微球周边有菌落生成,而无菌环境制备的微球周边未见菌落。见图 2。
|
| A:Oper enviroment; B:Aseptic condition. 图 2 微球无菌性检测 Figure 2 Sterile detection of microspheres |
|
|
微球与HPMSCs共培养后细胞形态无明显变化,微球浸入培养液后体积溶胀变大。见图 3。

|
| 图 3 与HPMSCs共培养后微球的形态表现 Figure 3 Morphology of microspheres after co-cultured with HPMSCs |
|
|
微球与HPMSCs共培养后细胞的增殖率在载药微球组、空载微球组和无球组之间各时间点比较差异均无统计学意义 (P > 0.05)。见表 1。
| (n=3, x±s, η/%) | |||
| Group | Proliferation rate | ||
| (t/h) 24 | 48 | 72 | |
| HPMSCs | 100.00±0.02 | 100.00±0.07 | 100.00±0.05 |
| Drug-loaded microspheres+HPMSCs | 88.97±0.11 | 92.28±0.08 | 95.68±0.06 |
| Microspheres+HPMSCs | 63.48±0.10 | 84.19±0.25 | 89.82±0.05 |
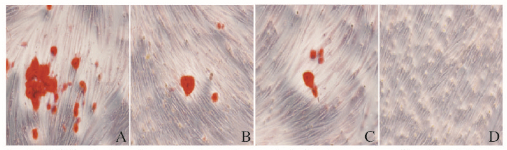
成骨诱导21d后茜素红染色显示:载药微球诱导组钙盐沉积明显多于空载微球诱导组、无球诱导组和非诱导组,但空载微球诱导组与无球诱导组比较无明显差别。见图 4(插页三)。
|
| A:HMPSCs+drug-loaded microspheres+induction group; B: HMPSCs+microspheres+induction group; C: HMPSCs+induction; D: HMPSCs+PBS group. 图 4 共培养后HMPSCs成骨诱导茜素红染色结果 Figure 4 Results of Alizarin red staining of co-cultured HPMSCs after osteogenic induction |
|
|
HPMSCs成骨诱导21d后ALP活性检测结果显示:载药微球诱导组细胞内ALP活性明显高于空载微球诱导组和无球诱导组 (P < 0.05),空载微球诱导组细胞ALP活性高于无球诱导组 (P < 0.05),无球诱导组细胞ALP活性高于非诱导组 (P < 0.05)。见表 2。
| (n=3, x±s) | |
| Group | ALP activity |
| HPMSCs+PBS | 0.75±0.01 |
| HPMSCs+induction | 0.86±0.04# |
| Microspheres+HPMSCs+induction | 0.91±0.02△ |
| Drug-loaded microspheres+HPMSCs+ induction | 0.96±0.01△ |
| *P < 0.05 compared withmicrospheres+HPMSCs+induction group; △P < 0.05 compared with HPMSCs+induction group; #P < 0.05 compared with HPMSCs+PBS group. | |
组织工程学是一门将细胞生物学和材料学相结合,在体外或体内构建组织器官的新兴学科。近年来骨组织工程研究取得了瞩目进展, 主要集中在种子细胞、支架材料和构建方式3个方面。HPMSCs具有发育上的原始性,相对于其他来源的成体干细胞具有更好的多向诱导分化能力,在特定诱导环境下可以向成骨细胞、成脂肪细胞和内皮细胞等定向分化[8-10]。HPMSCs易于获取且稳定安全[11], 是骨组织工程中极具应用前景的种子细胞来源。目前常用的支架材料是天然高分子可降解材料,具有良好的生物相容性,海藻酸钙水凝胶有利于细胞的附着和营养代谢产物的交换,将其与壳聚糖复合后,可明显提高其机械性能,并可通过调整两者的比例,实现细胞黏附和聚集体的调控[12]。
复杂大段骨缺损中心部位血供受限且常并发感染,单纯的组织工程骨移植很有可能会因为营养不足和局部感染而导致移植失败。VEGF能够促进局部血管再生[13-14],但VEGF体内半衰期短,大剂量给药易导致血管瘤,直接应用难以奏效。万古霉素是治疗骨和关节感染的常用抗生素[15-16],具有强大的抗菌作用,尤其对耐甲氧西林金黄色葡萄球菌属和肠球菌属。海藻酸盐壳聚糖微球作为药物载体能够持续缓慢地释放药物,提高生物利用度,已广泛用于免疫和癌症等研究[17-19]。本课题组前期实验[6-7]制备的载VEGF/万古霉素的多层海藻酸盐壳聚糖缓释微球,是将VEGF包载于最内层海藻酸钙核心球,将万古霉素包载于外层的壳聚糖。在体外,由于外层的阻滞作用,VEGF有2个释放高峰,维持较长时间有利于骨缺损部位的血管再造;而万古霉素的释放开始较快较多,之后逐渐减缓,既能达到控制感染的目的,又能避免不良反应的产生。
本实验研究了双重载药缓释微球对与之共培养的HPMSCs增殖活性和成骨分化能力的影响。在HPMSCs增殖活性检测中,载药微球组、空载微球组和无球组HPMSCs增殖水平接近,无明显差异,表明缓释微球对与之共培养的HPMSCs的增殖无影响,可以用于与HPMSCs共培养的实验研究。在HPMSCs成骨分化能力检测中,茜素红染色证实经过成骨诱导的3个实验组中均有钙盐沉积,载药微球诱导组钙盐沉积明显多于空载微球诱导组和无球诱导组。研究[20]表明:VEGF对成骨细胞的生长、分化和趋化有一定的直接作用。在成骨前体细胞体外培养时发现:分化早期其表达少量VEGF,随着细胞分泌钙质,加入VEGF可以促进钙结节形成[21]。本研究中ALP活性各组间比较差异有统计学意义,从高到低分别为载药微球诱导组、空载微球诱导组、无球诱导组和非诱导组。应用VEGF能增强成骨细胞ALP活性[22]。本研究中载药微球诱导组ALP活性高于空载微球诱导组;载药微球诱导组和空载微球诱导组ALP活性均高于无球诱导组。研究[23]表明:藻酸盐可以促进细胞内ALP合成量的增加,微球内有海藻酸盐成分,溶胀后可释放入培养基中。
综上所述,载VEGF/万古霉素的多层海藻酸盐壳聚糖缓释微球对HPMSCs增殖活性无明显影响,且能提高HPMSCs的成骨分化能力,有望和HPMSCs一起应用于组织工程骨的构建。但生物体内环境复杂,双重载药微球的体内缓释情况及其生物效应还需进一步研究。
| [1] | Jin HH, Kim DH, Kim TW, et al. In vivo evaluation of porous hydroxyapatite/chitosan-alginate composite scaffolds for bone tissue engineering[J]. Int J Biol Macromol, 2012, 51(5): 1079–1085. DOI:10.1016/j.ijbiomac.2012.08.027 |
| [2] | Chimutengwende-Gordon M, Khan WS. Advances in the use of stem cells and tissue engineering applications in bone repair[J]. Curr Stem Cell ResTher, 2012, 7(2): 122–126. DOI:10.2174/157488812799219036 |
| [3] | 段鑫, 李伟, 项舟. 组织工程骨血管生成的研究进展[J]. 中国修复重建外科杂志, 2015, 29(2): 239–244. |
| [4] | Cevher E, Orhan Z, Mülazimoglu L, et al. Characterization of biodegradable chitosan microspheres containing vancomycin and treatment of experimental osteomyelitis caused by methicillin-resistant Staphylococcus aureus with prepared microspheres[J]. Int J Pharm, 2006, 317(2): 127–135. DOI:10.1016/j.ijpharm.2006.03.014 |
| [5] | Makarov C, Gotman I, Radin S, et al. Vancomycin release from bioresorbable calcium phosphate-polymer composites with high ceramic volume fractions[J]. J Mater Sci, 2010, 45(23): 6320–6324. DOI:10.1007/s10853-010-4444-1 |
| [6] | 杨军星, 王琦, 王媛媛, 等. 双重载药多层海藻酸盐-壳聚糖缓释微球的制备及体外释放[J]. 高等学校化学学报, 2015, 36(5): 1025–1032. |
| [7] | 刘志辉, 王博蔚, 韩舒, 等. 一种载VEGF和万古霉素的多层缓释微球制剂、制备方法及应用[P]. 中国. 发明专利, 2014104059767. 2016-09-07. |
| [8] | 刘春丽, 刘志辉, 王博蔚, 等. 人胎盘源间充质干细胞多向分化潜能的实验研究[J]. 中国实验诊断学, 2009, 13(8): 1022–1024. |
| [9] | Liu ZH, Meng GW, Wang BW, et al. Research on human placenta-derived mesenchymal stem cells transfected with plRES2-EGFP-VEGF165 using liposome[J]. Afr J Biotechnol, 2011, 10(40): 7727–7735. DOI:10.5897/AJB |
| [10] | 刘志辉, 周延民, 王博蔚, 等. 体外定向诱导人胎盘源间充质干细胞向内皮细胞分化[J]. 吉林大学学报:医学版, 2010, 36(3): 500–504. |
| [11] | 王敬龙, 金巨楼, 杜冰, 等. 胎盘源间充质干细胞的分子生物学特性[J]. 中华细胞与干细胞杂志:电子版, 2013, 3(1): 27–30. |
| [12] | 张伟骏, 张坤玺, 李贵飞, 等. 海藻酸钠和壳聚糖静电复合弹性支架的制备和表征[J]. 高等学校化学学报, 2015, 36(4): 758–764. |
| [13] | Herzog DP, Dohle E, Bischoff I, et al. Cell communication in a coculture system consisting of outgrowth endothelial cells and primary osteoblasts[J]. Biomed Res Int, 2014, 2014: 320123. |
| [14] | Wu X, Hou T, Luo F, et al. Vascular endothelial growth factor and physiological compressive loading synergistically promote bone formation of tissue-engineered bone[J]. Tissue Eng Part A, 2013, 19(21/22): 2486–2494. |
| [15] | Loc-Carrillo C, Wang C, Canden A, et al. Local intramedullary delivery of vancomycin can prevent the development of long bone Staphylococcus aureusinfection[J]. PLoS One, 2016, 11(7): e0160187. DOI:10.1371/journal.pone.0160187 |
| [16] | Parent M, Magnaudeix A, Delebassée S, et al. Hydroxyapatite microporous bioceramics as vancomycin reservoir:Antibacterial efficiency and biocompatibility investigation[J]. J Biomater Appl, 2016, 31(4): 488–498. DOI:10.1177/0885328216653108 |
| [17] | Borges O, Silva M, de Sousa A, et al. Alginate coated chitosan nanoparticles are an effective subcutaneous adjuvant for hepatitis B surface antigen[J]. Int Immunopharmacol, 2008, 8(13/14): 1773–1780. |
| [18] | Abdelghany SM, Schmid D, Deacon J, et al. Enhanced antitumor activity of the photosensitizer meso-Tetra (N-methyl-4-pyridyl) porphine tetra tosylate through encapsulation in antibody-targeted chitosan/alginate nanoparticles[J]. Biomacromolecules, 2013, 14(2): 302–310. DOI:10.1021/bm301858a |
| [19] | 汪程, 汪令伟, 史晓宇, 等. 海藻酸钠壳聚糖微球作为药物载体的研究进展[J]. 现代生物医学进展, 2014, 14(16): 3174–3176. |
| [20] | 蒋佳, 范存义, 曾炳芳. 慢病毒介导BMP2和VEGF165基因共转染对骨髓基质干细胞成骨分化的影响[J]. 上海交通大学学报:医学版, 2011, 31(6): 753–758. |
| [21] | Deckers MM, Karperien M, van der Bent C, et al. Expression of vascular endothelial growth factors and their receptors during osteoblast differentiation[J]. Endocrinology, 2000, 141(5): 1667–1674. DOI:10.1210/endo.141.5.7458 |
| [22] | Street J, Bao M, Deguzman L, et al. Vascular endothelial growth factor stimulates bone repair by promoting angiogenesis and bone turnover[J]. Proceed Nat Acad Sci, 2002, 99(15): 9656–9661. DOI:10.1073/pnas.152324099 |
| [23] | 侯天勇, 许建中, 李强, 等. 间充质干细胞在藻酸盐微球溶液中增殖和分化的实验研究[J]. 中国矫形外科杂志, 2006, 14(23): 1816–1819. |
 2017, Vol. 43
2017, Vol. 43


