扩展功能
文章信息
- 曲萌, 董佳婧, 姜锐, 崔继春, 孙坤洋, 董志恒, 孙立伟
- QU Meng, DONG Jiajing, JIANG Rui, CUI Jichun, SUN Kunyang, DONG Zhiheng, SUN Liwei
- 红参发酵产物对高糖下大鼠肾小球系膜细胞增殖和细胞外基质降解的影响
- Influence of fermented red ginseng extract in proliferation of rat glomerularmesangial cellsand extracellular matrix degradation under high sugar stimulation
- 吉林大学学报(医学版), 2017, 43(02): 245-249
- Journal of Jilin University (Medicine Edition), 2017, 43(02): 245-249
- 10.13481/j.1671-587x.20170207
-
文章历史
- 收稿日期: 2016-04-25
2. 北华大学化学与生物学院吉林省中药 生物技术创新中心, 吉林 吉林 132013;
3. 吉化集团公司总医院门诊部, 吉林 吉林 132021;
4. 吉林大学 药学院实验药理与毒理学教研室, 吉林 长春 130021;
5. 北华大学基础医学院病理学教研室, 吉林 吉林 132013
2. Jilin Province Chinese Medical Biotechnology Innovation Center, College of Chemistry and Biology, Beihua University, Jilin 132013, China;
3. Department of Outpatient, General Hospital, Jilin Chemical Industry Corporation, Jilin 132021, China;
4. Department of Experimental Pharmacology and Toxicology, School of Pharmacy, Jilin University, Changchun 130021, China;
5. Department of Pathology, College of Basic Medical Sciences, Beihua University, Jilin 132013, China
作为糖尿病肾病 (diabetic nephropathy, DN) 的主要靶细胞,肾小球系膜细胞 (glomerulus mesangial cells, GMCs) 在高糖的刺激下增生,分泌大量细胞因子,合成大量的系膜基质,引起肾小球基膜增厚和细胞外基质 (extracellular matrix, ECM) 积聚,导致肾小球硬化,同时,ECM的降解受到抑制也在肾小球硬化过程中起着重要的作用[1]。因此探索抑制GMCs增殖、促进ECM降解的药物,对延缓DN的发生发展具有重要的临床意义。红参发酵产物 (fermented red ginseng extract,FRGE) 是以红参为原材料发酵后制备的,与红参比较,其活性成分更易被肠道吸收,研究[2-5]表明:红参发酵后具有抗氧化、抗炎、降糖和抗肿瘤等生物学活性,但其对高糖下大鼠GMCs增殖及ECM降解的影响尚未见报道。本研究以大鼠GMCs为研究对象,观察FRGE对高糖诱导下大鼠GMCs增殖、Ⅳ型胶原蛋白 (type Ⅳ collagen, Col Ⅳ)、基质金属蛋白酶2(matrix metalloproteinase-2, MMP-2) 及其组织抑制剂2(tissue inhibitor of metalloproteinase-2, TIMP-2) 蛋白表达的影响,旨在探讨FRGE对DN的防治作用及可能机制。
1 材料与方法 1.1 实验细胞株和主要试剂正常大鼠GMCs (HBZY-1) 购于中国医学科学院基础医学研究所细胞中心。Col Ⅳ酶联免疫试剂盒购于武汉博士德生物工程公司,兔抗MMP-2、TIMP-2多克隆抗体、鼠抗β-actin单克隆抗体和ECL增强发光试剂盒购于美国Santa Cruz公司,抗兔二抗和抗鼠二抗购于北京中杉金桥生物技术有限公司,FRGE由北华大学化学与生物学院吉林省中药生物技术创新中心提供,其他试剂均为国产分析纯。
1.2 GMCs的培养从液氮中取出大鼠GMCs的冻存管后,迅速复苏,接种于含15%胎牛血清 (FBS) 的DMEM低糖培养基中,5% CO2、37℃培养,24 h半量换液,以后每2~3 d完全更换培养液1次,换液过程中逐渐将FBS浓度降为10%,待长满平底后0.25%胰酶消化,进行细胞传代。
1.3 FRGE的配制以红参为原材料,酶法发酵后制备提取产物,工艺流程由北华大学化学与生物学院吉林省中药生物技术创新中心改良、操作并对产物进行了组分的鉴定,本实验使用红参发酵后的多组分混合物,包含有蛋白、寡糖、多糖和皂苷等成分,将获得的棕红色粉末状产物称质量后以DMEM高糖培液配成3.75、7.50和15.00 mg·L-1 3个浓度。
1.4 MTT法检测不同培养条件下GMCs的增殖率取第5代GMCs,采用含15%FBS的DMEM低糖培养液,以1×104 mL-1接种于96孔板中,贴壁后同步化 (含0.5%FBS的DMEM低糖培养液)24 h,分别加入DMEM低糖培养液 (NG组)、DMEM高糖培液 (HG组)、高糖+3.75 mg·L-1 FRGE (FRGE低剂量组,FL组)、高糖+ 7.50 mg·L-1 FRGE (FRGE中剂量组,FM组) 和高糖+15.00 mg·L-1 FRGE (FRGE高剂量组,FH组),每组设5个复孔,继续培养24、48和72 h。在预定时间点,每孔加入5 g·L-1 MTT溶液20 μL,37℃继续孵育4 h,弃去孔内上清,150 μL每孔加入DMSO,震荡溶解结晶物10 min,于酶标仪490 nm处检测各孔吸光度 (A) 值,并计算细胞增殖率。细胞增殖率=实验组A值/对照组A值×100%。
1.5 培养上清液中Col Ⅳ水平检测收集各组细胞的培养液上清,严格按照酶联免疫吸附法 (ELISA) 试剂盒说明书要求操作。依据标准曲线计算各实验组细胞上清中Col Ⅳ的水平,单位为μg·L-1。
1.6 Western blotting法检测各组GMCs中MMP-2和TIMP-2蛋白表达水平各实验组作用48 h后,收集细胞,检测GMCs中MMP-2和TIMP-2蛋白表达水平。每组样品各加入50 μL蛋白裂解液,4℃、2 h,10 000 r·min-1离心5 min,留上清,测定浓度并定量后加入上样缓冲液,煮沸5 min,使其变性,各取50 μg蛋白样品上样,10% SDS-PAGE电泳,20 mA出浓缩胶后调至40 mA恒流继续电泳约30 min,15 mA电转移至PVDF膜;含5%脱脂奶粉封闭1 h;按说明书所示比例,将各一抗加入封闭液中, 4℃孵育过夜,TBST振荡洗膜5 min×5;根据一抗选择相应的二抗,37℃孵育2 h,TBST洗膜;ECL增强发光试剂盒A和B液1:1显色处理;ECL发光仪进行图像采集及数据处理,蛋白表达水平=每个样本条带的A值/ GAPDH的A值。
1.7 统计学分析采用SPSS 13.0统计软件对数据进行统计学分析。各组细胞增殖率、Col Ⅳ水平、MMP-2和TIMP-2蛋白表达水平以x±s表示,多组间样本均数比较采用单因素方差分析。以P < 0.05为差异有统计学意义。
2 结果 2.1 各组GMCs增殖率MTT检测结果显示:与NG组比较,细胞培养24 h后,HG组GMCs增殖率升高 (P < 0.01);48 h后,达峰值 (P < 0.01);FL组和FM组24和48h时GMCs增殖率明显升高 (P < 0.05或P < 0.01);FH组24 h时GMCs增殖率明显升高 (P < 0.05),48 h时与NG组比较差异无统计学意义 (P > 0.05)。与HG组比较,不同浓度FRGE组24和48 h时GMCs增殖率均明显降低 (P < 0.01);细胞培养72 h后,HG和不同浓度FRGE组GMCs增殖率降低,但各组间比较差异无统计学意义 (P > 0.05)。见表 1。
| (n=5, x±s,η/%) | |||
| Group | Proliferation rate | ||
| (t/h) 24 | 48 | 72 | |
| NG | 100.00±1.21 | 100.00±1.04 | 100.00±2.07 |
| HG | 168.91±2.15** | 169.17±2.83** | 111.97±2.64 |
| FL | 152.33±2.43 **△ | 117.79±3.02**△ | 107.72±1.96 |
| FM | 125.39±2.33**△ | 110.67±2.67*△ | 104.63±2.17 |
| FH | 109.34±1.26*△ | 107.91±1.99△ | 101.16±1.65 |
| *P < 0.05,** P < 0.01 vs NG group;△ P < 0.01 vs HG group. | |||
与NG组比较,HG组培养24和48 h时GMCs培养上清中Col Ⅳ水平明显升高 (P < 0.01)。与HG组比较,不同浓度FRGE组培养24和48 h时GMCs培养上清中Col Ⅳ水平明显降低 (P < 0.01);其中FH组Col Ⅳ水平低于FL和FM组,但组间比较差异无统计学意义 (P > 0.05)。见表 2。
| [n=5, x±s, ρB/(μg·L-1)] | ||
| Group | Col Ⅳ level | |
| (t/h) 24 | 48 | |
| NG | 10.24±0.37 | 16.86±0.14 |
| HG | 13.16±0.41** | 25.60±0.47** |
| FL | 12.46±0.28 **△ | 19.79±0.24**△ |
| FM | 11.28±0.29*△ | 18.48±0.52*△ |
| FH | 11.01±0.23△ | 17.52±0.39△ |
| *P < 0.05,** P < 0.01 vs NG group;△P < 0.01 vs HG group. | ||
Western blotting检测结果显示:与NG组比较,HG、FL和FM组GMCs中MMP-2蛋白表达水平明显降低 (P < 0.05或P < 0.01)。与HG组比较,不同浓度FRGE组GMCs中MMP-2蛋白表达水平明显升高 (P < 0.01)。在NG组GMCs中TIMP-2蛋白呈弱表达 (0.31±0.03),与NG组比较,HG和FL组GMCs中TIMP-2蛋白表达水平明显升高 (P < 0.05或P < 0.01),FM和FH组GMCs中TIMP-2蛋白表达水平无明显变化 (P > 0.05);与HG组比较,高糖+不同浓度FRGE组TIMP-2蛋白表达水平明显降低 (P < 0.01)。见图 1。
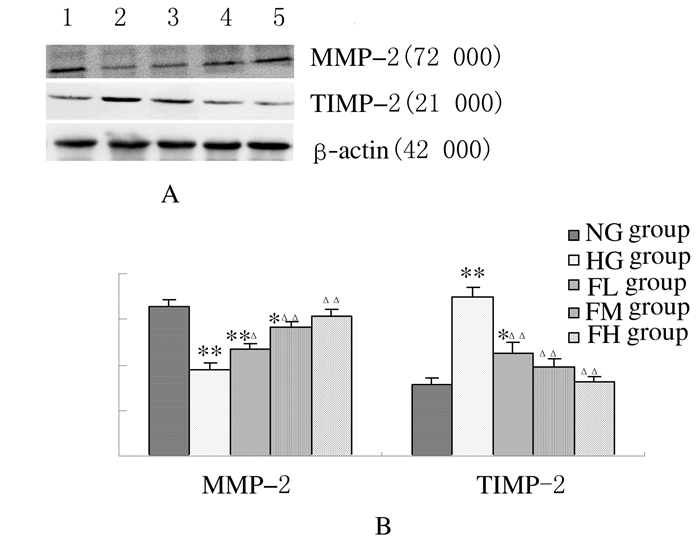
|
| Lane1:NG group; Lane2:HG group; Lane3:FL group; Lane4:FM group; Lane5:FH group. *P < 0.05, ** P < 0.01 vs NG group; △P < 0.05, △△ P < 0.01 vs HG group. 图 1 各组GMCs中MMP-2和TIMP-2蛋白表达电泳图 (A) 和直条图 (B) Figure 1 Electrophoregram (A) and histogram (B) of expressions of MMP-2 and TIMP-2 in GMCs in various groups |
|
|
人参作为我国的传统名贵药材具有多种生物学活性,以人参为原材料,蒸煮后所制备的红参是参的熟用品。红参在蒸制过程中,因为热处理会发生化学反应,成分发生变化,会生成水参及白参不具有的新成分,其抗氧化、降糖、提高免疫力和抑菌等活性增强。研究[6-7]显示:红参特有的活性物质人参三醇炔有抑制癌细胞增长的作用,麦芽醇具有抗氧化作用。而以红参为原材料发酵后所制备的发酵产物 (FRGE) 其多糖成分增加,皂苷发生转换,并产生新的活性物质如CK,与红参比较其活性成分更易被肠道吸收。
与红参比较,FRGE的生物学活性更强,如在动物模型中,只需用红参量1/3的FRGE即可达到相同的抗炎效果[8];红参发酵4 d后人参皂苷代谢产物从4637.0 mg·L-1增加到7581.1 mg·L-1,腹腔注射抑制肿瘤的转移率由66.9%增加到81.1%[9],其对乳腺癌细胞、肝癌细胞等肿瘤细胞的抑制作用也优于平行对照的红参组[2], 在玉米油诱导的高脂小鼠模型中,以人参皂苷Rh2为主要成分的FRGE比以人参皂苷Rg3为主要成分的红参更有效地降低血脂和血糖等[10-11],对餐后血糖也有下调作用[4]。
GMCs是肾小球固有细胞中最活跃的细胞,除具有分泌多种生物活性介质功能外,还具有收缩 (类似于平滑肌细胞)、增殖、吞噬大分子物质及合成系膜基质等多种功能。ECM主要由GMCs分泌产生,而肾小球硬化的关键为ECM积聚。因此,抑制GMCs的增生可有效地减少ECM的产生和堆积。本实验MTT法检测结果显示:各浓度FRGE均可显著地抑制高糖对GMCs的促增殖作用,同时随着时间的延长,抑制效果越为显著,呈现一定的浓度依赖关系。
在正常情况下,ECM处于生成与降解的动态平衡状态。而在病理条件下,ECM合成增多和 (或) 降解受抑引发ECM积聚,导致肾小球系膜增宽及肾间质纤维化。高糖可刺激多种细胞因子过度表达,促进ECM合成代谢[12]。基质金属蛋白酶 (MMPs)/基质金属蛋白酶组织抑制剂 (TIMPs) 系统是ECM降解中的重要酶系统[13],MMPs是一组重要的锌依赖的蛋白质,其参与了ECM的降解和转运, 并阻止ECM重塑,其中MMP-2主要降解底物是ECM的重要成分Col Ⅳ,TIMP-2是MMP-2的特异组织抑制剂,通过与MMP-2特异结合而阻止其对底物的降解作用, 对维持肾小球合成与降解的平衡、保证肾小球正常生理功能起着重要作用。近年来的研究[14-16]显示:通过调控MMP-2和TIMP-2的表达,可有效地延缓DN的进展。本实验结果显示:高糖可导致细胞培养上清中Col Ⅳ水平升高,并随着时间的延长,其促进效果增强,FRGE可明显降低Col Ⅳ水平,呈现一定的浓度依赖关系;FRGE可上调MMP-2蛋白表达水平,同时下调TIMP-2蛋白表达水平,从而促进ECM的降解,2种蛋白表达均呈剂量依赖关系,表达趋势相反,在各实验组中2种蛋白表达水平均呈负相关关系。此结果与姚芳等[17]使用高糖刺激大鼠GMCs 48 h所获得的结果基本一致。
综上所述,FRGE对高糖下GMCs增殖有抑制作用但对ECM降解有促进作用,提示一定浓度的FRGE可在一定程度下延缓肾小球硬化,防治DN的发生发展。但影响DN发生发展的因素很多,本实验仅从GMCs的增殖及ECM降解方面进行了初步探讨,有关FRGE对DN中肾脏的保护作用还需要更深入的研究。
| [1] | Thrailkill KM, Clay Bunn R, Fowlkes JL. Matrix metalloproteinases:their potential role in the pathogenesis of diabetic nephropathy[J]. Endocrine, 2009, 35(1): 1–10. DOI:10.1007/s12020-008-9114-6 |
| [2] | Oh J, Jeon SB, Lee Y. Fermented red ginseng extract inhibits cancer cell proliferation and viability[J]. J Med Food, 2015, 18(4): 421–428. DOI:10.1089/jmf.2014.3248 |
| [3] | Igami K, Shimojo Y, Ito H. Hepatoprotective effect of fermented ginseng and its major constituent compound K in a rat model of paracetamol (acetaminophen)-induced liver injury[J]. J Pharm Pharmacol, 2015, 67(4): 565–572. DOI:10.1111/jphp.2015.67.issue-4 |
| [4] | Chung SI, Rico CW, Kang MY. Comparative study on the hypoglycemic and antioxidative effects of fermented paste (doenjang) prepared from soybean and brown rice mixed with rice bran or red ginseng marc in mice fed with high fat diet[J]. Nutrients, 2014, 6(10): 4610–4624. |
| [5] | Oh Js, Lee SR, Hwang KT. The anti-obesity effects of the dietary combination of fermented red ginseng with levan in high fat diet mouse model[J]. Phytother Res, 2014, 28(4): 617–622. DOI:10.1002/ptr.v28.4 |
| [6] | Lee S, Lee YH, Park JM. Bioconversion of ginsenosides from red ginseng extract using Candida allociferrii JNO301 isolated from Meju[J]. Mycobiology, 2014, 42(4): 368–375. DOI:10.5941/MYCO.2014.42.4.368 |
| [7] | Lee SJ, Kim Y, Kim MG. Changes in the ginsenoside content during the fermentation process using microbial strains[J]. J Ginseng Res, 2015, 39(4): 392–397. DOI:10.1016/j.jgr.2015.05.005 |
| [8] | Lee EJ, Song MJ, Kwon HS, et al. Oral administration of fermented red ginseng suppressed ovalbumin-induced allergic responses in female BALB/c mice[J]. Phytomedicine, 2012, 19(10): 896–903. |
| [9] | Kim BG, Shin KS, Yoon TJ, et al. Fermentation of Korean red ginseng by Lactobacillus plantarum M-2 and its immunological activities[J]. Appl Biochem Biotechnol, 2011, 165(5/6): 1107–1119. |
| [10] | Shin SK, Kwon JH, Jeong YJ, et al. Supplementation of cheonggukjang and red ginseng cheonggukjang can improve plasma lipid profile and fasting blood glucose concentration in subjects with impaired fasting glucose[J]. J Med Food, 2011, 14(1/2): 108–113. |
| [11] | Trinh HT, Han SJ, Kim SW, et al. Bifidus fermentation increases hypolipidemic and hypoglycemic effects of red ginseng[J]. J Microbiol Biotechnol, 2007, 17(7): 1127–1133. |
| [12] | Zhang D, Shao S, Shuai H, et al. SDF-1α reduces fibronectin expression in rat mesangial cells induced by TGF-β1 and high glucose through PI3K/Akt pathway[J]. Exp Cell Res, 2013, 319(12): 1796–1803. DOI:10.1016/j.yexcr.2013.03.030 |
| [13] | Catania JM, Chen G, Parrish AR. Role of matrix metalloproteinases in renal pathophysiologies[J]. Am J Physiol Renal Physiol, 2007, 292(3): F905–F911. |
| [14] | 杨秀, 马立彬, 谢祥成. 大黄素对糖尿病大鼠肾组织基质金属蛋白酶-2及金属蛋白酶组织抑制剂-2表达的影响[J]. 中国糖尿病杂志, 2016, 24(2): 159–162. |
| [15] | Wang Z, Famulski K, Lee J, et al. TIMP2 and TIMP3 have divergent roles in early renal tubulointerstitial injury[J]. Kidney Int, 2014, 85(1): 82–93. DOI:10.1038/ki.2013.225 |
| [16] | 平橹, 孙艳艳, 方敬爱, 等. 芡实对糖尿病肾病大鼠肾组织MMP-9、TIMP-1及Collagen Ⅳ表达的影响[J]. 中国中西医结合肾病杂志, 2015, 16(7): 583–586. |
| [17] | 姚芳, 李志红, 闫吉吉, 等. 高糖刺激下大鼠肾小球系膜细胞MMP-2, TIMP-2, MT1-MMP和CTGF的表达及意义[J]. 解放军医学杂志, 2013, 38(10): 811–817. |
 2017, Vol. 43
2017, Vol. 43


