扩展功能
文章信息
- 郭小凯, 包幸福, 杨军星, 王玉琢, 李雨桐, 胡敏
- GUO Xiaokai, BAO Xingfu, YANG Junxing, WANG Yuzhuo, LI Yutong, HU Min
- 出生后小鼠牙不同发育期DKK1表达的形态学特点及其意义
- Morphological characteristics of expressions of DKK1 in different periods of tooth development in postnatal mice and their significances
- 吉林大学学报(医学版), 2017, 43(02): 241-244
- Journal of Jilin University (Medicine Edition), 2017, 43(02): 241-244
- 10.13481/j.1671-587x.20170206
-
文章历史
- 收稿日期: 2016-11-01
2. 吉林省牙发育及颌骨重塑与再生重点实验室, 吉林 长春 130021
2. Jilin Provincial Key Laboratory of Tooth Development and Bone Remodeling, Changchun 130021, China
牙发育从胚胎时期一直持续至青少年时期,上皮细胞和间充质细胞参与其中并相互调控,尽管既往研究[1]已有诸多突破,但具体调控机制尚未完全清楚。Wnt通路非常保守,参与人体多个组织的发育过程[2],有学者[3-5]报道:Wnt通路参与了牙胚的分化、牙齿形态调控和牙周组织形成等过程。Wnt通路抑制因子Dickkopf1(DKK1) 是Wnt信号通路中最重要的拮抗分子之一,能够特异性地抑制经典Wnt信号通路[6]。文献[7]报道:小鼠出生前,DKK1主要表达于牙源性的间充质细胞及其分化形成的前成牙本质细胞和成牙本质细胞,但小鼠出生后DKK1的表达情况尚未见通过相关报道。本研究探讨小鼠出生后牙发育情况与DKK1的表达特点,阐明DKK1在牙体组织和牙周组织发育中可能的作用,为阐明Wnt信号通路调控牙发育机制提供依据。
1 材料与方法 1.1 动物、主要试剂和仪器SPF级昆明母鼠购于北京华阜康生物科技股份有限公司,动物合格证号:SCXK (京)2014-0004。多聚甲醛和乙二胺四乙酸二钠 (北京酷来搏公司,中国),兔超敏二步法免疫组织化学试剂盒PV9001(北京中杉金桥公司,中国),酶修复液和PBS (武汉博士德公司,中国),兔抗小鼠DKK1多克隆抗体 (Santa Cruze公司,美国),DAB显色试剂盒 (福州迈新公司,中国)。中威BMJ-B型包埋机 (常州市中威电子仪器有限公司,中国),Shandong Finesse 325型石蜡切片机 (Thermo Fisher Scientific公司,美国)。
1.2 组织制备选择出生后第0.5、6.5、12.5、18.5、24.5和30.5天的昆明小鼠并按时间分组,每组3只,在相应时间点采用颈椎脱臼法处死小鼠。仔细剥离含有下颌第一磨牙的下颌骨组织,浸泡于4%多聚甲醛磷酸盐缓冲液1晚进行固定,流水冲洗后置于10%乙二胺四乙酸二钠溶液中,存放于4℃冰箱内进行脱钙,根据组织硬度脱钙时间为1~30 d不等。脱钙完全后用磷酸盐缓冲液冲洗,常规组织脱水,石蜡包埋,制作5 μm厚含有下颌第一磨牙的组织切片。
1.3 苏木素-伊红 (HE) 染色观察牙体和牙周组织的形态表现将切片进行二甲苯脱蜡3次,每次15 min;梯度乙醇水化,每个浓度中浸泡5 min;苏木素染色10 min;1%盐酸酒精分化3s;流水返蓝10s;1%伊红染色5 min;梯度乙醇脱水,每缸10s;二甲苯透明2次,每次5 min;中性树胶封片;光学显微镜下观察并照相。
1.4 免疫组织化学染色观察牙体和牙周组织中DKK1的表达按上述方法进行二甲苯脱蜡及梯度水化;酶消化液室温孵育15 min,进行抗原修复;磷酸盐缓冲液洗3次,每次2 min;随后3%过氧化氢溶液室温孵育10 min,磷酸盐缓冲液洗涤3次,每次2 min;滴加DKK1一抗 (1:80) 并在4℃孵育过夜,磷酸盐缓冲液洗涤3次,每次2min;按说明书将试剂1和试剂2分别室温孵育15 min,用磷酸盐缓冲液洗涤3次,每次2 min;DAB室温显色,光镜下控制反应时间 (约5 min),流水冲洗终止显色;苏木素复染2 min,梯度乙醇脱水,二甲苯透明,中性树胶封片,显微镜下观察并照相。阴性对照组由PBS代替一抗,其余步骤相同。以阴性对照为参照,无特异性染色者为阴性,细胞或组织呈黄色或棕黄色染色者为阳性,根据颜色的深浅来判断DKK1表达量的高低。
2 结果 2.1 HE染色观察牙体和牙周组织的形态表现在小鼠出生后第0.5天,下颌第一磨牙牙胚处于钟状晚期,可见明显的外釉上皮、内釉上皮和星网状层,此期尚无釉质形成。第6.5天时釉质发育已经基本完成,并可见矿化后的牙本质和未矿化的前期牙本质,成牙本质细胞整齐排列于前期牙本质的内侧,内外釉上皮细胞形成的上皮根鞘向根方延伸,提示牙根开始发育。第12.5天时釉质和冠部牙本质已经发育完成,牙根也已发育1/3,根部牙本质仍在发育中,此时下颌第一磨牙仍未萌出。第18.5天时牙齿已经萌出,牙冠由于脱钙处理而崩解消失,残留冠部牙本质,牙根形成约2/3,可在牙根的冠1/3处见到牙骨质,并能清晰看见牙周膜与牙槽骨结构。从第24.5到30.5天,牙根进一步发育,根尖孔逐渐闭合。见图 1(插页二)。
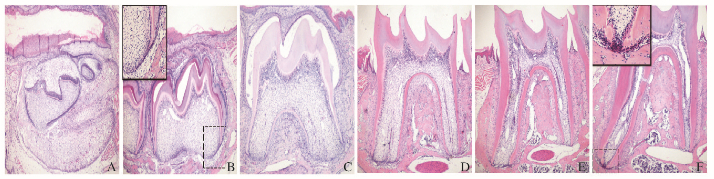
|
| A:0.5 d; B:6.5 d; C:12.5 d; D:18.5 d; E:24.5 d; F:30.5 d. 图 1 小鼠出生后不同时间牙和牙周组织的HE染色结果 (×40) Figure 1 HE staining results of tooth and periodontal tissues of mice at different time after birth (×40) |
|
|
阴性对照组未出现DKK1阳性表达。第0.5天时,牙胚组织中几乎无DKK1表达。第6.5天时,前期牙本质和成牙本质细胞中DKK1呈弱阳性表达,上皮根鞘组织呈现淡染黄色。第12.5天时,DKK1在前期牙本质、成牙本质细胞和牙周膜中呈阳性表达。第18.5天时,成牙本质细胞和前期牙本质中DKK1仍呈阳性表达,表达量基本未变化,而牙周膜黄色进一步加深,提示DKK1表达增强。第24.5天时,牙周膜中DKK1呈强阳性表达,成牙本质细胞和前期牙本质中表达也进一步加深,在根部的细胞性牙骨质中可见DKK1阳性表达的细胞。该表达特点一直延续至第30.5天,且牙髓组织在各时期均未见DKK1阳性表达。见图 2(插页二)。
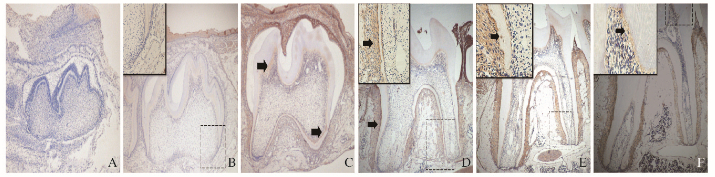
|
| A:0.5 d; B:6.6 d; C:12.5 d; D:18.5 d; E:24.5 d; F:30.5 d. 图 2 小鼠出生后不同时间牙组织中DKK1的表达 (免疫组织化学,×40) Figure 2 Expressions of DKK1 in tooth tissue of mice at different time after birth (Immunohistochemistry, ×40) |
|
|
胚胎发育时期,外胚层细胞和神经嵴来源的间充质细胞间经过多种信号刺激后,上皮内陷入间充质细胞并增厚形成牙胚,开始牙齿的发育过程。以往研究[7]发现了多条参与胚胎期间牙冠发育调控的信号通路,但是关于出生后牙发育的调控机制仍未完全清楚。Wnt信号通路是一条保守的通路,包括经典的Wnt-β连环蛋白通路和多条非经典信号通路,前者被认为在牙发育的不同时期发挥调控作用,例如持续激活上皮细胞中Wnt经典通路会形成畸形异位牙,而阻断Wnt经典通路会使磨牙牙尖圆钝并导致牙根吸收[8]。DKK1是经典Wnt通路的特异性抑制因子,含有266个氨基酸残基的分泌性糖蛋白[9]。DKK1抑制Wnt通路的机制之一是在胞外与激活剂竞争共受体LRP5/6[10],组织配体激活Wnt通路;另一个机制是DKK1与细胞膜受体Kremen1/2结合,引起LRP5/6内吞[11]。有学者[7]通过研究胚胎期小鼠牙胚发现:DKK1 mRNA表达于牙乳头细胞、前成牙本质细胞和成牙本质细胞;Han等[12]应用DKK1转基因小鼠模型研究发现:DKK1可以通过Wnt通路依赖或非依赖途径,调控小鼠出生后牙本质的形成、矿化和牙本质小管的形态维持等,这些证据均提示DKK1在牙本质发育中发挥重要作用,但是关于DKK1在出生后小鼠不同牙发育时期的表达特点还不清楚,本研究利用免疫组织化学染色方法观察了DKK1的时空表达特性。
小鼠出生0.5d时牙胚处于钟状期,几乎无DKK1表达,因为Wnt通路参与钟状期牙胚的发育过程[13],所以本文作者推测:DKK1的表达抑制与Wnt通路的激活有关。随着牙本质的发育形成,从6.5d开始,前期牙本质和成牙本质细胞中开始出现DKK1表达,并在牙本质发育完成后维持一定的表达水平。成牙本质细胞是形成牙本质的效应细胞,Wnt通路能动态调控成牙本质细胞的功能,持续激活Wnt通路能形成过厚的牙本质[14],而抑制Wnt通路能使成牙本质细胞分化受阻[15];结合本研究结果,可以推测DKK1作为Wnt通路的抑制剂,或许在牙本质发育中起负向调节作用,避免牙本质过度形成,与其在骨代谢中的作用类似。牙髓组织中除了外侧的成牙本质细胞外,几乎无阳性表达的细胞,提示DKK1主要在牙齿硬组织中发挥功能。
除了牙体组织,牙周组织中也出现了DKK1的阳性表达,其中牙周膜中DKK1的表达最多,且与牙根发育成熟程度呈正相关关系,说明DKK1参与牙周膜的形成和稳态维持。Wnt通路对于维持牙周膜宽度和牙周膜细胞的应力反应十分重要[16],DKK1可能通过抑制Wnt通路发挥对牙周膜的调控作用。在24.5 d时,细胞性牙骨质中出现了阳性表达的细胞,结合既往研究[12]推测:DKK1过表达会造成无细胞牙骨质部分缺失,可以确定DKK1也参与了牙骨质的发育和代谢过程,但是具体作用机制需待后续的研究。牙槽骨中也存在DKK1的阳性表达,有学者[17]报道DKK1过表达可以导致小鼠成骨细胞数量减少,小鼠发生骨质疏松。相反,如果敲除小鼠DKK1基因则表现为成骨能力的增强和骨总量的增加[18],这些可能是通过阻断经典Wnt信号通路实现的。DKK1在牙周组织的广泛性表达提示其可能在牙周稳态的维持和改建中发挥作用。除DKK1外,硬化蛋白也是Wnt经典通路的抑制剂,有学者[19]分析了牙根发育过程中硬化蛋白的表达特点,发现在成年小鼠的牙骨质和牙槽骨中有硬化蛋白的表达,与DKK1具有相似的组织分布,但是两者在牙周组织中的关系尚不清楚,需要今后进一步研究。
综上所述,出生后小鼠牙不同发育期牙体组织和牙周组织中DKK1的表达不同,本研究结果为阐明Wnt信号通路调控牙发育机制提供了依据。
| [1] | Tummers M, Thesleff I. The importance of signal pathway modulation in all aspects of tooth development[J]. J Exp Zool B Mol Dev Evol, 2009, 312(4): 309–319. |
| [2] | van Amerongen R, Nusse R. Towards an integrated view of Wnt signaling in development[J]. Development, 2009, 136(19): 3205–3214. DOI:10.1242/dev.033910 |
| [3] | Chen J, Lan Y, Baek JA, et al. Wnt/beta-catenin signaling plays an essential role in activation of odontogenic mesenchyme during early tooth development[J]. Develop Biol, 2009, 334(1): 174–185. DOI:10.1016/j.ydbio.2009.07.015 |
| [4] | Ahn Y, Sanderson BW, Klein OD, et al. Inhibition of Wnt signaling by Wise (Sostdc1) and negative feedback from Shh controls tooth number and patterning[J]. Development, 2010, 137(19): 3221–3231. DOI:10.1242/dev.054668 |
| [5] | Järvinen E, Birchmeier W, Taketo MM, et al. Continuous tooth generation in mouse is induced by activated epithelial Wnt/β-catenin signaling[J]. Proc Natl Acad Sci U S A, 2006, 103(49): 18627–18632. DOI:10.1073/pnas.0607289103 |
| [6] | Sarkar L, Sharpe PT. Expression of Wnt signalling pathway genes during tooth development[J]. Mech Dev, 1999, 85(1/2): 197–200. |
| [7] | Fjeld K, Kettunen P, Furmanek T, et al. Dynamic expression of Wnt signaling-related Dickkopf1, -2, and-3 mRNAs in the developing mouse tooth[J]. Dev Dyn, 2005, 233(1): 161–166. |
| [8] | Lim WH, Liu B, Hunter DJ, et al. Downregulation of Wnt causes root resorption[J]. Am Orthodon Dentofacial Orthop, 2014, 146(3): 337–345. DOI:10.1016/j.ajodo.2014.05.027 |
| [9] | Tai N, Inoue D. Anti-Dickkopf1 (Dkk1) antibody as a bone anabolic agent for the treatment of osteoporosis[J]. Clin Calcium, 2014, 24(1): 75–83. |
| [10] | Goldstein SD, Trucco M, Hayashi M, et al. A monoclonal antibody against the Wnt signaling inhibitor dickkopf-1 inhibits osteosarcoma metastasis in a preclinical model[J]. Oncotarget, 2016, 7(16): 21114–21123. |
| [11] | Mao B, Wu W, Davidson G, et al. Kremen proteins are Dickkopf receptors that regulate Wnt/β-catenin signalling[J]. Nature, 2002, 417(6889): 664–667. DOI:10.1038/nature756 |
| [12] | Han XL, Liu M, Voisey A, et al. Post-natal effect of overexpressed DKK1 on mandibular molar formation[J]. J Dent Res, 2011, 90(11): 1312–1317. DOI:10.1177/0022034511421926 |
| [13] | Liu F, Chu EY, Watt B, et al. Wnt/β-catenin signaling directs multiple stages of tooth morphogenesis[J]. Dev Biol, 2008, 313(1): 210–224. DOI:10.1016/j.ydbio.2007.10.016 |
| [14] | Kim TH, Lee JY, Baek JA, et al. Constitutive stabilization of ss-catenin in the dental mesenchyme leads to excessive dentin and cementum formation[J]. Biochem Biophys Res Commun, 2011, 412(4): 549–555. DOI:10.1016/j.bbrc.2011.07.116 |
| [15] | Kim TH, Bae CH, Lee JC, et al. β-catenin is required in odontoblasts for tooth root formation[J]. J Dent Res, 2013, 92(3): 215–221. DOI:10.1177/0022034512470137 |
| [16] | Lim WH, Liu B, Mah S, et al. Alveolar bone turnover and periodontal ligament width are controlled by Wnt[J]. J Periodontol, 2015, 86(2): 319–326. DOI:10.1902/jop.2014.140286 |
| [17] | Li J, Sarosi I, Cattley RC, et al. Dkk1-mediated inhibition of Wnt signaling in bone results in osteopenia[J]. Bone, 2006, 39(4): 754–766. DOI:10.1016/j.bone.2006.03.017 |
| [18] | Morvan F, Boulukos K, Clément-Lacroix P, et al. Deletion of a single allele of the Dkk1 gene leads to an increase in bone formation and bone mass[J]. J Bone Miner Res, 2006, 21(6): 934–945. DOI:10.1359/jbmr.060311 |
| [19] | Jäger A, Götz W, Lossdörfer S, et al. Localization of SOST/sclerostin in cementocytes in vivo and in mineralizing periodontal ligament cells in vitro[J]. J Periodont Res, 2010, 45(2): 246–254. DOI:10.1111/jre.2010.45.issue-2 |
 2017, Vol. 43
2017, Vol. 43


