扩展功能
文章信息
- 王思涵, 姜欢, 于航, 刘少伟, 李梦红, 王六一, 杨军星, 胡敏
- WANG Sihan, JIANG Huan, YU Hang, LIU Shaowei, LI Menghong, WANG Liuyi, YANG Junxing, HU Min
- 不同浓度熊果酸对破骨细胞增殖分化的作用及其意义
- Effects of ursolic acid at different concentrations on proliferation and differentiation of osteoclasts and their significances
- 吉林大学学报(医学版), 2017, 43(02): 236-240
- Journal of Jilin University (Medicine Edition), 2017, 43(02): 236-240
- 10.13481/j.1671-587x.20170205
-
文章历史
- 收稿日期: 2016-12-21
2. 吉林省牙发育及颌骨重塑与再生重点实验室, 吉林 长春 130021
2. Jilin Provincial Kay Laboratory of Tooth Development and Bone Remodeling, Changchun 130021, China
牙根外吸收 (external resorption) 是指牙根表面发生的进行性病理性吸收,其病因有很多,如创伤、不适当的正畸力及根尖周牙周炎[1]。在正畸临床治疗中,牙根吸收是常见的并发症之一[2],在炎症或刺激的条件下,牙根表面发生一系列生理或病理变化,干扰牙骨质形成和再吸收之间的平衡[3]。破骨细胞 (osteoclasts, OC) 是唯一一种参与骨和软骨再吸收的细胞,细胞核因子κB (NF-κB) 受体活化因子配基 (RANKL) 是OC存活、增殖和分化的重要细胞因子,与其相应受体活化剂NF-κB (RANK) 相结合从而发挥生物学作用,RANKL和RANK相结合,激活MAPK、NF-κB及Ca2+等信号通路引起OC内一系列酶促级联反应,使OC前体分化、存活和融合为成熟OC[4-5]。
熊果酸 (ursolic acid, UA) 是一种五环三萜类化合物,在植物界分布极为广泛,如希腊鼠尾草、夹竹桃[6],其毒性低、不良反应少,具有增强免疫力、抗肝炎、抗肿瘤、抗菌抗病毒和降血糖等效果[7-12]。研究[10, 13-16]表明:UA可通过调控信号传导及激活STAT3、MAPKs、PPARs和TGF-b/Smad信号及NF-κB发挥作用。目前,对于UA药理学机制的研究主要集中在抗癌、保肝、抗高血脂和抗抑郁作用方面,在骨代谢方面少有报道。本研究以RAW264.7细胞为模型,观察UA对RANKL诱导成功的OC增殖和分化的影响,旨在探讨UA对正畸力致牙根吸收过程中的保护作用,为今后进一步开发和利用UA防治牙根吸收提供实验依据。
1 材料与方法 1.1 细胞和主要试剂小鼠单核/巨噬系细胞RAW264.7细胞株 (本实验室传代保存ATCC细胞库),RPMI1640培养液 (Hyclone公司,美国),胎牛血清 (Gibco公司,美国),磷酸盐缓冲液 (phosphate buffer solution,PBS, Gibco公司,美国),RANKL (Pepro Tech公司,美国),抗酒石酸酸性磷酸酶 (tartrate resistant acid phosphatase,TRAP) 染色试剂盒 (Sigma-Aldrich公司,美国),熊果酸 (Sigma公司,美国),CCK-8试剂盒 (贝博公司,中国)。
1.2 RAW264.7细胞培养将装有RAW264.7细胞的冻存管从-80℃中取出,投入37℃水浴锅中迅速溶化细胞,吸出细胞移至离心管内,1000 r·min-1离心5 min,弃上清,加入含10%胎牛血清及1%双抗的RPMI1640培养液,将细胞团块吹打均匀,再将培养液移入培养皿中,置于37℃、体积分数5% CO2培养箱中培养,隔天换液1次。
1.3 OC的诱导诱导液的配制为10% FBS和1%双抗的RPMI1640培养液中加入60 μg·L-1 RANKL。选择生长状态良好的RAW264.7单核/巨噬细胞细胞株,使用无菌细胞刮将培养皿中的细胞轻轻刮下,重悬细胞。经细胞计数板计数,以每孔1×104的细胞密度接种于24孔板,待细胞贴壁后加入1 mL诱导液,置于37℃、体积分数5% CO2培养箱中,培养5 d,并隔天更换破骨细胞诱导液。
1.4 OC的TRAP染色TRAP是特异性表达于OC的酶,其表达和分泌均与OC功能密切相关,是识别OC的重要标志。从37℃、5% CO2恒温孵育箱中取出已加入60 μg·L-1 RANKL的诱导5 d后的RAW264.7细胞,去除原有培养基,用37℃预热的PBS漂洗3次,4%多聚甲醛常温固定20 min后,37℃预热的PBS漂洗3次。使用TRAP染色试剂盒,按照说明书建议的操作步骤操作。显微镜下拍照,光镜下观察到2个细胞核以上且TRAP染色阳性的多核细胞即为OC。
1.5 OC骨吸收陷窝的观察取24孔培养板,选用生长状态良好的RAW264.7细胞以每孔1×104的细胞密度与骨片共同培养,置37℃、5% CO2培养箱中,实验组培养液中加入60 μg·L-1的RANKL,对照组不加RANKL,诱导第5天时,弃上清,PBS冲洗3次,用蒸馏水反复冲洗骨片,去除骨片上贴附的细胞,超声清洗10 min×3次。通过电镜扫描检测观察骨吸收陷窝。
1.6 选取对OC无细胞毒性适宜浓度的UA选用生长状态良好的RAW264.7细胞按每孔2×103的细胞密度接种于96孔板上,分为对照组和不同浓度 (1.0、2.5、5.0、10.0、20.0和40.0μmol·L-1) UA组,每组6个复孔,置于37℃、5% CO2培养箱中孵育5 d,每2d换液1次,换液同时更换培养液中诱导液及不同浓度的药物。分别在第1、3和5天每孔加入10μL CCK-8试剂溶液,培养箱继续孵育4 h后,终止培养。在酶标仪上测定各孔在波长450 nm处的吸光度 (A) 值,计算各孔细胞的活力。细胞活力=(加药组A值-空白组A值)/(对照组A值-空白组A值)×100%。
1.7 统计学分析采用SPSS 17.0统计软件进行统计学分析。各组细胞活力均以x±s表示,多组间样本均数比较采用单因素方差分析。以P < 0.05为差异有统计学意义。
2 结果 2.1 OC的TRAP染色观察RAW264.7细胞诱导培养5 d后,可见TRAP染色阳性细胞,体积大,多核 (核≥3个),形状不规则,边缘呈云雾状,有伪足,镜下细胞核呈紫蓝色,胞浆中TRAP活性部位呈紫红色颗粒,表明RAW264.7细胞成功向OC转化。见图 1(插页一)。
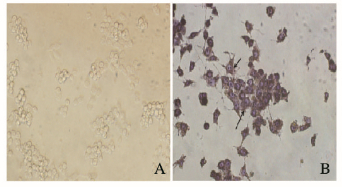
|
| A:RAW264.7 cells induced without RANKL; B:Osteoclasts induced successfully with RANKL. 图 1 OC的TRAP染色结果 (×400) Figure 1 Results of TRAP staining of OC (×400) |
|
|
RAW264.7细胞诱导培养5 d后,扫描电镜下吸收陷窝呈圆形和椭圆形等,底壁较粗糙,边界较清晰。表明RAW264.7细胞成功向OC转化。见图 2。

|
| A:Bone pieces co-cultured without RAW264.7 cells; B:Bone pieces co-cultured with RAW264.7 cells. 图 2 OC的骨吸收陷窝 Figure 2 Bone resorption lacunae of OC |
|
|
纵向观察:药物作用1、3和5 d时,UA浓度在> 10.0 μmol·L-1时细胞活力均低于对照组,说明UA浓度> 10.0 μmol·L-1时对OC增殖有明显的抑制作用;药物作用1和3 d时,UA浓度 < 5.0 μmol·L-1组细胞活力低于对照组,但差异无统计学意义 (P > 0.05);在药物作用5 d时,UA < 5.0 μmol·L-1组均低于对照组,且5.00 μmol·L-1组差异有统计学意义 (P < 0.05)。UA对OC的作用表现为高浓度早期抑制增殖 (> 10.0 μmol·L-1),低浓度 (1.0和2.5μmol·L-1) 早期无作用,中浓度 (5.0 μmol·L-1) 早期无作用,第5天时起抑制OC增殖作用。见表 1。
| (n=6, x±s, η/%) | |||
| Group | Cell viability | ||
| (t/d) 1 | 3 | 5 | |
| Control | 100.00±1.81 | 100.00±4.00 | 100.00±5.87 |
| UA (μmol·L-1) | |||
| 1.0 | 96.00±5.60 | 98.43±7.34 | 99.90±3.23 |
| 2.5 | 100.79±4.52 | 99.92±4.03 | 98.80±3.88 |
| 5.0 | 98.36±6.43 | 100.28±5.82 | 90.36±5.29* |
| 10.0 | 40.46±1.47* | 16.59±0.59* | 13.53±1.49* |
| 20.0 | 32.20±0.65* | 17.11±1.29* | 17.21±3.31* |
| 40.0 | 32.35±0.66* | 16.67±1.22* | 17.39±4.58* |
| *P < 0.01 vs control group. | |||
横向观察:高浓度组 (> 10.0 μmol·L-1) 表现为早期抑制OC增殖作用 (P < 0.05);低浓度组 (< 2.5μmol·L-1) 表现为无作用;中浓度组 (5.0μmol·L-1) 表现为早期无作用,晚期 (第5天) 有抑制OC增殖作用。见图 3。
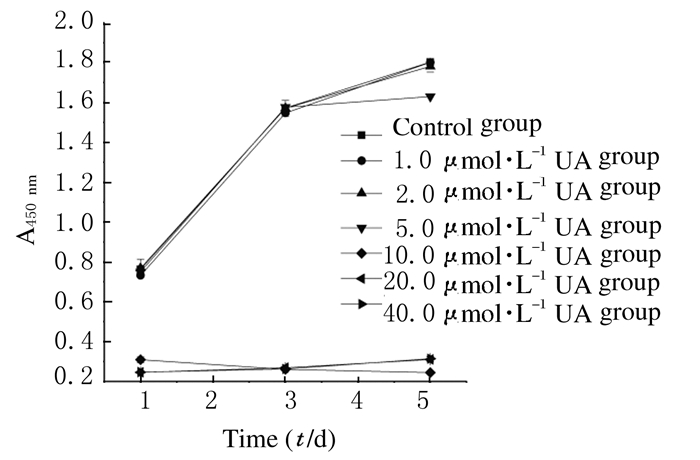
|
| 图 3 CCK-8法横向观察线状图 Figure 3 Linear graph of CCK-8 method in horizontal observation |
|
|
正畸所导致的牙根外吸收是由于机械力诱发牙周细胞坏死所触发的炎症反应,该炎症所致的微环境可以引起骨吸收和骨形成[17]。在此过程中,OC起到关键的作用,研究[18-19]表明:RANKL可促进OC的分化,增强成熟OC的活力,阻止OC凋亡,是OC分化成熟和维持功能所需的重要因子。RANKL的信号经RANK传递给肿瘤坏死因子受体相关因子 (TRAF),经过TRAF激活下游多种信号分子,引起一系列的信号转导反应和细胞生物学效应, 从而促进OC的增殖、分化、成熟以及增强骨吸收活性。其中,RANKL与M-CSF结合到OC的前体细胞表面受体RANK和M-CSFR上,RANK胞内区的特异性位点与OC内的肿瘤坏死因子受体相关蛋白结合,引起OC下游信号的的链式反应。近年来研究[20]显示:无论M-CSF是否存在, RANKL均能诱导脾细胞向OC分化。本实验中直接用加RANKL的诱导培养基诱导RAW264.7细胞,出现许多TRAP (OC特征性标志物[21]) 染色阳性的多核细胞和骨吸收陷窝 (体外培养成熟OC最可靠的鉴别指标[22]),证实了实验培养的多核细胞是OC前体细胞分化形成的成熟OC。本研究以OC前体细胞RAW264.7细胞为模型,在含诱导培养基中加RANKL诱导RAW264.7细胞分化成熟, 减少了M-CSF的应用, 使培养体系更加简单, 易于操作, 获取的细胞时程短、稳定高效、细胞成分单一、产量和纯度都高,通过RANKL诱导OC分化从而获取成熟OC,为进一步研究OC与正畸炎性牙根吸收的机制奠定基础。
Tan等[23]以卵巢切除 (OVX) 的小鼠为模型,发现喂养含有UA的枇杷叶的实验组OVX小鼠比对照组OVX小鼠骨矿化密度明显增高,表明UA在OVX小鼠中可显著抑制骨密度流失,尤其在头部、腹部及腰椎部,并且表明该机制与雌激素不相关;而后续的细胞实验中也证明了UA对OC起抑制作用并呈剂量依赖性 (在生物安全浓度范围内0~40 mg·L-1)。Jiang等[24]以RANKL诱导的RAW 264.7细胞的OC为载体,将UA分为3个不同浓度组,对照组可见大量OC生成,而UA组则出现显著抑制作用并呈浓度依赖性。本实验应用此方法将实验组分为6组 (浓度分别为1.0、2.5、5.0、10.0、20.0和40.0μmol·L-1),选取RANKL诱导第5天的RAW 264.7细胞,通过CCK-8法选取适宜浓度的UA组。结果表明:高浓度组 (> 10.0μmol·L-1) 早期抑制OC增殖,证明了UA的安全作用浓度为 < 10.0μmol·L-1,与Lee[25]的研究结果一致。而低浓度组 (< 2.5μmol·L-1) 表现为无作用,但细胞活力均低于对照组,是否无作用还需进一步的研究。中浓度组 (5.0μmol·L-1) 表现为早期对OC无作用,晚期 (第5天) 表现为抑制OC增殖的作用,说明适宜浓度UA对OC增殖有抑制作用,且呈时间依赖性。
本研究结果表明:高浓度UA (> 10.0μmol·L-1) 对OC有显著抑制作用,具有细胞毒性,表明UA的安全作用浓度为 < 10.0μmol·L-1。适宜浓度UA对OC具有抑制作用且呈时间依赖性,但其作用机制还有待进一步的研究。随着研究的逐步深入,UA有望成为临床上治疗正畸炎性牙根吸收修复的有效药物或辅助药物。
| [1] | Liu Y, Du H, Wang Y, et al. Osteoprotegerin-knockout mice developed early onset root resorption[J]. J Endod, 2016, 42(10): 1516–1522. DOI:10.1016/j.joen.2016.07.008 |
| [2] | Albaker BK, Wong RW. Diagnosis and management of root resorption by erupting canines using cone-beam computed tomography and fixed palatal appliance:a case report[J]. J Med Case Rep, 2010, 4: 399. DOI:10.1186/1752-1947-4399 |
| [3] | Gama A, Navet B, Vargas JW, et al. Bone resorption:an actor of dental and periodontal development[J]. Front Physiol, 2015, 6: 510–517. |
| [4] | Liu YK, Ye J, Han QL, et al. Toxicity and bioactivity of cobalt nanoparticles on the monocytes[J]. Orthop Surg, 2015, 7(2): 168–173. DOI:10.1111/os.2015.7.issue-2 |
| [5] | Wada T, Nakashima T, Hiroshi N, et al. RANKL-RANK signaling in osteoclastogenesis and bone disease[J]. Trends Mol Med, 2006, 12(1): 17–25. DOI:10.1016/j.molmed.2005.11.007 |
| [6] | 陶渊博, 邢雅丽, 方芝娟, 等. 生物活性物质熊果酸资源分布状况研究进展[J]. 林产化学与工业, 2012, 32(1): 119–126. |
| [7] | Wang X, Li L, Wang B, et al. Effects of ursolic acid on the proliferation and apoptosis of human ovarian cancer cells[J]. J Huazhong Univ Sci Technol Med Sci, 2009, 29(6): 761–764. DOI:10.1007/s11596-009-0618-y |
| [8] | Chen H, Gao Y, Wang A, et al. Evolution in medicinal chemistry of ursolic acid derivatives as anticancer agents[J]. Eur J Med Chem, 2015, 92: 648–655. DOI:10.1016/j.ejmech.2015.01.031 |
| [9] | Li X, Zhang H, Zheng D, et al. Efficient delivery of ursolic acid by poly (n-vinylpyrrolidone)-block-poly (ε-caprolactone) nanoparticles for inhibiting the growth of hepatocellular carcinoma in vitro and in vivo[J]. Int J Nanomed, 2015, 10(1): 1909–1920. |
| [10] | Jia Y, Bhuiyan MJ, Jun HJ, et al. Ursolic acid is a PPAR-α agonist that regulates hepatic lipid metabolism[J]. Bioorg Med Chem Lett, 2011, 21(19): 5876–5880. DOI:10.1016/j.bmcl.2011.07.095 |
| [11] | Weng H, Tan ZJ, Hu YP, et al. Ursolic acid induces cell cycle arrest and apoptosis of gallbladder carcinoma cells[J]. Cancer Cell Int, 2014, 14(1): 96–106. DOI:10.1186/s12935-014-0096-6 |
| [12] | Li J, Guo WJ, Yang QY. Effects of ursolic acid and oleanolic acid on human colon carcinoma cell line HCT15[J]. World J Gastroenterol, 2002, 8(3): 493–495. |
| [13] | Pathak AK, Bhutani M, Nair AS, et al. Ursolic acid inhibits STAT3 activation pathway leading to suppression of proliferation and chemosensitization of human multiple myeloma cells[J]. Mol Cancer Res, 2007, 5(9): 943–955. DOI:10.1158/1541-7786.MCR-06-0348 |
| [14] | Li Y, Lu X, Qi H, et al. Ursolic acid induces apoptosis through mitochondrial intrinsic pathway and suppression of ERK1/2 MAPK in heLa cells[J]. J Pharmacol Sci, 2014, 125(2): 202–210. DOI:10.1254/jphs.14017FP |
| [15] | Murakami S, Takashima H, Sato-Watanabe M, et al. Ursolic acid, an antagonist for transforming growth factor (TGF)-β1[J]. FEBS Lett, 2004, 566(1-3): 55–59. DOI:10.1016/j.febslet.2004.04.036 |
| [16] | Checker R, Sandur SK, Sharma D, et al. Potent anti-inflammatory activity of ursolic acid, a triterpenoid antioxidant, is mediated through suppression of NF-κB, AP-1 and NF-AT[J]. PLoS One, 2012, 7(2): e31318. DOI:10.1371/journal.pone.0031318 |
| [17] | Brezniak N, Wasserstein A. Root resorption after orthodontic treatment:Part 1. Literature review[J]. Am J Orthod Dentofacial Orthop, 1993, 103(1): 62–66. DOI:10.1016/0889-5406(93)70106-X |
| [18] | 仲蕾蕾, 杨冰, 黄晓斌, 等. OPG/RANKL/RANK系统在成骨细胞和破骨细胞相互调节中的作用[J]. 中国骨质疏松杂志, 2011, 17(11): 1010–1013. |
| [19] | 董伟, 彭宏峰, 梁永强, 等. 双膦酸盐对NFATc1及相关因子p-NF-κB、p-c-Jun在破骨细胞分化过程中的影响[J]. 解放军医学杂志, 2015, 40(10): 778–781. |
| [20] | Kong YY, Yoshida H, Sarosi I, et al. OPGL is a key regulator of osteoclastogenesis, lymphocyte development and lymph-node organogenesis[J]. Nature, 1999, 397(6717): 315–323. DOI:10.1038/16852 |
| [21] | Boyle WJ, Simonet WS, Lacey DL. Osteoclast differentiation and activation[J]. Nature, 2003, 423(6937): 337–342. DOI:10.1038/nature01658 |
| [22] | Ferlin A, Pepe A, Facciolli A, et al. Relaxin stimulates osteoclast differentiation and activation[J]. Bone, 2010, 46(2): 504–513. DOI:10.1016/j.bone.2009.10.007 |
| [23] | Tan H, Furuta S, Nagata T, et al. Inhibitory effects of the leaves of loquat (Eriobotrya japonica) on bone mineral density loss in ovariectomized mice and osteoclast differentiation[J]. J Agric Food chem, 2014, 62(4): 836–841. DOI:10.1021/jf402735u |
| [24] | Jiang C, Xiao F, Gu X, et al. Inhibitory effects of ursolic acid on osteoclastogenesis and titanium particle-induced osteolysis are mediated primarily via suppression of NF-κB signaling[J]. Biochimie, 2015, 111: 107–118. |
| [25] | Lee SU, Park SJ, Kwak HB, et al. Anabolic activity of ursolic acid in bone:Stimulating osteoblast differentiation in vitro and inducing new bone formation in vivo[J]. Pharmacol Res, 2008, 58(5/6): 290–296. |
 2017, Vol. 43
2017, Vol. 43


