扩展功能
文章信息
- 杨曼, 孙小铃, 王继, 梁宝璐, 李艳博, 荆黎, 孙志伟
- YANG Man, SUN Xiaoling, WANG Ji, LIANG Baolu, LI Yanbo, JING Li, SUN Zhiwei
- 小鼠体内气管滴注纳米二氧化硅对体内主要脏器的影响
- Effects of SiO2 nanoparticles by intratracheal instilation on major organs of mice in vivo
- 吉林大学学报(医学版), 2017, 43(02): 230-235
- Journal of Jilin University (Medicine Edition), 2017, 43(02): 230-235
- 10.13481/j.1671-587x.20170204
-
文章历史
- 收稿日期: 2016-05-06
2. 首都医科大学环境毒理学北京市重点实验室, 北京 100069
2. Beijing Key Laboratory of Environmental Toxicology, Capital Medical University, Beijing 100069, China
近年来随着灰霾天气的不断出现,大气颗粒物的污染及其危害越来越引起人们的关注。国际癌症研究组织 (International Agency for Research on Cancer, IARC) 在2013年将户外环境污染物和主要成分大气颗粒物 (PM) 归类到对人类具有致癌性的组类 (Group 1)[1]。美国癌症协会一项群体研究[2]显示:大气中PM2.5的浓度每增加10 μg·m-3,总死亡率上升4%,心肺疾病死亡率上升6%,肺癌死亡率上升8%。纳米二氧化硅 (SiO2) 颗粒是自然界中广泛存在的一类颗粒,如沙尘暴和建筑粉尘等,是PM的重要成分,如煤、石油等矿物质燃烧的产物[3]; 纳米SiO2颗粒也是目前世界上和我国产量最高的一类无机纳米材料,被广泛应用在生物医药、化妆品、化工和食品中,使得人群的暴露机会大大增加,并可能引发复杂的有害生物效应,潜在危害不容忽视。纳米SiO2进入人体的途径主要有呼吸道、消化道、皮肤和血液系统,其中最重要的是呼吸道,可造成肺脏明显的损伤,包括肺泡间隔增宽、炎性细胞浸润等[4]。此外,纳米SiO2到达肺泡后,还可以穿过肺泡上皮细胞进入肺间质从而进入血液循环,或者通过淋巴循环进入血液[5],经口摄入的纳米SiO2也可以进入血液循环,随着血液到达全身各组织器官形成二次分布[6]。灌胃和气管滴注二次分布及静脉注射的纳米SiO2的主要分布器官有肝、肾和脾等[7-9],心脏和脑中也有少量分布,其直接结果是造成这些器官的损伤和炎性改变等。国内外有较多关于纳米SiO2对多脏器影响的研究,实验采用的暴露途径多是静脉注射[10]、腹腔注射[11]、灌胃或经食物摄入[12],且多采用急性毒性实验方法,而关于气管滴注纳米SiO2在体内对不同脏器脏影响的研究极少,但肺是大气颗粒物最主要和最直接的靶器官。本研究通过给予成年小鼠气管滴注不同剂量纳米SiO2,采用重复染毒的方法,观察在不同时间点各剂量组小鼠主要脏器的组织形态学变化,探讨该暴露途径下纳米SiO2在体内对各脏器的剂量效应和时间效应,为纳米SiO2的体内毒性研究提供参考依据。
1 材料与方法 1.1 实验动物、主要试剂和仪器40只雌性SPF级BALB/c小鼠,6~8周龄,体质量18~22g,购自北京维通利华实验动物技术有限公司,动物合格证号:AEEI-2015-103,实验前在SPF级动物房适应性饲养1周。所有动物实验已经通过首都医科大学动物伦理委员会的审核和批准 (伦理审核编号:AEEI-2015-103)。所用化学试剂均购自美国Sigma公司。石蜡切片为莱卡医疗仪器有限公司,透射电镜为日本产JEOL JEM2100仪器,粒度分析仪为美国马尔文公司生产的Nano-ZS90仪器,气管滴注仪器为美国Hallowell MEC公司产的WELCH ALLYN气管滴注设备。
1.2 纳米SiO2制备和表征Stöber法制备纳米SiO2:三颈瓶中依次加入无水乙醇50 mL、氨水2 mL、高纯水1mL,室温恒温后,在搅拌速度为150r·min-1下迅速加入1.5 mLTEOS,反应12h后停止;15000 r·min-1离心30 min后,用无水乙醇和去离子水分别清洗3次,超声分散在无菌水中,即纳米SiO2母液;取分散好的母液,放入1 mL已称质量的离心管中,烘干40 h,称质量,计算母液的浓度。取一定浓度纳米SiO2溶液用电位粒度仪检测其粒度和电位。取少量纳米SiO2滴在铜网上,自然晾干,于透射电子显微镜下观察其形态。母液用于动物实验前再超声5 min,用生理盐水稀释调节浓度。
1.3 动物分组和处理小鼠随机分为对照组 (生理盐水)、低剂量SiO2组 (7mg·kg-1)、中剂量SiO2组 (21 mg·kg-1) 和高剂量SiO2组 (35 mg·kg-1),每组10只。小鼠在水合氯醛麻醉下,采用非暴露式气管内注入法,注射相应剂量的纳米SiO2悬液,注射体积50 μL,每3d染毒1次,共5次。染毒前小鼠禁食12 h。取材时间为最后一次染毒后1和15 d,取材前小鼠禁食12 h。
1.4 组织形态表现观察分别于最后一次染毒后的1和15 d取材,每组取4只小鼠进行解剖取材,取左肺、肝脏、脾脏、右肾和心脏,多聚甲醛中固定,常规脱水、石蜡包埋、切片,苏木精-伊红 (HE) 染色后光镜下进行组织形态表现检查。同时对肝脏的肉芽肿数量和肺的小动脉栓塞数量进行计数,每组的组织分别在显微镜下计数,进行统计分析。
1.5 血生化指标检测分别于最后一次染毒后的1和15 d,将小鼠麻醉后从眼眶静脉丛取血,测定肝肾功能相关的血生化指标,包括丙氨酸氨基转移酶 (ALT)、天冬氨酸氨基转移酶 (AST)、乳酸脱氢酶 (LDH)、尿素氮 (BUN)、肌酐 (Cr) 和尿酸 (CA)。
1.6 统计学分析采用SPSS19.0统计软件进行统计学分析。分析粒子的粒径分布情况,小鼠各项检测数据均以x±s表示,组间均数比较采用单因素方差分析,两两比较采用LSD和SNK法;两时间点均数比较采用两独立样本t检验。以P < 0.05表示差异有统计学意义。
2 结果 2.1 纳米SiO2表征纳米SiO2颗粒大小较均匀,分散性好。见图 1。其平均粒径约为45 nm。水合粒径分析结果显示:纳米SiO2颗粒分散在高纯水中无团聚现象,分散性好,聚合物分散指数 (polymer dispersity index, PDI) 均小于0.2,PDI越小,表示颗粒的单分散性越好;颗粒表面带负电荷,Z电势绝对值约为30mV,说明粒子稳定性很好。见表 1。
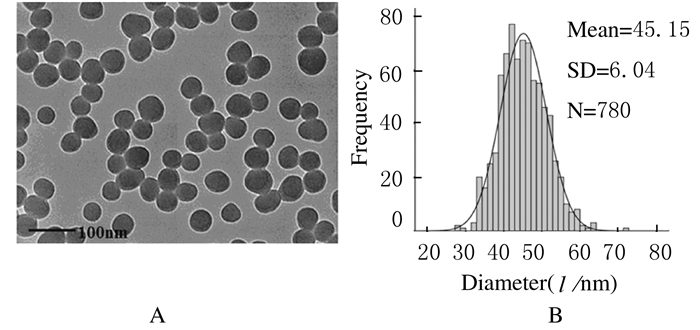
|
| A: TEM image; B: Size distribution. 图 1 纳米SiO2颗粒的表征 Figure 1 Characterization of SiO2 nanoparticles |
|
|
| Time (t/d) | Water | ||
| Size (l/nm) | PDI | Zeta potential | |
| 0 | 80.66 | 0.124 | -24.7 |
| 1 | 78.88 | 0.098 | -25.3 |
| 5 | 79.77 | 0.130 | -28.2 |
| 7 | 79.76 | 0.150 | -26.3 |
| 14 | 77.65 | 0.139 | -27.2 |
| 21 | 79.65 | 0.126 | -29.9 |
染毒结束后1d,与对照组比较,各实验组小鼠肺组织可见较多实变区域,肺泡间隔增宽,肺泡壁充血,间质中可见较多淋巴细胞和单核细胞浸润及毛细血管充血等一系列炎性表现,并且剂量越高,表现越明显;染毒结束后15d肺组织总体炎性改变区域较1d时少,但在中和高剂量SiO2组小鼠肺组织中可见小动脉血栓,推测是气管滴注纳米SiO2后血管内皮损伤引起 (图 2,见插页一)。数据分析显示:各实验组小鼠小动脉血栓数量与对照组比较差异均无统计学意义 (P > 0.05)。见图 3。

|
| A-D: 1 d; E-H: 15 d; A, E: Control group; B, F: Low dose of SiO2 group; C, G: Middle dose of SiO2 group; D, H: High dose of SiO2 group. 图 2 各组小鼠肺组织学形态表现 (HE, ×100) Figure 2 Morphology of lung tissue of mice in various groups (HE, ×100) |
|
|

|
| 图 3 各组小鼠肺小动脉血栓数量 Figure 3 Number of thrombi in pulmonary arteriolae of mice in various groups |
|
|
各组小鼠肝脏可见多个肝小叶,肝小叶轮廓清晰,肝索呈放射状,排列整齐。肝细胞核呈圆形,胞浆粉红。染毒结束后1和15 d,与对照组比较,各实验组肝组织中可见肉芽肿样的小灶性淋巴细胞聚集,并且周围肝细胞可见嗜酸性增强和细胞核固缩,呈坏死表现,剂量越高,炎性肉芽肿越多;在1d时高剂量SiO2组中可见肉芽肿周边以外区域的局灶性肝细胞坏死。染毒后15d时肝组织炎性肉芽肿数量较少。数据分析显示:1d时各实验组肉芽肿数量较对照组明显增多 (P < 0.05),15d时中剂量SiO2组肝肉芽肿数量多于对照组 (P < 0.05);1和15d时,低和高剂量SiO2组肝肉芽肿数量比较差异有统计学意义 (P < 0.05),且15d时肝肉芽肿数量少于1d时。见图 4(插页一) 和5。

|
| A-D: 1 d; E-H: 15 d; A, E: Control group; B, F: Low dose of SiO2 group; C, G: Middle dose of SiO2 group; D, H: High dose of SiO2 group. Black circles denoted granuloma-like lymphocytic infiltration; White circles denoted focal hepatocyte necrosis. 图 4 各组小鼠肝组织学形态表现 (HE, ×100) Figure 4 Morphology of liver tissue of mice in various groups (HE, ×100) |
|
|

|
| *P < 0.05, **P < 0.01 compared with control group; ▲P < 0.05 compared between two time points. 图 5 各组小鼠肝组织中肝肉芽肿数量 Figure 5 Number of granulomas in liver tissue of mice in various groups |
|
|
各组小鼠脾组织红、白髓分界清楚;与对照组比较,各实验组小鼠脾红髓增大、充血并可见较多巨噬细胞,随着剂量增加,充血范围有增大趋势;中和高剂量SiO2组小鼠脾红髓中可见巨核细胞。染毒后15d脾组织充血表现更为明显。见图 6(插页一)。

|
| A-D: 1 d; E-H: 15 d; A, E: Control group; B, F: Low dose of SiO2 group; C, G: Middle dose of SiO2 group; D, H: High dose of SiO2 group. Black circles denoted megakaryocytes. 图 6 各组小鼠脾组织形态表现 Figure 6 Morphology of spleen tissue of mice in various groups |
|
|
与对照组比较,中和高剂量SiO2组小鼠肾组织可见少量淋巴细胞浸润,肾小球及肾小管等结构未见明显异常。见图 7(插页二)。
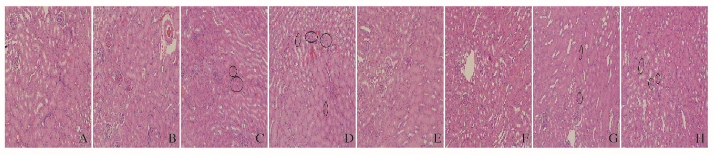
|
| A-D: 1 d; E-H: 15 d; A, E: Control group; B, F: Low dose of SiO2 group; C, G: Middle dose of SiO2 group; D, H: High dose of SiO2 group. Black circles denote lymphocytic infiltration. 图 7 各组小鼠肾组织形态表现 Figure 7 Morphology of kidney tissue of mice in various groups |
|
|
对照组和实验组小鼠心脏组织结构未发生明显变化。见图 8(插页二)。
|
| A-D: 1 d; E-H: 15 d; A, E: Control group; B, F: Low dose of SiO2 group; C, G: Middle dose of SiO2 group; D, H: High dose of SiO2 group. 图 8 各组小鼠心脏组织形态表现 Figure 8 Morphology of heart tissue of mice in various groups |
|
|
与对照组比较,15d时低剂量SiO2组小鼠ALT水平明显降低 (P < 0.05),中剂量SiO2组小鼠ALT水平明显升高 (P < 0.05);低和中剂量SiO2组1和15d时小鼠ALT水平比较差异有统计学意义 (P < 0.05),但无剂量依赖性和时间依赖性。与对照组比较,1d时中剂量SiO2组小鼠AST水平明显降低 (P < 0.01),15d时低剂量SiO2组小鼠AST水平明显升高 (P < 0.01);低和中剂量SiO2组15d时小鼠AST水平明显高于1 d时 (P < 0.05),但无剂量依赖性。1d时高剂量SiO2组小鼠LDH水平低于对照组 (P < 0.05),低剂量SiO2组1d时小鼠LDH水平高于15d时 (P < 0.05);1d时低、中和高剂量SiO2组小鼠BUN水平均明显高于对照组 (P < 0.05),低剂量SiO2组小鼠15d时BUN水平低于1d时 (P < 0.05)。与对照组比较,1d时低剂量SiO2组小鼠Cr水平明显降低 (P < 0.05),15d时中剂量SiO2组小鼠Cr水平明显升高 (P < 0.05),且低和中剂量SiO2组15d时小鼠Cr水平高于1d时 (P < 0.05)。与对照组比较,1d时中剂量SiO2组小鼠CA水平明显降低 (P < 0.05),而高剂量SiO2组小鼠15d时CA水平低于1d时 (P < 0.05)。见图 9。
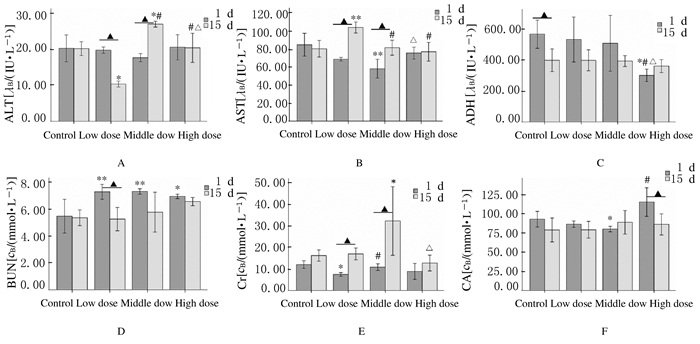
|
| A: ALT; B:AST; C: LDH; D: BUN; E: Cr; F: CA; *P < 0.05, **P < 0.05 compared with control group; #P < 0.05 compared with low dose group; △P < 0.05 compared with middle dose group; ▲P < 0.05 compared between two time points. 图 9 各组小鼠血清生化指标 Figure 9 Serum biochemical indicators of mice in vanious groups |
|
|
纳米SiO2颗粒在自然界中广泛存在,是大气颗粒物的重要成分之一,同时也是目前世界上和我国产量最高的一类无机纳米材料,在许多领域有着不可替代的作用,使得人群接触机会越来越多。吸入颗粒物最直接的靶器官是肺脏,可造成肺的明显损伤;同时这些颗粒还可进入血液循环分布到其他器官,如肝脏、肾脏和脾脏等。因此有必要研究通过呼吸道进入体内的纳米SiO2对各脏器的影响。本研究采用非暴露式气管内注入法进行染毒,既避免纳米SiO2在上呼吸道沉积,又能精确控制进入气管内纳米SiO2的量[13]。小鼠进行重复剂量染毒的方法,在不同时间点观察不同脏器的炎症反应与损伤程度。研究[4, 13-14]显示:气管内滴注纳米SiO2可致肺毒性作用,表现为肺泡壁充血、肺泡间隔增宽、肺泡间隔单核巨噬细胞浸润和淋巴细胞浸润、肺泡腔内可见脱落的上皮细胞、肺内支气管周围淋巴结增大、肺内散在细胞性结节、肺泡上皮肥大增生以及肺泡排列紊乱等。本研究中,与对照组比较,各实验组小鼠肺组织可见较多实变区域,肺泡间隔增宽,肺泡壁充血,间质中可见较多淋巴细胞和单核细胞浸润及毛细血管充血等一系列炎性表现,并且剂量越高,表现越明显,与上述相关研究结果一致。染毒结束后15d时肺组织总体炎性改变区域少于1d时,炎性表现较轻,说明染毒后15d时小鼠自身可能有恢复作用;中和高剂量SiO2组小鼠肺组织内可见小动脉血栓,实验组与对照组小鼠血栓数量比较差异无统计学意义,但实验组可见血栓的肺组织数量多于对照组,可能由于气管滴注纳米SiO2后进入血循环的纳米SiO2数量较少,未引起弥散性血管内凝血,只是诱发了肺个别血管内皮损伤。
纳米SiO2所致肝损伤的现有研究多集中于静脉注射途径,相关研究[10, 15]显示:静脉注射纳米SiO2可致急性肝损伤,表现为淋巴细胞浸润、肉芽肿形成、肝细胞水肿、巨噬细胞增生以及肝细胞局灶性坏死。研究[12]报道:经食物摄入纳米SiO2引起的亚慢性毒性中,肝脏出现炎性肉芽肿、细胞坏死和纤维化表现。气管滴注碳纳米管也可致肝损伤,高剂量组可见小灶性炎细胞浸润、部分肝细胞肿胀、肝细胞灶性坏死[16]。肉芽肿是一种机体隔离外源性物质的免疫反应,由巨噬细胞吞噬外源性物质并分泌细胞因子和趋化因子,使淋巴细胞和中性粒细胞聚集而形成[17]。本研究中,各实验组小鼠肝组织可见肉芽肿样的小灶性淋巴细胞聚集,并且周围肝细胞可见嗜酸性增强和细胞核固缩,呈坏死表现,染毒后1d时高剂量组小鼠可见肉芽肿周边以外区域的局灶性肝细胞坏死,说明该剂量下肝组织的损伤较为严重。染毒后15d时肝组织炎性肉芽肿数量较少,提示炎症可能有所消退。因此推测肉芽肿样淋巴细胞聚集的形成是纳米SiO2颗粒作为一种外来物质被肝巨噬细胞 (Kupffer细胞) 吞噬的结果。本研究组织形态学结果与血生化结果均提示:纳米SiO2可引起肝脏的炎症和损伤,其中组织形态学的剂量效应及时间效应更显著。
本研究中各实验组小鼠脾组织红髓增大、充血并可见较多巨噬细胞,随着剂量增加,充血范围有增大趋势,染毒后1d时脾组织表现比15d时更为明显。脾作为一个免疫器官,通过肺间质进入血循环的纳米SiO2颗粒有一部分滞留在脾脏中。正常情况下脾不参与造血,在病理或者大失血状态下脾的髓外造血功能启动,产生各种血细胞[18]。本研究中各实验组小鼠脾组织内可见巨核细胞,可能是纳米SiO2颗粒刺激所致,但其机制不明。
本研究中,中和高剂量SiO2组小鼠肾组织可见轻微的淋巴细胞浸润,而对照组及低剂量SiO2组则未见明显改变,血生化指标水平的变化提示纳米SiO2造成一定程度的肾组织炎症及肾功能损害。本研究中对照组和实验组小鼠心脏均无明显异常,可能是纳米SiO2在心脏中滞留少,不足以产生肉眼可见的组织学改变。
综上所述,气管滴注纳米SiO2对不同脏器的影响主要表现在炎症及损伤方面,受影响的脏器主要有肺脏、肝脏、脾脏和肾脏。
| [1] | Loomis D, Grosse Y, Lauby-Secretan B, et al. The carcinogenicity of outdoor air pollution[J]. Lancet Oncol, 2013, 14(13): 1262–1263. DOI:10.1016/S1470-2045(13)70487-X |
| [2] | Pope CA3rd, Burnett RT, Thun MJ, et al. Lung cancer, cardiopulmonary mortality, and long-term exposure to fine particulate air pollution[J]. JAMA Am Med Asso, 2002, 287(9): 1132–1141. DOI:10.1001/jama.287.9.1132 |
| [3] | Tsai CH, Vivero-Escoto JL, Slowing II, et al. Surfactant-assisted controlled release of hydrophobic drugs using anionic surfactant templated mesoporous silica nanoparticles[J]. Biomaterials, 2011, 32(26): 6234–6244. DOI:10.1016/j.biomaterials.2011.04.077 |
| [4] | 孙景萍, 王素华, 高艳荣. 纳米级和微米级二氧化硅粉尘对大鼠肺损伤的研究[J]. 包头医学院学报, 2011, 27(4): 27–29. |
| [5] | Estevanato LL, Lacava LM, Carvalho LC, et al. Long-term biodistribution and biocompatibility investigation of dextran-coated magnetite nanoparticle using mice as the animal model[J]. J Biomed Nanotechnol, 2012, 8(2): 301–308. DOI:10.1166/jbn.2012.1376 |
| [6] | Hillyer JF, Albrecht RM. Gastrointestinal persorption and tissue distribution of differently sized colloidal gold nanoparticles[J]. J Pharm Sci, 2001, 90(12): 1927–1936. DOI:10.1002/jps.1143 |
| [7] | Cho M, Cho W, Choi M, et al. The impact of size on tissue distribution and elimination by single intravenous injection of silica nanoparticles[J]. Toxicol Lett, 2009, 189(3): 177–183. DOI:10.1016/j.toxlet.2009.04.017 |
| [8] | Zane A, McCracken C, Knight D A, et al. Uptake of bright fluorophore core-silica shell nanoparticles by biological systems[J]. Int J Nanomed, 2015, 10: 1547–1567. |
| [9] | 崔冠群, 杜忠君, 高静, 等. 气管滴注纳米二氧化硅颗粒致大鼠肺炎症反应及脏器中硅浓度变化的研究[J]. 中国实验诊断学, 2013, 17(10): 1779–1782. |
| [10] | Yu Y, Li Y, Wang W, et al. Acute toxicity of amorphous silica nanoparticles in intravenously exposed ICR mice[J]. PLoS One, 2013, 8: e613464. |
| [11] | Chen X, Wang Z, Zhou J, et al. Renal interstitial fibrosis induced by high-dose mesoporous silica nanoparticles via the NF-kappa B signaling pathway[J]. Int J Nanomed, 2015, 10: 1–22. DOI:10.2217/nnm.14.186 |
| [12] | van der Zande M, Vandebriel RJ, Groot MJ, et al. Sub-chronic toxicity study in rats orally exposed to nanostructured silica[J]. Fart Fibre Toxicol, 2014, 11: 8. DOI:10.1186/1743-8977-11-8 |
| [13] | 蔺新丽. 纳米二氧化硅颗粒肺毒性及其相关机制研究[D]. 长春: 吉林大学, 2011. |
| [14] | 崔冠群. 气管滴注纳米二氧化硅颗粒对大鼠肺脏的影响[D]. 长春: 吉林大学, 2014. |
| [15] | Isoda K, Tetsuka E, Shimizu Y, et al. Liver injury induced by thirty-and fifty-nanometer-diameter silica nanoparticles[J]. Biol Pharm Bull, 2013, 36(3): 370–375. DOI:10.1248/bpb.b12-00738 |
| [16] | 林本成. 纳米二氧化硅与碳纳米管典型生物毒性效应研究[D]. 北京: 中国人民解放军军事医学科学院, 2010. |
| [17] | Liu T, Li L, Fu C, et al. Pathological mechanisms of liver injury caused by continuous intraperitoneal injection of silica nanoparticles[J]. Biomaterials, 2012, 33(7): 2399–2407. DOI:10.1016/j.biomaterials.2011.12.008 |
| [18] | Gluhcheva Y, Atanasov V, Ivanova J, et al. Cobalt-induced changes in the spleen of mice from different stages of development[J]. J Toxicol Environ Health Part A, 2012, 75(22/23): 1418–1422. |
 2017, Vol. 43
2017, Vol. 43


