扩展功能
文章信息
- 潘宝龙, 巫玲, 潘丽, 马润玫
- PAN Baolong, WU Ling, PAN Li, MA Runmei
- visfatin对体外脂肪细胞胰岛素受体底物和PI3K表达的影响
- Influence of visfatin in expressions of insulin receptor substrate and PI3K in fat cells in vitro
- 吉林大学学报(医学版), 2017, 43(02): 225-229
- Journal of Jilin University (Medicine Edition), 2017, 43(02): 225-229
- 10.13481/j.1671-587x.20170203
-
文章历史
- 收稿日期: 2016-07-01
2. 云南省玉溪市中心血站质管科, 云南 玉溪 653100;
3. 昆明医科大学第一附属医院产科, 云南 昆明 650031
2. Department of Quality Control, Yuxi Center Blood Station, Yunnan Province, Yuxi 653100, China;
3. Department of Obstetrics, First Affiliated Hospital, Kunming Medical University, Kunming 650031, China
近年来,来源于脂肪组织的脂肪因子 (adipokines) 与2型糖尿病 (type 2 diabetes mellitus,T2DM) 的关系倍受关注,已成为新的研究热点[1-2]。内脏脂肪素 (visfatin) 是新近发现的脂肪因子之一,目前国内外对其与T2DM关系的研究[3-4]多局限于人体血清及体内网膜脂肪组织中水平检测,并且结果存在各种争议。本课题组的前期研究[5]显示:visfatin在T2DM患者血清及体内网膜脂肪组织中呈明显高表达,提示两者可能存在关联,但前期研究只是揭示了两者之间的表象,同时带来了新的问题,即visfatin与T2DM的胰岛素抵抗 (insulin resistance,IR) 是否存在因果关系问题。为进一步探讨两者之间的关系,本课题组在前期研究基础上,以体外培养T2DM脂肪细胞为载体,检测在visfatin不同程度过表达状态下,脂肪细胞中胰岛素受体下游信号分子——胰岛素受体底物1/2 (insulin receptor substrate,IRS-1/2)、磷脂酰肌醇-3-激酶 (phosphatidy inositol-3 kinase,PI3K) mRNA及蛋白表达、IRS-1/2酪氨酸磷酸化水平的变化以及细胞葡萄糖摄取率的变化,从胰岛素经典信号传导通路 (IRS-1/2和PI3K) 角度探讨visfatin与T2DM的IR的关系,为研究T2DM发病机制和治疗策略提供线索。
1 材料与方法 1.1 人前脂肪细胞复苏和传代培养将本课题组之前冻存细胞进行复苏和传代,具体操作方法见本课题组之前发表的文献[5]。人T2DM大网膜前脂肪细胞主要由T2DM腹腔手术患者提供,符合人体试验伦理学标准,经昆明医科大学第六附属医院伦理委员会批准,并获得患者的知情同意。
1.2 人源visfatin过表达载体构建由广州复能基因公司协助构建,制作感受态细胞,visfatin质粒转染大肠杆菌,筛选阳性克隆及扩大培养,抽提无内毒素级别质粒,最终得到visfatin质粒浓度为0.601 g·L-1。
1.3 visfatin质粒转染体外培养脂肪细胞将visfatin质粒分别按照0.0、1.0、2.5和5.0 μg 4个浓度梯度转染T2DM人源第3代传代脂肪细胞,每个浓度转染6孔,文中所有检测均为6孔同时检测,每孔重复检测2次。
1.4 Q-PCR法检测细胞中mRNA表达转染48h后,提取细胞总蛋白和总RNA,Q-PCR检测visfatin、IRS-1、IRS-2和PI3K的mRNA表达。各引物信息为:visfatin,上游引物5′-AGCTGTTCCTGAGGGC TTTGTCAT-3′,下游引物5′-TGGCCACTGTGATTGGATACCAGG-3′;IRS-1,上游引物5′-AATGTCTGTTGTAAAGAGTGGAGC-3′,下游引物5′-GAACTCAGCTCAACATCA GGTAT-3′;IRS-2,上游引物5′-AAAACGACCACAGTCCTACCTC-3′,下游引物5′-CACCTCCCACACCCAATACA-3′;PI3K (P85α),上游引物5′-GGCTGCTAGCCT GCTCTG-3′,下游引物5′-CTTCCTAAGTCACGCACGAT-3′;GAPDH,上游引物5′-CG ACAGTCAGCCGCATCT-3′,下游引物5′-ATGAGTCCTCCACGATACCAA-3′。将定量PCR 96孔板置于冰上,总反应体系为20 μL (相应上下游引物各1 μL、RNA 1 μL、参比染料ROX 10 μL、蒸馏水7 μL),ABI RT-PCR仪,反应条件:95℃、10 s预变性;95℃、15 s,60℃、20 s,72℃、10 s,共40个循环;60℃、30 s定量检测。结果判读:以2-ΔΔct法计算各样本相对拷贝值。
1.5 Western blotting法检测细胞中蛋白表达用BCA蛋白定量试剂盒测定样品中蛋白含量,进行电泳、转膜、孵育抗体及显影,检测细胞中visfatin、IRS-1、IRS-2和PI3K的蛋白表达。文中所使用特异性一抗和通用性二抗均购自广州复能基因公司,所有Western blotting检测图中:上面条带为待测条带,下面条带为β-actin。
1.6 Western blotting法检测酪氨酸磷酸化水平进行不同浓度visfatin质粒转染组IRS-1和IRS-2酪氨酸磷酸化水平检测,使用相应一抗和通用二抗,具体操作同1.5。
1.7 检测visfatin不同浓度质粒转染细胞后葡萄糖的摄取率采用[3H]-2-脱氧-D葡萄糖摄取法检测visfatin不同浓度质粒转染细胞后葡萄糖的摄取率。[3H]-2-脱氧-D-葡萄糖摄取率=计数分钟衰变数×2/蛋白浓度。
1.8 统计学分析文中所有检测均为6孔同时检测,每孔检测2次,每组共12个数据。各项检测均以0.0 μg组为对照组,首先计算其均值,而后分别计算各组12个数据与对照组均值的比值进行标化,最终各组比值以x±s表示。采用SPSS 20.0统计软件进行统计学分析。多组间计量资料比较采用单因素方差分析。以P < 0.05为差异有统计学意义。
2 结果 2.1 各组visfatin mRNA和蛋白表达水平visfatin mRNA和蛋白表达水平随转染过表达梯度升高而升高,组间比较差异有统计学意义 (P < 0.01)。所构建visfatin过表达载体有效。见表 1。
| (x±s) | ||
| Group | Visfatin mRNA | Visfatin protein |
| Control (0.0 μg) | 1.00±0.04 | 1.00±0.06 |
| Visfatin | ||
| 1.0 μg | 35.15±4.51 | 7.47±1.04 |
| 2.5 μg | 226.21±10.87 | 87.43±5.94 |
| 5.0 μg | 1 104.35±97.87 | 306.47±21.45 |
| F | 177.81 | 106.44 |
| P | 0.000 | 0.000 |
随着visfatin表达水平的增加,IRS-1和PI3K (P85α) mRNA表达水平也明显升高,组间比较差异有统计学意义 (P < 0.05或P < 0.01)。而IRS-2 mRNA表达水平未发生明显变化 (P > 0.05)。见表 2。
| (x±s) | |||
| Group | IRS-1 | IRS-2 | PI3K (P85α) |
| Control (0.0 μg) | 1.00±0.07 | 1.00±0.11 | 1.00±0.08 |
| Visfatin | |||
| 1.0 μg | 1.44±0.26 | 0.94±0.14 | 1.16±0.19 |
| 2.5 μg | 1.71±0.29 | 0.97±0.17 | 2.79±0.22 |
| 5.0 μg | 3.01±0.26 | 0.97±0.13 | 14.73±1.04 |
| F | 22.72 | 0.83 | 48.97 |
| P | 0.013 | 0.694 | 0.007 |
随着visfatin表达水平增加,各组IRS-1和PI3K (P85α) 蛋白表达水平明显升高,组间比较差异有统计学意义 (P < 0.05或P < 0.01),但IRS-2蛋白表达水平未见明显变化 (P > 0.05)。见表 3和图 1。
| (x±s) | |||
| Group | IRS-1 | IRS-2 | PI3K (P85α) |
| Control (0.0 μg) | 1.00±0.14 | 1.00±0.16 | 1.00±0.22 |
| Visfatin | |||
| 1.0 μg | 1.22±0.23 | 0.97±0.11 | 1.77±0.21 |
| 2.5 μg | 2.73±0.31 | 0.99±0.09 | 2.86±0.37 |
| 5.0 μg | 3.12±0.39 | 1.01±0.14 | 3.96±0.47 |
| F | 24.71 | 1.04 | 49.57 |
| P | 0.011 | 0.648 | 0.006 |
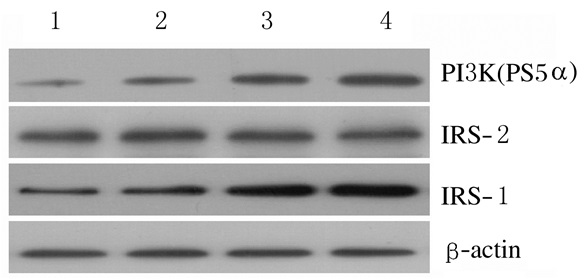
|
| Lane 1-4: 0.0, 1.0, 2.5, and 5.0 μg visfatin groups. 图 1 各组IRS-1、IRS-2和PI3K (P85α) 蛋白表达电泳图 Figure 1 Electrophoregram of expression levels of IRS-1, IRS-2, and PI3K (P85α) protein in various groups |
|
|
随着visfatin表达水平增加,各组IRS-1酪氨酸磷酸化水平明显升高,组间比较差异有统计学意义 (P < 0.05),但IRS-2酪氨酸磷酸化水平未发生明显变化 (P > 0.05)。见表 4和图 2。
| (x±s) | ||
| Group | IRS-1 | IRS-2 |
| Control (0.0 μg) | 1.00±0.07 | 1.00±0.14 |
| Visfatin | ||
| 1.0 μg | 1.09±0.16 | 0.87±0.22 |
| 2.5 μg | 2.16±0.19 | 0.99±0.26 |
| 5.0 μg | 2.39±0.24 | 0.97±0.19 |
| F | 18.610 | 0.940 |
| P | 0.024 | 0.595 |
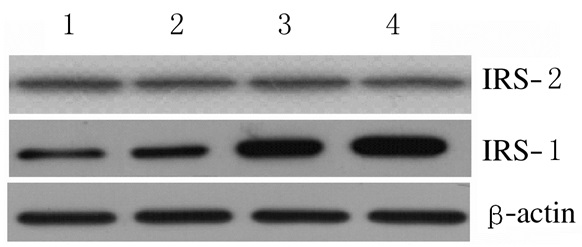
|
| Lane 1-4: 0.0, 1.0, 2.5, and 5.0 μg visfatin groups. 图 2 各组IRS-1和IRS-2酪氨酸磷酸化水平电泳图 Figure 2 Electrophoregram of IRS-1 and IRS-2 phosphorylation levels in various groups |
|
|
随着visfatin表达水平的增加,各组脂肪细胞的葡萄糖摄取率明显升高,0.0、1.0、2.5和5.0 μg visfatin组脂肪细胞葡萄糖摄取率分别为1.00±0.21、1.21±0.18、1.26±0.23和1.44±0.27,组间比较差异有统计学意义 (F=8.79,P=0.037)。
3 讨论T2DM病因至今未明,IR及由于IR导致的糖脂代谢紊乱是目前公认的T2DM发病的病理生理基础。近年来研究[6-7]显示:脂肪因子visfatin与肥胖、IR及T2DM密切相关,但具体机制尚不明确。本课题组前期研究[5]显示:T2DM患者血清和网膜组织中脂肪因子visfatin明显升高,与T2DM患者肥胖、血清空腹血糖、血脂明显正相关。为进一步研究其内在联系,本课题组采用了体外表达实验研究。因涉及医学伦理学原因,目前对于基因表达与疾病关系的研究多以体外实验方式进行,常见的是细胞培养和动物模型[8]。学术界针对脂肪展开的生物学研究中多数实验样本均采用啮齿类动物脂肪细胞[9-10]。尤其对于人脂肪细胞的研究,更多的是采用了小鼠3T3-L1前脂肪细胞。但啮齿类动物与人类存在明显的遗传学差异,且两者之间的代谢途径也迥然不同,因此将其作为实验样本往往难以避免潜在的实验缺陷问题,从而影响数据和结论的科学性。本课题组在前期工作中成功建立了T2DM网膜脂肪细胞原代培养及增殖分化模型,以人源细胞作为研究载体,进行后续有关T2DM方面的研究,更具科学性。并且,以取自T2DM网膜组织而培养传代的前脂肪细胞,可能更多地保留了T2DM其他的一些基因信息,更真实地模拟了T2DM基因环境,使结果更具有说服力。这也是本课题得以顺利进行的基础条件和特点之一。
本研究采用了大肠杆菌表达系统,将所构建visfatin过表达载体转染大肠杆菌,筛选阳性克隆及扩大培养后,抽提无内毒素级别质粒,将得到的质粒分别以低 (1.0 μg)、中 (2.5 μg) 和高 (5.0 μg)3个浓度梯度转染T2DM脂肪细胞,以Q-PCR及Western blotting法检测相应mRNA及蛋白表达,发现mRNA及蛋白表达水平均随着质粒转染浓度增加而增加,结果说明:①所构建的T2DM网膜脂肪细胞原代培养及增殖分化模型真实有效,具有正常生理功能和表达能力;②所构建visfatin过表达载体有效,随梯度增加而表达增加。
目前众多研究[11-12]认为:IR主要由受体后信号传导的异常引起。胰岛素受体的信号传导主要经过2个途径,即PI3K途径和Ras-丝分裂原激活的蛋白激酶 (Ras-MAPK) 途径。PI3K途径是胰岛素受体信号传导的经典途径,也是胰岛素对代谢调节的主要途径,主要作用于葡萄糖摄取、糖原合成和降解的调节;Ras-MAPK途径主要与基因转录的调控有关,主要作用于细胞生长和分化的调节[13]。2条途径相互独立,在一定条件下,也能相互激活。
基于上述理论,本研究进行的是visfatin与T2DM胰岛素PI3K经典信号传导途径关系的研究,结果显示:visfatin与T2DM的IR存在紧密的联系,表现为随着visfatin表达水平的增加,细胞中IRS-1和PI3K (P85α) 表达水平也升高,并且伴随IRS-1酪氨酸磷酸化水平明显升高。本文作者认为:IRS是胰岛素信号通路的关键物质,visfatin表达增加,促进了IRS-1的表达增加和活化 (酪氨酸磷酸化),促进了PI3K的表达增加,启动了PI3K信号通路途径,最终促进了脂肪细胞对葡萄糖的摄取。整个过程中,IRS-2 mRNA和蛋白表达及磷酸化程度未发生明显变化,说明visfatin所使用的信号传导途径仅通过IRS-1进行传导,而与IRS-2无关。目前国内外一些研究[14-15]认为:ISR-1的表达可能与具有T2DM家族史的患者密切相关,ISR-1表达不足或者磷酸化异常可导致IR,而IRS-2在IR和T2DM的发生中起着极其重要的作用,一旦IRS-2的表达出现异常,机体将很快出现糖尿病样症状。本研究也证实ISR-1的表达可能与T2DM关系密切,IRS-1和IRS-2存在相对独立的传导方式,一些胰岛素信号的传导,可能仅通过其中一个而完成,并且不存在相互激活的情况。结合之前研究结果,本文作者认为:visfatin的胰岛素增敏机制表现为visfatin过表达增加了IRS-1和PI3K的表达水平,并且促进了IRS-1的活化,从而导致了胰岛素PI3K信号传导通路的活化。
visfatin与T2DM之间是否存在其他途径的内在联系?visfatin对机体胰岛素的增敏效果是否存在一定的限度?若visfatin的表达升高是T2DM发生了IR的一种变应性补偿,那么这种补偿机制更深层次的内在机制是什么?增加visfatin的表达会不会是T2DM治疗的一种新的思路?这些问题有待于学术界的共同努力并进一步深入研究。
| [1] | Wurst U, Ebert T, Kralisch S, et al. Serum levels of the adipokine Pref-1 in gestational diabetes mellitus[J]. Cytokine, 2015, 71(2): 161–164. DOI:10.1016/j.cyto.2014.10.015 |
| [2] | Ma Q, Fan J, Wang J, et al. High levels of chorionic gonadotrophin attenuate insulin sensitivity and promote inflammation in adipocytes[J]. J Mol Endocrinol, 2015, 54(2): 161–170. DOI:10.1530/JME-14-0284 |
| [3] | Pérez-Pérez A, Guadix P, Maymó J, et al. Insulin and leptin signaling in placenta from gestational diabetic subjects[J]. Horm Metab Res, 2016, 48(1): 62–69. |
| [4] | Yu H, Liu JC, Fan YJ, et al. Association between occupational stressors and type 2 diabetes among Chinese police officers:a 4-year follow-up study in Tianjin, China[J]. Int Arch Occup Environ Health, 2016, 89(2): 277–288. DOI:10.1007/s00420-015-1071-9 |
| [5] | 陈卓. 妊娠期糖尿病外周和内脏脂肪组织Omentin、Islet-1、Vaspin mRNA表达差异与胰岛素抵抗的研究[D]. 昆明: 昆明医科大学, 2011. http://www.cnki.com.cn/Article/CJFDTotal-XXYX200901017.htm |
| [6] | Patel TP, Rawal K, Bagchi AK, et al. Insulin resistance:an additional risk factor in the pathogenesis of cardiovascular disease in type 2 diabetes[J]. Heart Fail Rev, 2016, 21(1): 11–23. DOI:10.1007/s10741-015-9515-6 |
| [7] | Song T, Luo Y, Wang X, et al. Clinical characteristics of Chinese with over 40 years of duration of type 2 diabetes[J]. J Diabetes, 2016, 34(2): 116–124. |
| [8] | Rho YH, Lu N, Peloquin CE, et al. Independent impact of gout on the risk of diabetes mellitus among women and men:a population-based, BMI-matched cohort study[J]. Ann Rheum Dis, 2016, 75(1): 91–95. DOI:10.1136/annrheumdis-2014-205827 |
| [9] | Wang C, Wang L, Li W, et al. Irisin has no effect on lipolysis in 3T3-L1 adipocytes or fatty acid metabolism in HepG2 hepatocytes[J]. Endocrine, 2015, 49(1): 90–96. DOI:10.1007/s12020-014-0458-9 |
| [10] | 聂绪强, 杨建文, 史海霞, 等. IR-3T3-L1脂肪胰岛素抵抗细胞的建立[J]. 南方医科大学学报, 2015, 35(1): 103–108. |
| [11] | Inoue H. Central insulin-mediated regulation of hepatic glucose production[J]. Endocr J, 2016, 63(1): 1–7. DOI:10.1507/endocrj.EJ15-0540 |
| [12] | Pavan Kumar N, Nair D, Banurekha VV, et al. Type 2 diabetes mellitus coincident with pulmonary or latent tuberculosis results in modulation of adipocytokines[J]. Cytokine, 2016, 79: 74–81. DOI:10.1016/j.cyto.2015.12.026 |
| [13] | Wang Y, Wang J, Zhao Y, et al. Fucoidan from sea cucumber Cucumaria frondosa exhibits anti-hyperglycemic effects in insulin resistant mice via activating the PI3K/PKB pathway and GLUT4[J]. J Biosci Bioeng, 2016, 121(1): 36–42. DOI:10.1016/j.jbiosc.2015.05.012 |
| [14] | Wang N, Li T, Han P. The effect of Tianmai Xiaoke Pian on insulin resistance through PI3-K/AKT signal pathway[J]. J Diabetes Res, 2016, 2016(1): 926–932. |
| [15] | Akbarzadeh S, Eskandari F, Tangestani H, et al. The effect of Stevia rebaudiana on serum omentin and visfatin level in STZ-induced diabetic rats[J]. J Diet Suppl, 2015, 12(1): 11–22. DOI:10.3109/19390211.2014.901999 |
 2017, Vol. 43
2017, Vol. 43


