扩展功能
文章信息
- 陈晓娜, 王晓丹, 孙丽光, 方芳, 崔巍巍, 杨永广, 刘娅
- CHEN Xiaona, WANG Xiaodan, SUN Liguang, FANG Fang, CUI Weiwei, YANG Yongguang, LIU Ya
- 携带hTERT-P2A-EGFP基因真核表达质粒的构建和鉴定
- Construction and identification of eukaryotic expression plasmid carrying hTERT-P2A-EGFP
- 吉林大学学报(医学版), 2017, 43(02): 213-219
- Journal of Jilin University (Medicine Edition), 2017, 43(02): 213-219
- 10.13481/j.1671-587x.20170201
-
文章历史
- 收稿日期: 2016-09-14
2. 吉林大学第一医院转化医学研究院, 吉林 长春 130061;
3. 吉林大学免疫学研究所, 吉林 长春 130061
2. Academy of Translational Medicine, First Hospital, Jilin University, Changchun 130061, China;
3. Institute of Immunology, Jilin University, Changchun 130061, China
端粒位于真核细胞线状染色体的末端,是由串联重复的短双链序列 (TTAGGG) 和结合蛋白形成的复合体[1],在维持染色体基因组完整性和功能稳定性方面有重要作用[2]。细胞每分裂1次,染色体末端的端粒就会缩短一些,当端粒缩短到一定程度,细胞将停止分裂并衰老死亡[3]。端粒酶在细胞中负责端粒的延长,其可以把端粒修复延长,使端粒不会因细胞分裂而有所缩短,进而增强了细胞的分裂能力[4]。人端粒酶逆转录酶 (human telomerase reverse transcriptase,hTERT) 是人类端粒酶蛋白的催化亚单位[5],hTERT的转录调控是限制端粒酶活性的主要因素[6]。近年来,研究[7-8]证实:在端粒酶阴性细胞系中转入hTERT基因可以引起端粒延长,从而导致细胞生命周期的延长,hTERT基因的表达是端粒酶活性调节的关键步骤。本研究构建携带hTERT基因和增强绿色荧光蛋白 (enhanced green fluorescentce protein, EGFP) 的重组质粒,并检测重组质粒对HEK293FT细胞的感染能力,为进一步研究hTERT基因的功能及构建永生化细胞系奠定基础。
1 材料与方法 1.1 质粒、菌株和细胞pBABE-puro-hTERT质粒由Bob Weinberg实验室惠赠,Trans1-T1 Chemically Comptent Cell购自北京Transgen公司,pRRLSIN-cPPT-MSCV-EGFP质粒和P2A序列及HEK293FT细胞由吉林大学白求恩第一医院转化医学研究院杨永广实验室赠送。
1.2 工具酶和试剂Eastep质粒小提试剂盒和Eastep凝胶及PCR回收试剂盒购自美国Promega公司,EndoFree Plasmid Maxi Kit购自美国QIAGEN公司,FastDigest EcoRⅠ、FastDigest SalⅠ、FastDigest SgsⅠ、FastDigest XhoⅠ、FastDigest DpnⅠ和T4 DNA Ligase购自美国Thermo公司,PrimeSTAR GXL DNA Polymerase购自日本TaKaRa公司,Lipofectamine 2000购自美国Invitrogen公司,氨苄青霉素 (Ampicillin Sodium Salt) 购自美国Ameresco公司。
1.3 引物的设计和合成根据hTERT、P2A和EGFP序列,应用Oligo软件设计引物,引物信息见表 1。引物合成和测序由库美生物公司完成。
| Gene | Primer sequence (5′-3′) | |
| hTERT | F | ATGCCGCGCGCTCC |
| R | GTCCAGGATGGTCTTGAAGTC | |
| P2A | F | AGACTTCAAGACCATCCTGGACCGTGCCAAGCGAGGC |
| R | CTCGCCCTTGCTCACCATTGGTCCTGGGTTCTCCTC | |
| GFP | F | ATGGTAGCAAGGGCGA |
| R | TTACTTGTACAGCTCGTCCATG | |
| hTERT-P2A-EGFP | F | CCGGAATTCGCCACCATGCCGCGCGCTCC |
| R | ACGCGTCGACTTACTTGTACAGCTCGTCCATG | |
| 2000 bp mutation | F | GATGAGCGTGCGGGACTGCGCTTGGCTGC |
| R | GCAGCCAAGCGCAGTCCCGCACGCTCATC |
以hTERT、P2A和EGFP质粒为模板,分别扩增hTERT、P2A和EGFP目的片段。PCR反应体系50 μL:模板50ng,PrimeSTAR GXL DNA Polymerase1 μL, dNTP Mixture 4 μL, 上游引物1 μL,下游引物1 μL, 去离子水补加到50 μL。PCR反应条件:98℃预变性1 min,98℃变性15s,50℃~60℃退火15s,72℃延伸9 min,30~35个循环,最后12℃保温。PCR产物经1%琼脂糖电泳后回收。
1.5 真核表达质粒hTERT-P2A-EGFP的构建以凝胶回收的3个目的片段为模板,进行聚合酶链式反应,得到目的基因片段。PCR的反应体系和反应条件同1.4。将载体骨架 (pRRLSIN-cPPT-MSCV-) 和目的片段 (hTERT-P2A-EGFP) 酶切,反应体系60 μL:PCR产物2 μg,SgsⅠ 2 μL,SalⅠ 2 μL,10 Buffer 6 μL,去离子水补加到60 μL,反应条件:37℃、30 min,琼脂糖凝胶电泳后回收。连接反应20 μL体系:载体与插入片段比为1:3,T4 DNA Ligase 2 μL,10×T4 DNA Ligase Buffer 2 μL,去离子水补加到20 μL,反应条件16℃过夜连接。将连接产物20 μL转入到100 μL的感受态细胞内,轻弹混匀,冰浴30 min,42℃热击30s,立即置于冰上2 min,在离心管中加入LB培养基900 μL,放入摇床,37℃、200r·min-1离心1h。取200 μL菌液涂于含Ampicillin Sodium Salt的琼脂糖平板上,37℃过夜培养,挑取抗性单菌落,进行质粒DNA扩增,应用Eastep质粒小提试剂盒抽提质粒DNA,用SalⅠ和SgsⅠ限制性内切酶进行酶切,1%琼脂糖凝胶电泳,观察是否出现4300 bp的条带。
1.6 质粒序列测定和定点突变重组质粒 (hTERT-P2A-EGFP) 酶切,1%琼脂糖凝胶电泳,将电泳后出现4300bp条带的质粒送至库美生物公司进行测序。经测序质粒目的基因中存在一位点突变,且为错义突变,利用FastDigest DpnⅠ进行定点突变。
1.7 HEK293FT细胞的培养和质粒转染将HEK293FT细胞复苏后,置于含有10% FBS的DMEM培养基中,于37℃、饱和湿度、5.0% CO2的培养箱中培养,待细胞长满80%~90%时,胰酶消化回收细胞,取pRRLSIN-cPPT-MSCV-hTERT-P2A-EGFP质粒各2 μg,按照Lipofectamine 2000的转染程序及操作步骤转染HEK293FT细胞,空白对照组不加质粒,转染24 h后可用荧光显微镜观察细胞状态及绿色荧光。
1.8 流式细胞术检测质粒的转染效率质粒转染HEK293FT细胞48 h后,将细胞用胰酶消化,4℃、1650 r·min-1离心5 min,然后采用FACS溶液将细胞重悬,使之形成单细胞悬液,流式细胞术观察HEK293FT细胞中绿色荧光蛋白 (green fluorescence protein, GFP) 的阳性率,以GFP的阳性率来表示质粒的转染效率。
2 结果 2.1 目的片段hTERT、P2A和EGFP获取PCR得到的hTERT、P2A和EGFP目的片段,经1%琼脂糖凝胶电泳检测,与预期大小一致。见图 1。
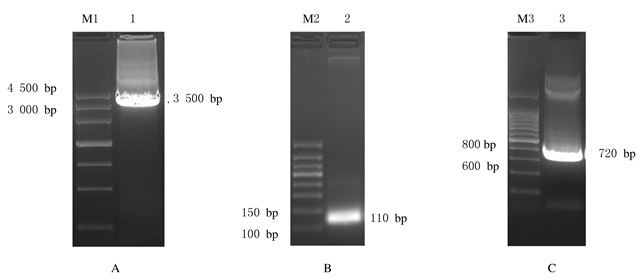
|
| A:hTERT; B:P2A; C:EGFP; M1:MarkerⅢ; Lane 1:hTERT (3 500 bp); M2:50 bp DNA marker; Lane 2: P2A (110 bp); M3:200bp DNA marker; Lane 3: EGFP (720 bp). 图 1 目的片段PCR扩增后电泳图 Figure 1 Electrophoregram of target fragments after amplified by PCR |
|
|
以凝胶回收的3个目的片段为模板,进行PCR反应,用1%琼脂糖凝胶电泳检测PCR产物。见图 2。
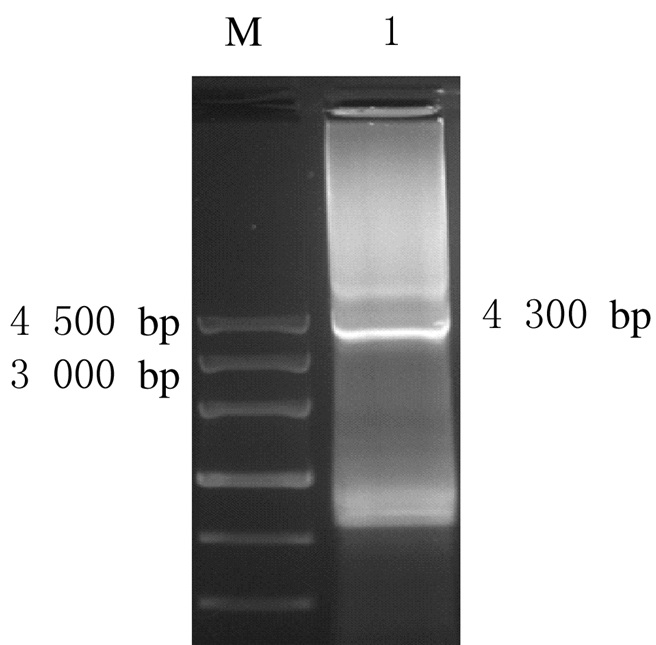
|
| M:MarkerⅢ; Lane 1:hTERT-P2A-EGFP (4 300 bp). 图 2 目的片段PCR扩增后电泳图 Figure 2 Electrophoregram of target fragments after amplified by PCR |
|
|
载体pRRLSIN-cPPT-MSCV-EGFP质粒经SalⅠ和SgsⅠ双酶切后,可见约6500 bp的线性质粒片段;将插入片段hTERT-P2A-EGFP经同样酶切后,通过电泳可观察到目的片段,全长约为4 300 bp。见图 3。采用T4 DNA Ligase, 按载体与插入片段比为1:3进行过夜连接反应。
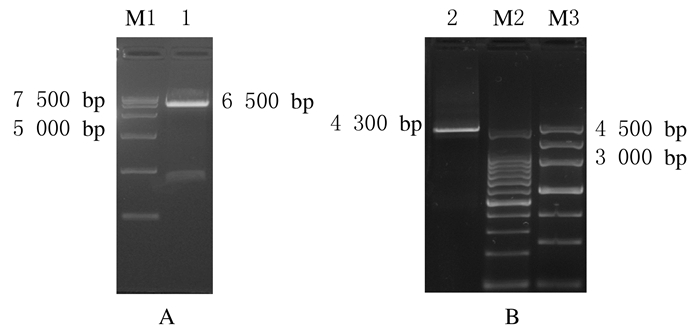
|
| A: Vector; B: hTERT-P2A-EGFP; M1: DL 15 000 DNA marker; Lane 1: Vector (6 500 bp); Lane 2: hTERT-P2A-EGFP (4 300 bp); M2:200 bp DNA marker; M3: Marker Ⅲ. 图 3 载体和目的片段酶切电泳图 Figure 3 Electrophoregram of enzyme digestion of vector and target fragment |
|
|
在0~12泳道中,0泳道的酶切片段小于4 000 bp,1~11泳道酶切后无目的片段,说明载体和目的片段未连接成功。仅有第12泳道的质粒经酶切后目的条带约4300 bp,与预期结果一致,见图 4。因此,将第12泳道的质粒送往公司测序。
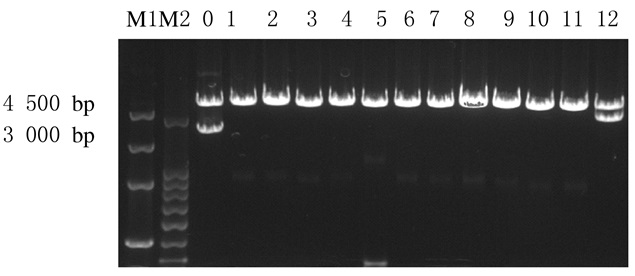
|
| M1: MarkerⅢ; M2:200bp DNA ladder; Lane0-12:Recombinant plasmids. 图 4 重组质粒酶切后电泳图 Figure 4 Electrophoregram of recombinant plasmids after enzyme digestion |
|
|
测序结果显示:与GenBank公布的标准基因序列比较,在1547位点发生突变,由A突变为G,经氨基酸翻译,由天冬氨酸变为甘氨酸,为错义突变。见图 5。

|
| 图 5 重组质粒DNA序列 Figure 5 DNA sequence of recombinant plasmid |
|
|
由于重组质粒的1547位点发生了错义突变,因此将含有突变位点的部分目的基因片段酶切,连入空载体 (pEASY Blunt Simple Cloning Vector) 中,设计含有1547位点正确碱基的引物,利用定点突变技术,使序列发生改变。经过序列分析,突变位点左右两端有2个酶切位点,分别为SgsⅠ和XhoⅠ。质粒双酶切后,可见约2000 bp的线性质粒片段。见图 6。
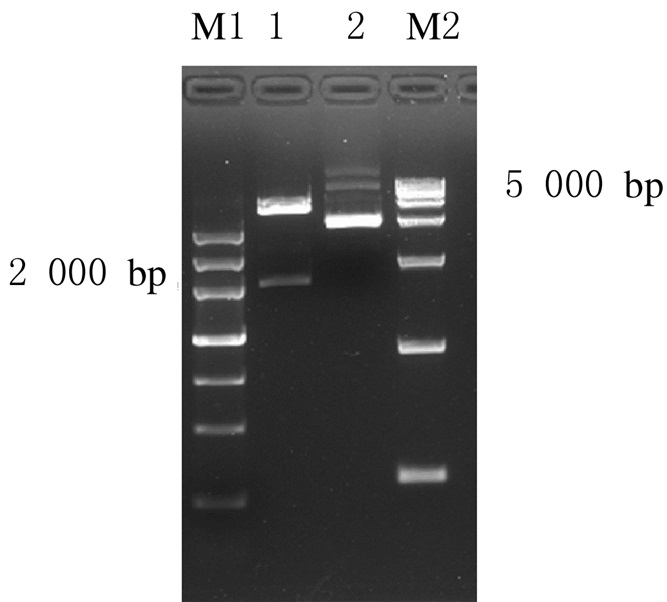
|
| M1: MarkerⅢ; Lane1: Plasmid with enzyme digestion; Lane2:Plasmid without enzyme digestion; M2: DL15000 DNA marker. 图 6 质粒酶切电泳图 Figure 6 Electrophoregram of enzyme digestion of plasmids |
|
|
空载体 (pEASY Blunt Simple Cloning Vector) 和2000 bp片段进行连接,过夜连接后,转化并提取质粒,用含有1547位点正确碱基的引物进行PCR反应。将反应产物转入感受态中,扩增并提取质粒,采用SgsⅠ和XhoⅠ限制性内切酶进行酶切,1%琼脂糖凝胶电泳,观察目的条带。质粒经酶切后产生2000bp的目的条带与预期结果一致。见图 7。

|
| M: MarkerⅢ; Lane1-6: Plasmids without enzyme digestion; Lane 7-12: Plasmids with enzyme digestion. 图 7 质粒酶切电泳图 Figure 7 Electrophoregram of enzyme digestion of plasmids |
|
|
测序结果显示:与点突前比较,点突后的质粒与标准序列一致。见图 8。

|
| 图 8 点突后DNA序列 Figure 8 DNA sequence after site mutation |
|
|
突变后的2 000 bp片段与载体相连,连接产物转入感受态中,扩增质粒后,酶切电泳,其中3、4、5、6、7、9、10、11、13、14、15、16、17和18泳道出现了目的条带 (约4 300 bp)。见图 9。
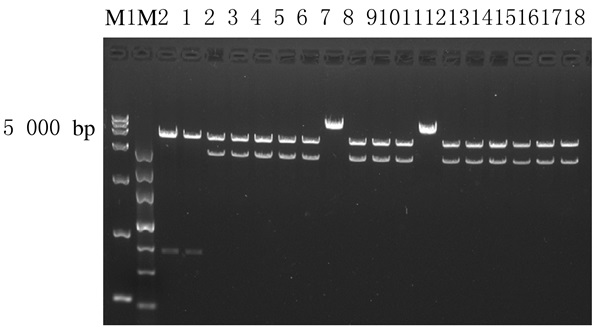
|
| M1: DL 15 000 DNA marker; M2: MarkerⅢ; Lane 1-18: Recombinant plasmids after site mutation. 图 9 点突后重组质粒酶切电泳图 Figure 9 Electrophoregram of enzyme digestion of recombinant plasmids after site mutation |
|
|
利用Lipofectamine 2000将序列正确的重组质粒转染HEK293FT细胞,24h后荧光显微镜观察显示:与阴性对照组比较,实验组 (质粒转染) 可观察到明显的绿色荧光。见图 10(插页一)。

|
| A: Negative control (fluorescent); B: Negative control (bright); C: Experimental group (fluorescent); D: Experimental group (bright). 图 10 质粒转染HEK293FT细胞后EGFP的表达 (免疫组织化学,×100) Figure 10 Expressions of EGFP in HEK293FT cells after transfected with plasmid (Immunohistochemistry, ×100) |
|
|
质粒转染HEK293FT细胞48h后,将细胞用胰酶消化,离心重悬,经流式细胞仪检测质粒的转染效率约为44.8%。见图 11。
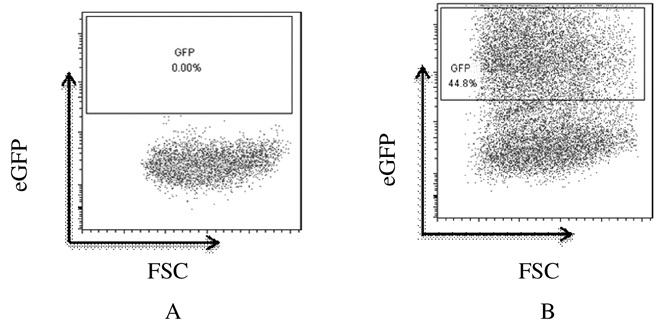
|
| A: Negative control group; B: Experimental group. 图 11 质粒转染48h后HEK293FT细胞流式细胞术检测结果 Figure 11 Results of flow cytometry of HEK293FT cells 48h after plasmid transfection |
|
|
目前,端粒和端粒酶是分子生物学领域的研究热点。端粒是真核细胞染色体末端的特殊结构,是由富含G的端粒DNA和端粒结合蛋白组成的核糖核酸的蛋白质复合物[9]。在正常的体细胞中,随着细胞分裂次数的增加,端粒不断缩短[10],当细胞中染色体末端的端粒缩短到一定程度,细胞就会停止分裂,使细胞衰老[11-12]。端粒酶是一种逆转录酶,与相关蛋白组成一种核糖核蛋白复合体,其以自身为模板逆转录合成端粒重复序列以维持端粒长度[13]。端粒酶逆转录酶 (TERT) 是端粒酶的催化亚单位,其表达水平与端粒酶活性一致[14]。正常情况下,大多数体细胞端粒酶的表达是低水平的,研究[15-16]表明:外源性hTERT基因的表达可以恢复端粒酶阴性细胞中端粒酶的活性,进而延长细胞体外培养寿命甚至可使其达到永生化,且不改变细胞的正常功能。表达外源hTERT,可以使某些类型的细胞永生化,Vidale等[17]用hTERT建立了马科动物成纤维细胞系,Yao等[18]利用hTERT建立了永生化的间充质基质细胞系。本研究通过构建含有hTERT基因的质粒,为后续建立永生化细胞系提供基础。
与仅含有hTERT基因的质粒比较,本研究构建的是具有EGFP标记的hTERT真核质粒。在细胞生物学与分子生物学领域中,GFP是一种报告分子[19],敏感性强且性质稳定,通常不影响目的基因表达产物的生物学活性[20-22]。本研究利用GFP独特的发光机制,将EGFP作为蛋白质标签,即利用DNA重组技术,将目的基因 (hTERT) 与GFP基因构成融合基因,转染HEK293FT细胞,然后借助荧光显微镜直观地判断转染效率,并间接判断目的蛋白在细胞中的表达。
与其他利用双启动子或添加内部核糖体进入位点 (internal ribosome entry site,IRES) 构建的重组质粒比较,本研究利用P2A序列将目的基因hTERT和EGFP连接,使之共表达。目前,常用的多基因共表达方法有使用双启动子、在目的基因之间添加IRES、多个质粒共转染等。但是这些方法均存在一些缺陷,如启动子之间相互干扰,被表达的目的基因起始效率低,上下游的目的基因表达不平衡,其中IRES下游的蛋白翻译表达效率远低于同一开放阅读框中上游蛋白的翻译水平[23]。与IRES比较,P2A的序列短且能够调节多基因独立表达且表达效率高[24],使目的基因与EGFP能同时表达,且不影响各自的活性和功能。质粒转染细胞后,绿色荧光既能标记被转染的细胞,又不会干扰hTERT的表达。
本实验中重组hTERT-P2A-EGFP质粒转染HEK293FT细胞,绿色荧光观察和流式细胞术结果均表明质粒能够在细胞中表达,为后续实验中TERT慢病毒的制备及永生化细胞系的建立奠定了基础。
| [1] | Wojtyla A, Gladych M, Rubis B. Human telomerase activity regulation[J]. Mol Biol Rep, 2011, 38(5): 3339–3349. DOI:10.1007/s11033-010-0439-x |
| [2] | Hayashi MT, Cesare AJ, Rivera T, et al. Cell death during crisis is mediated by mitotic telomere deprotection[J]. Nature, 2015, 522(7557): 492–496. DOI:10.1038/nature14513 |
| [3] | Dessauge F, Lollivier V, Ponchon B, et al. Effects of nutrient restriction on mammary cellturnover and mammary gland remodeling in lactating dairy cows[J]. J Dairy Sci, 2011, 94(9): 4623–4635. DOI:10.3168/jds.2010-4012 |
| [4] | Shukla S, Acharya S, Rajput D, et al. Telomere-the twilight to immortality[J]. J Assoc Physicians India, 2010, 58(31): 553–560. |
| [5] | Zvereva MI, Shcherbakova DM, Dontsova OA. Telomerase:structure, functions, and activity regulation[J]. Biochemistry (Mosc), 2010, 75(13): 1563–1583. DOI:10.1134/S0006297910130055 |
| [6] | Osterhage JL, Friedman KL. Chromosome end maintenance by telomerase[J]. J Biol Chem, 2009, 284(24): 16061–16065. DOI:10.1074/jbc.R900011200 |
| [7] | Domenech A, Raynes JG, Rodriquez EG, et al. Recombinant expression of goat milk serum amyloid A:preliminary studies of the protein and derived peptides on macrophage phagocytosis[J]. Protein Pept Lett, 2012, 19(3): 299–307. DOI:10.2174/092986612799363217 |
| [8] | Hasegawa T, Chosa N, Asakawa T, et al. Establishment of immortalized human periodontalligament cells derived from deciduous teeth[J]. Int J Mol Med, 2010, 26(5): 701–705. |
| [9] | Low KC, Tergaonkar V. Telomerase:central regulator of all of the hallmarks of cancer[J]. Trends Biochem Sci, 2013, 38(9): 426–434. DOI:10.1016/j.tibs.2013.07.001 |
| [10] | D'Souza Y, Chu TW, Autexier C. A translocation-defective telomerase with low levels of activity and processivity stabilizes short telomeres and confers immortalization[J]. Mol Biol Cell, 2013, 24(9): 1469–1479. DOI:10.1091/mbc.E12-12-0889 |
| [11] | Miller J, Dakic A, Chen R, et al. HPV16 E7 protein and hTERT proteins defective for telomere maintenance cooperate to immortalize human keratinocytes[J]. PLoS Pathog, 2013, 9(4): e1003284. DOI:10.1371/journal.ppat.1003284 |
| [12] | Artandi SE. Telomeres, telomerase, and human disease[J]. N Engl J Med, 2006, 355(12): 1195–1197. DOI:10.1056/NEJMp068187 |
| [13] | Balducci L, Blasi A, Saldarelli M, et al. Immortalization of human adipose-derived stromal cells:production of cell lines with high growth rate, mesenchymal marker expression and capability to secrete high levels of angiogenic factors[J]. Stem Cell Res Ther, 2014, 5(3): 63. DOI:10.1186/scrt452 |
| [14] | Daniel M, Peek GW, Tollefsbol TO. Regulation of the human catalytic subunit of telomerase (hTERT)[J]. Gene, 2012, 498(2): 135–146. DOI:10.1016/j.gene.2012.01.095 |
| [15] | Li NF, Broad S, Lu YJ, et al. Human ovarian surface epithelial cells immortalized with hTERT maintain functional pRb and p53 expression[J]. Cell Prolif, 2007, 40(5): 780–794. DOI:10.1111/cpr.2007.40.issue-5 |
| [16] | Abdallah BM, Haack-Sørensen M, Burns JS, et al. Maintenance of differentiation potential of human bone marrow mesenchymal stem cells immortalized by human telomerase reverse transcriptase gene despite[J]. Biochem Biophys Res Commun, 2005, 326(3): 527–538. DOI:10.1016/j.bbrc.2004.11.059 |
| [17] | Vidale P, Magnani E, Nergadze SG, et al. The catalytic and the RNA subunits of human telomerase are required to immortalize equid primary fibroblasts[J]. Chromosoma, 2012, 121(5): 475–488. DOI:10.1007/s00412-012-0379-4 |
| [18] | Yao CL, Hwang SM. Immortalization of human mesenchymal stromal cells with telomerase and red fluorescence protein expression[J]. Methods Mol Biol, 2012, 879: 471–478. DOI:10.1007/978-1-61779-815-3 |
| [19] | Ebe T. Green fluorescent protein as a marker gene expression[J]. Tanpakushitsu Kakusan Koso, 2007, 52(13 Suppl): 1766–1767. |
| [20] | 杨慧敏, 李文刚, 吴高峰, 等. 绿色荧光蛋白的研究进展[J]. 中国畜牧兽医, 2008, 35(8): 29–32. |
| [21] | 王晓丽, 邵卫星, 单虎. 绿色荧光蛋白研究进展[J]. 动物医学进展, 2008, 29(1): 56–59. |
| [22] | 刘伟, 王杰, 幸永明, 等. 绿色荧光蛋白标记SOX9基因慢病毒载体的构建及在兔骨髓间充质干细胞中的表达[J]. 中国实验诊断学, 2017, 21(1): 140–145. |
| [23] | Chan HY, Sivakamasundari V, Xing X, et al. Comparison of IRES and F2A-based locus-specific multicistronic expression in stable mouse lines[J]. PLoS One, 2011, 6(12): e28885. DOI:10.1371/journal.pone.0028885 |
| [24] | Deng W, Yang D, Zhao B, et al. Use of the 2A peptide for generation of multi-transgenic pigs through a single round of nuclear transfer[J]. PLoS One, 2011, 6(5): e19986. DOI:10.1371/journal.pone.0019986 |
 2017, Vol. 43
2017, Vol. 43


