扩展功能
文章信息
- 贾荣, 季红
- JIA Rong, JI Hong
- 超声波辅助乙醇提取山葡萄籽多酚的工艺研究
- Study on extracting polyphenols from Vitis amurensis seeds through ultrasound-assisted method using ethanol
- 吉林大学学报(医学版), 2017, 43(01): 190-195
- Journal of Jilin University (Medicine Edition), 2017, 43(01): 190-195
- 10.13481/j.1671-587x.20170138
-
文章历史
- 收稿日期: 2016-09-10
2. 内蒙古自治区包头市医疗机构药品和医用耗材网上集中采购服务管理中心, 内蒙古 包头 014010
2. Baotou Online Centralized Purchase Service Management Center of Medical Institutions of Drug and Medical Consumables, Baotou 014010, China
山葡萄(Vitis amurensis Rupr)也称东北山葡萄,又名野葡萄,为葡萄科落叶藤本,主要分布在我国东北三省和内蒙古等地[1],资源丰富,可药食两用。目前,山葡萄主要用来酿酒,在其加工过程中会产生大量的山葡萄籽,山葡萄籽中含有丰富的多酚类物质。研究[2-3]表明:葡萄籽提取物中多酚类物质在体内的抗氧化效果约为维生素C的20倍,维生素E的50倍,是迄今为止发现的植物来源中最高效的抗氧化剂之一。因此,葡萄籽多酚的提取和应用备受国内外学者[4-7]的关注。但在相关文献中葡萄多酚的提取大多采用传统溶剂浸提法,该法提取时间长,溶剂消耗量大,提取效率低。近年来,超声波提取法在多酚提取方面的应用越来越广泛,该方法利用超声波的机械破碎和空化效应,能加速有效成分的扩散和溶解,减少杂质成分的溶出,且避免高温对多酚成分的破坏,能最大程度保持有效成分活性,具有提取时间短、高效率、温度低和多酚结构没有破坏等优点[8-10]。目前,超声波辅助乙醇提取山葡萄籽多酚的方法尚未见报道。本文作者采用超声波辅助乙醇提取法,对酿酒后山葡萄籽中多酚类物质进行提取,旨在寻找一种低成本、高效率的山葡萄籽多酚提取方法,为山葡萄籽的进一步开发和合理利用提供参考。
1 材料与方法 1.1 样品与试药酿酒山葡萄籽(吉林省柳河县酒厂提供),没食子酸对照品(中国药品生物制品检定所提供),乙醇和碳酸钠等试剂均为国产分析纯。
1.2 主要仪器AB204-E分析天平(瑞士梅特勒公司), KQ3200DE型医用数控超声波清洗器(江苏省昆山市超声仪器有限公司),SHHW21-Cr三用电热恒温水箱(北京长安科学仪器厂),RE-52A旋转蒸发器(上海亚荣生化仪器厂),722-可见分光光度计(上海精密科学仪器有限公司),D2F-6020型真空干燥箱(上海博迅实业有限公司)。
1.3 原料处理收集酿酒后的山葡萄籽,进行挑选、清洗、自然风干后,粉碎至60目,得到山葡萄籽粉末,备用。
1.4 山葡萄籽多酚的提取方法取山葡萄籽粉末适量,置入锥形瓶中,按一定的料液比加入一定比例的乙醇溶液,在一定温度、功率和时间下,超声提取,提取液滤过,定容至刻度,作为样品溶液,待测。
1.4.1 提取溶剂浓度的确定在料液比为1:8,温度为45℃,超声波功率为120W,超声30 min,提取1次的条件下,计算乙醇浓度分别为20%、40%、60%、80%和95%时山葡萄籽多酚的提取率。
1.4.2 提取时间的确定在料液比为1:8,乙醇浓度为60%,温度为45℃,超声波功率为120W,提取1次的条件下,计算超声时间分别为10、20、30、40和60 min时山葡萄籽多酚的提取率。
1.4.3 提取温度的确定在料液比为1:8,乙醇浓度为60%,超声波功率为120W,超声30 min,提取1次的条件下,计算温度分别为25℃、35℃、45℃、55℃和65℃时山葡萄籽多酚的提取率。
1.4.4 料液比的确定在乙醇浓度为60%,温度为45℃,超声波功率为120W,超声30 min,提取1次的条件下,计算料液比分别为1:4、1:6、1:8、1:10和1:12时山葡萄籽多酚的提取率。
1.4.5 提取次数的确定在料液比为1:8,乙醇浓度为60%,温度为45℃,超声波功率为120W,超声30 min的条件下,计算提取次数分别为1、2、3、4和5次时山葡萄籽多酚的提取率。
1.4.6 超声功率的确定在料液比为1:8,乙醇浓度为60%,温度为45℃,超声30 min的条件下,计算超声功率分别为50、60、80、100和120W时山葡萄籽多酚的提取率。
1.5 样品含量测定方法采用Folin-Ciocalteu比色法[11]对山葡萄籽提取物中总多酚的含量进行测定。精密量取各提取样品溶液0.5 mL,分别置50 mL容量瓶加水稀释并定容至刻度;再精密量取1mL稀释溶液置10 mL容量瓶中;加蒸馏水3 mL,摇匀;再加FC显色剂1 mL,摇匀;8 min内各加入20%碳酸钠溶液3 mL,用蒸馏水定容至刻度,摇匀,室温下避光放置2h。以相应试剂为空白对照,在760 nm处测定吸光度(A)值,比较各提取样品的A值。
2 结果 2.1 单因素实验 2.1.1 提取溶剂浓度的确定样品溶液的A值随乙醇浓度的增加先上升后下降。当乙醇浓度小于60%时,样品溶液A值逐渐增大,乙醇溶液浓度达到60%时,A值最大,表明提取率最高,而乙醇浓度高于60%后样品溶液A值呈缓慢下降趋势。因为乙醇浓度进一步升高时,溶剂与多酚极性差异增大,根据相似相溶原理,醇溶性杂质等亲脂性成分溶出量增加,与多酚类物质竞争溶剂结合,从而导致山葡萄籽多酚提取率下降,另外提取溶剂浓度越大,生产成本越高,故本实验选择60%的乙醇为提取溶剂。见图 1。
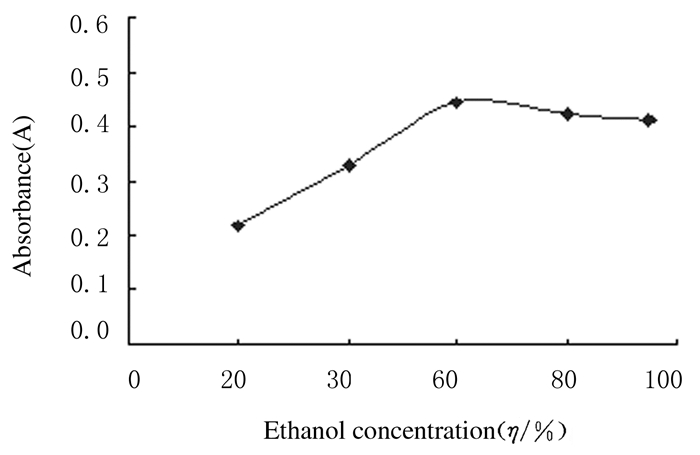
|
| 图 1 不同浓度乙醇时山葡萄籽多酚提取率 Figure 1 Extraction rates of polyphenols with different concentrations of ethanol |
|
|
超声时间在10~30 min内,样品溶液A值呈逐渐增加趋势;当超声时间为30 min时,样品溶液A值最大;超声时间从30 min增加至60 min时,样品溶液A值呈下降趋势。说明超声时间达到30 min时,山葡萄籽多酚化合物的浸出已经很充分,提取量接近饱和,再延长超声时间无明显效果,反而可能有更多的杂质溶出,且提取时间增加可以加速多酚的氧化,从而使产品的有效成分含量减小,综合考虑时间、耗能等因素,超声时间宜选用30 min。见图 2。

|
| 图 2 不同提取时间时山葡萄籽多酚的提取率 Figure 2 Extraction rates of polyphenols at different extraction time |
|
|
当温度从25℃增加至45℃时,样品溶液A值随温度的增加而增大,但当温度继续增加时,A值逐渐减小,提取率下降。原因可能是山葡萄籽多酚物质在高温下不稳定,易被氧化分解破坏,致使提取出来的多酚含量下降,而温度过低不利于超声的空化作用,降低山葡萄籽多酚的提取效果,因此最佳提取温度宜选用45℃。见图 3。
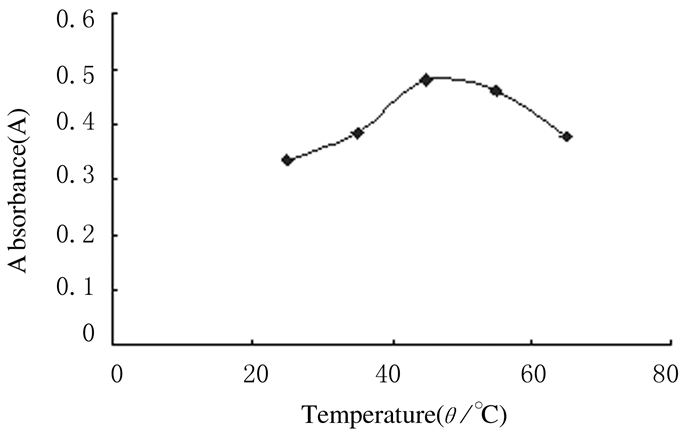
|
| 图 3 不同提取温度时山葡萄籽多酚的提取率 Figure 3 Extraction rates of polyphenols at different extraction temperatures |
|
|
当料液比从1:4增加至1:8时,多酚的提取率随之增加;当料液比达到1:8时,提取率最大;之后随着料液比的增大,多酚的提取效果反而下降。可能是杂质的溶出间接降低了多酚的提取量,同时考虑到提取溶剂的用量过多,能耗大,后续浓缩、过滤和干燥等工作耗时长,因此最佳料液比选择为1:8。见图 4。
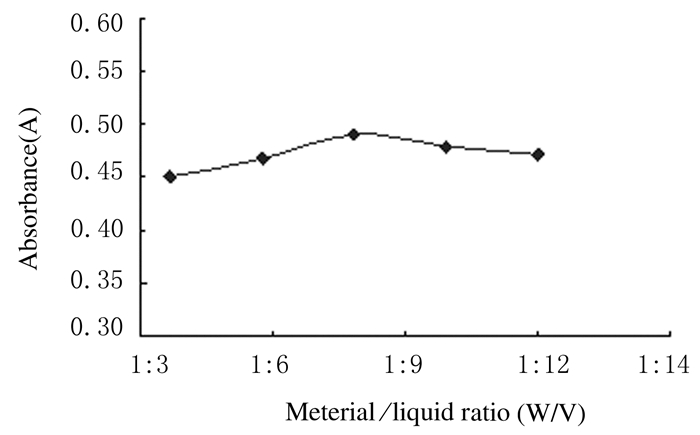
|
| 图 4 不同料液比时山葡萄籽多酚的提取率 Figure 4 Extraction rates of polyphenols with different material/liquid ratios |
|
|
随着提取次数增加,合并提取液后多酚提取率增大,但增加趋势不明显,当提取次数达3次时,多酚提取率就不再增加,之后随提取次数的增加提取率反而下降。一方面由于提取液放置太久多酚易氧化,另一方面提取次数多,合并提取液浓缩时间长,考虑到实验成本和工作时间因素,选择提取次数为2~3次为宜。见图 5。
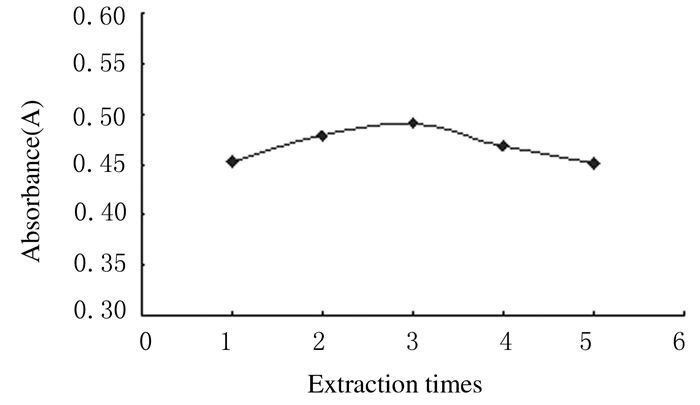
|
| 图 5 不同提取次数时山葡萄籽多酚的提取率 Figure 5 Extraction rates of polyphenols with different extraction times |
|
|
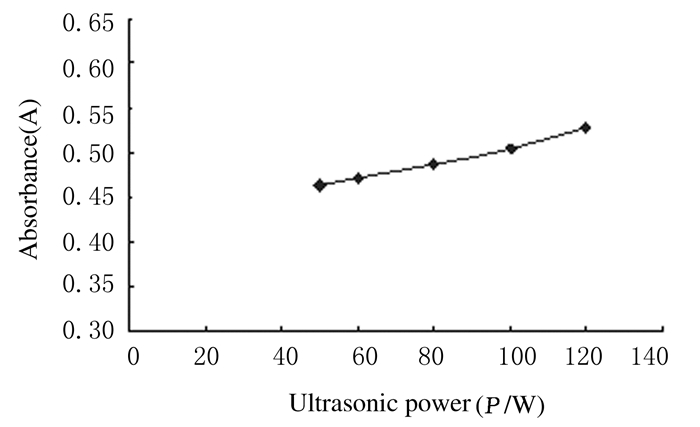
随着超声功率增加,样品溶液A值增大,提取率增加。在观察范围内,120 W时样品溶液A值达到最大值。超声波功率的大小直接影响超声波空化效应,进而影响山葡萄籽多酚的提取效果,增大超声波功率有助于目标产物的提出,但超声波功率过大,其空化效应大幅度增强,容易破坏多酚类物质,提取率下降,且结合实验室条件,本实验选择超声功率为120 W。见图 6。
|
| 图 6 不同超声功率时山葡萄籽多酚的提取率 Figure 6 Extraction rates of polyphenols with different ultrasonic powers |
|
|
在单因素实验基础上,选取超声温度、超声时间、料液比和超声次数作为考察因素,进行4因素3水平的正交试验,观察山葡萄籽粗提物中多酚含量的变化,对其提取条件进行优化,确定最佳提取条件。因素与水平设计见表 1,正交试验结果见表 2。
| Level | A Temperature (θ /℃) | BTime (t/min) | C Material/liquid ratio (W/V) |
D Times (n) |
| 1 | 40 | 30 | 1:7 | 1 |
| 2 | 45 | 35 | 1:8 | 2 |
| 3 | 50 | 40 | 1:9 | 3 |
| Experiment number |
A | B | C | D | Polyphenol content (η/%) |
| 1 | 1 | 1 | 1 | 1 | 24.99 |
| 2 | 1 | 2 | 2 | 2 | 27.61 |
| 3 | 1 | 3 | 3 | 3 | 23.72 |
| 4 | 2 | 1 | 2 | 3 | 28.98 |
| 5 | 2 | 2 | 3 | 1 | 25.79 |
| 6 | 2 | 3 | 1 | 2 | 26.30 |
| 7 | 3 | 1 | 3 | 2 | 32.34 |
| 8 | 3 | 2 | 1 | 3 | 31.37 |
| 9 | 3 | 3 | 2 | 1 | 32.47 |
| K1 | 76.322 | 86.301 | 82.654 | 83.243 | |
| K2 | 81.062 | 84.768 | 89.063 | 86.254 | |
| K3 | 96.180 | 82.496 | 81.848 | 84.068 | |
| R | 6.619 | 1.268 | 2.405 | 1.004 | |
| A:Temperature; B:Time; C:Material/liquid ratio; D:Times. | |||||
由表 2可知:极差分析得到山葡萄籽多酚提取的最佳组合为A3B1C2D2,即超声温度为50℃,超声时间为30 min,料液比为1:8,提取2次,在此条件下提取得到的山葡萄籽提取物中多酚含量最高。为了进一步确定各因素对山葡萄籽多酚含量的影响,对表 2结果进行方差分析,四因素中超声温度对多酚含量的影响最为明显,超声时间、料液比和超声次数对多酚的含量无明显影响,各因素对多酚含量的影响程度为A>C>B>D,即超声温度>料液比>超声时间>超声次数。见表 3。
| Variance sources | Sums of square | Freedom degree | Mean square | F | P |
| A | 71.708 | 2 | 35.854 | 44.424 | <0.05 |
| B | 2.444 | 2 | 1.222 | 1.514 | >0.10 |
| C | 10.422 | 2 | 5.211 | 6.457 | >0.10 |
| D | 1.615 | 2 | 0.807 | 1.000 | >0.10 |
| A:Temperature; B:Time; C:Material/liquid ratio; D:Times. | |||||
为进一步对最佳组合条件进行验证,按正交试验确定的最佳工艺条件对山葡萄籽多酚进行3次平行试验提取,计算山葡萄籽多酚提取物的得率和含量。按正交试验确定的最佳工艺条件提取,所得提取物多酚含量均高于正交试验结果,进一步验证了最佳组合条件的正确性和有效性,说明该方法重复性好,工艺稳定可行。见表 4。
| Sample number |
Material mass (m/g) |
Extraction mass (m/g) |
Yields (η/%) |
Polyphenol content (η/%) |
Average (η/%) |
RSD (η/%) |
| 1 | 100 | 11.46 | 11.46 | 32.79 | ||
| 2 | 100 | 11.32 | 11.32 | 32.55 | 32.72 | 0.40 |
| 3 | 100 | 11.78 | 11.78 | 32.82 |
按照正交试验确定的最佳提取条件,采用超声波提取法和参考文献[12]中所用最佳条件的传统溶剂提取法对酿酒山葡萄籽进行多酚提取,通过计算山葡萄籽多酚提取物的得率和含量,进行2种提取方法的比较。与传统溶剂提取法比较,超声波辅助提取山葡萄籽多酚的提取时间明显缩短,提取溶剂用量减少,且所得山葡萄籽多酚得率(11.71%)比传统提取方法(10.20%)略高,多酚含量为32.85%,提高了4.37%。见表 5。
| Extraction method | Extraction time (t/min) |
Material/liquid ratio (W/V) |
Extraction times | Yields (η/%) |
Polyphenol content (η/%) |
| Ultrasonic extraction | 30 | 1:8 | 2 | 11.71 | 32.86 |
| Traditional extraction | 180 | 1:20 | 2 | 10.20 | 28.49 |
山葡萄在我国种植面积大,产量高,野生和种植资源丰富。山葡萄主要用来酿酒和制作饮品,在其加工过程中会产生大量的葡萄皮渣等废弃物,其中葡萄籽占很大比率,约为葡萄干皮渣的65%[13]。一直以来,山葡萄籽作为加工后的副产品大多数被丢弃,没有很好地被开发和利用,不仅造成了资源的浪费而且污染环境。研究[14-15]显示:葡萄籽中含有大量的多酚类物质,具有抗氧化、抗衰老、抗辐射、降血压、消炎防肿和抗癌等多种生物活性,是一类极具开发前景的天然抗氧化物质。酿酒后的山葡萄籽作为葡萄多酚的重要资源,越来越受到人们的关注。
如何高效提取葡萄籽多酚成为了当前研究的热点之一。常见的植物多酚提取方法有溶剂浸提法、超声波辅助提取法、微波辅助提取法、超临界流体存取法和离子沉淀法等[16-17],其中传统的山葡萄籽多酚提取方法为溶剂浸提法,该方法仪器设备要求不高、实验过程比较简单,但存在溶剂消耗量大、毒性大、提取时间长且效率低等缺点[18]。本研究采用超声波辅助乙醇提取山葡萄籽多酚,综合单因素实验和正交试验优化法,确定多酚提取最佳工艺条件为乙醇浓度60%,超声温度50℃,超声时间30 min,超声功率120W,料液比1:8,超声提取2次。且超声波辅助提取时,山葡萄籽多酚得率和含量均高于传统有机溶剂浸提,综合考虑时间和能耗因素,超声波辅助提取山葡萄籽多酚具有高效、环保和节能等优点,有利于提升山葡萄籽废渣的附加值,具有极大的社会经济价值。该方法不仅效率高,有机溶剂用量少,成本低,而且在很大程度上保持了山葡萄籽的有效活性成分。从节能与资源综合利用等角度来看,超声波辅助提取山葡萄籽多酚比传统的有机溶剂浸提法更具有优势。
本实验结果表明:超声波辅助乙醇提取法与传统溶剂浸提法比较,不仅大大缩短了提取时间,节约了成本,而且多酚结构不易被破坏,多酚提取得率和含量均有所提高,效果优于传统溶剂浸提法,值得推广应用。
| [1] | 崔长伟, 刘丽媛, 王华, 等. 山葡萄综合开发利用研究进展[J]. 食品科学, 2015, 36(13): 276–282. |
| [2] | Wang JN, Chen YJ, Hano Y, et al. Antioxidant activity of polyphenols from seeds of Vitis amurensis in vitro[J]. Acta Pharmacol Sin, 2000, 21(7): 633–636. |
| [3] | 王倩倩, 王振斌, 王世清. 葡萄籽多酚的超声波辅助提取技术[J]. 江苏农业科学, 2011, 39(6): 436–438. |
| [4] | Prasad R, Katiyar SK. Grape seed proanthocyanidins inhibit migration potential of pancreatic cancer cells by promoting mesenchymalto-epithelial transition and targeting NF-κB[J]. Cancer Lett, 2013, 8(7): 139–146. |
| [5] | 郭红珍, 李丛胜, 茹少玉. 酿酒葡萄皮渣中多酚物质提取的研究[J]. 中国酿造, 2016, 38(8): 149–151. |
| [6] | 聂相珍, 申丽媛. 葡萄皮渣多酚提取及其对五种食源性致病菌的抑制作用[J]. 中国酿造, 2016, 35(9): 101–105. |
| [7] | 高兆允, 陈守臻, 史本康. 葡萄多酚对糖尿病大鼠膀胱功能的保护作用及其机制探讨[J]. 山东医药, 2016, 56(14): 4–6. |
| [8] | Deng Q, Penner MH, Zhao Y. Chemical composition of dietary fiber and polyphenols of five different varieties of wine grape pomace skins[J]. Food Res Int, 2011, 44(9): 2712–2720. |
| [9] | Both S, Chemat F, Strube J. Extraction of polyphenols from black tea-conventional and ultrasound assisted extraction[J]. Ultrason Sonochem, 2014, 21(3): 1030–1034. |
| [10] | 荀二娜, 张春利, 谢晓娜. 超声波法辅助提取松针多酚[J]. 吉林大学学报:理学版, 2012, 50(1): 147–152. |
| [11] | 贾荣, 倪海镜, 赵春芳, 等. 山葡萄籽提取物中总多酚的含量测定[J]. 吉林大学学报:医学版, 2009, 35(5): 877–879. |
| [12] | 焦淑萍, 董丽萍, 姜虹. 野生山葡萄多酚类物质提取实验研究[J]. 北华大学学报:自然科学版, 2003, 4(4): 311–313. |
| [13] | 刘建华, 程传格. 大泽山葡萄籽油中脂肪酸成分的GC/MS分析[J]. 化学分析计量, 2000, 9(1): 16–17. |
| [14] | 姜贵全, 牛佳牧, 方桂珍. 吉林地区山葡萄籽中活性成分及脂肪酸组成的比较研究[J]. 安徽农业科学, 2006, 34(23): 6096–6097. |
| [15] | 金飞, 陈乾, 焦平. 葡多酚对60Co-γ射线照射小鼠造血系统的辐射损伤修复作用[J]. 解放军药学学报, 2016, 32(4): 335–337. |
| [16] | 林樱姬, 赵萍, 王雅. 植物多酚的提取方法和生物活性研究进展[J]. 陕西农业科学, 2009(6): 105–107. |
| [17] | 朱美蓉, 房玉林. 葡萄多酚研究进展及其开发利用[J]. 中国酿造, 2015, 34(12): 1–4. |
| [18] | 汪成东, 张振文, 宋士任. 葡萄多酚物质提取方法的研究[J]. 西北植物学报, 2004, 24(11): 2131–2135. |
 2017, Vol. 43
2017, Vol. 43


