扩展功能
文章信息
- 高霞, 雷晓燕, 刘姝娆, 索艳红, 曹晓锋, 高明东
- GAO Xia, LEI Xiaoyan, LIU Shurao, SUO Yanhong, CAO Xiaofeng, GAO Mingdong
- 小鼠肾脏足细胞的原代培养和鉴定
- Primary culture and identification of mouse kidney cells
- 吉林大学学报(医学版), 2017, 43(01): 186-189
- Journal of Jilin University (Medicine Edition), 2017, 43(01): 186-189
- 10.13481/j.1671-587x.20170137
-
文章历史
- 收稿日期: 2016-05-31
2. 甘肃省中医药大学研究生处, 甘肃 兰州 730000;
3. 宁夏医科大学研究生学院, 宁夏 银川 750000
2. Department of Postgraduate, Gansu University of Traditional Chinese Medicine, Lanzhou 730000, China;
3. School of Postgraduate, Ningxia Medical University, Yinchuan 750001, China
研究[1-2]表明:足细胞损伤是导致大量蛋白尿发生的关键环节。有关足细胞的研究是肾脏病领域的热点内容,但目前足细胞的原代技术仍十分有限,已有的报道主要局限在大鼠足细胞的分离及培养方法,有关小鼠足细胞原代培养技术少见报道。C57/BL6J小鼠是建立基因敲除模型的主要模式动物[3],是实现基因敲除或基因敲入动物成模的关键动物品系。但是目前有关小鼠尤其是C57/BL6J小鼠足细胞原代培养的研究尚无文献报道。建立简便易行的C57/BL6J小鼠足细胞培养方法对于开展基因敲除小鼠足细胞的功能研究具有重要意义。本研究采用C57/ BL6J小鼠,分离培养其肾脏足细胞,以期建立小鼠肾脏足细胞分离及原代培养的最佳模式。
1 材料与方法 1.1 实验动物、试剂和主要仪器SPF级C57/BL6J小鼠,雄性,体质量30~40 g,复旦大学药理学动物实验室提供, 动物合格证号:2010002605829。ITS-X培养基(含转铁蛋白0.55 g·L-1、亚硒酸钠67 mg·L-1、胰岛素1 g·L-1)和DMEM/F培养基(美国Gibco公司)。倒置显微镜(日本Olympus公司),100、150和300目不锈钢筛网(国产)。
1.2 试剂制备①制备KI培养基的主要成分:DMEM/F12培养基, 含10 mmol·L-14-羟乙基哌嗪乙磺酸(HEPES)、ITS-X、105 U·L-1青霉素和100 g·L-1链霉素(双抗)。②制备3T3培养基的主要成分:DMEM培养基(高糖型), 含200 g·L-1胎牛血清、10mmol·L-1HEPES、2 mmol·L-1谷氨酰胺、2 mmol·L-1丙酮酸钠、105U·L-1青霉素和100 mg·L-1链霉素(双抗)。2种培养基制备好后,以KI培养基和3T3培养基1:1体积比混合, 即为KI-3T3培养基。
1.3 差异过筛法分离肾小球颈椎脱臼法处死小鼠, 在无菌条件下取出双肾, 置于预冷的PBS中。去除肾包膜, 剪碎肾皮质;用KI-3T3培液稀释剪碎后的肾皮质,过70 μm筛网,收集过筛细胞悬液。在40 μm筛网上一次过滤细胞悬液,收集筛网上的肾小球。于倒置显微镜下观察肾小球形态。
1.4 种植肾小球KI-3T3培养基重悬肾小球, 以适当密度种植在铺有鼠尾胶原的10 cm2塑料培养皿中,置于37℃、CO2恒温培养箱中孵育。
1.5 足细胞纯化与传代种植肾小球后静置3d,第4天开始首次换液, 以后每2 d换液1次。待足细胞基本长满培养皿,用0.25%Trypsin-EDTA消化传代培养足细胞。视生长情况3~5 d传代1次。
1.6 采用PCR法鉴定原代足细胞收集分离的原代(P0)足细胞、小鼠足细胞系(阳性对照组)和小鼠肝脏细胞(阴性对照组),抽提RNA,反转录,采用PCR法检测足细胞标志基因nepherin、podocin和p-cadherinmRNA表达情况,产物进行凝胶电泳。RT-PCR引物序列如下:nephrin-F,5′-GCTGGACGTGCATTATGCT-3′;nephrin-R,5′-CTCCTCGTCTTCCCCCAG-3′。Podocin-F,5′-C-ACTCTTCAGTCGCTGTCCA -3′;Podocin-R,5′-AGTTGATGCTCCCTTGTGCT-3′。P-cadherin-F,5′-TCTATACCGCACAGGACCCA-3′;P-cadherin-R,5′ -GGGAGGGTTCCACTGTCTG-3′;GAPDH-F,5′-TGGCCTTCCGTGTTCCTAC-3′;GAPDH-R,5′-GAGTTGCTGTTGAAGTCGCA-3′。
2 结果 2.1 C57/BL6J小鼠肾小球的分离和体外培养倒置显微镜下观察,可见从C57/BL6J小鼠肾皮质分离出来的肾小球形态大部分保持球形,通过血细胞计数板统计每只小鼠能够分离出的肾小球为(0.93±0.24)×104个,纯度>92%。分离的肾小球在第3天大部分处于贴壁状态,并且有足细胞开始从肾小球中爬出生长;第5天,爬出的足细胞数量明显增多,并在肾小球周围贴壁继续生长,刚爬出的足细胞不具备突起样结构,而呈纺锤或椭圆型,部分排列紧密;第7天,爬出贴壁的足细胞体积变大,并出现向多角及多突出样生长的趋势;第10~12天,原有分离的肾小球完全消失,培养皿中被爬出的足细胞取代。见图 1(插页四)。
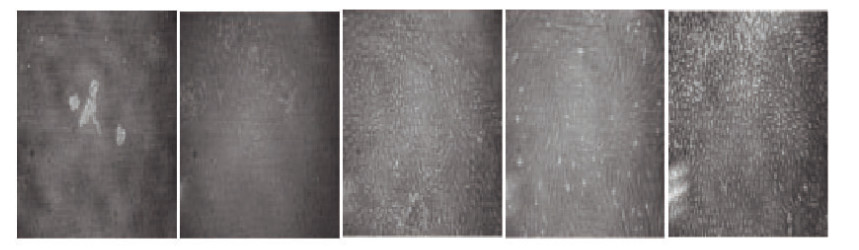
|
| A-E:Cuhure 0-7 d. 图 1 C57/BL6J小鼠肾小球的分离和体外培养(×200) Figure 1 Isolation and culture of glomcrularsin of C57/BL6J mice in vitro(×200) |
|
|
倒置相差显微镜下观察,足细胞在第1次传代后生长缓慢,但形态继续由上皮细胞向足细胞特有的多突起结构变化,细胞体积继续变大,足细胞间的突起互相连接。约在培养4~5d后细胞生长至80%左右,开始第2次传代。传至第2代的足细胞生长速度较第1代稍快,约3d可以继续传代。但细胞传至第4代时,开始形态变细长,并出现失黏附和死亡。
2.3 PCR法鉴定肾小球足细胞采用PCR法分析原代培养细胞是否具备足细胞生物学标志的特异表达。以永生化小鼠足细胞作为阳性对照,小鼠肝细胞系作为阴性对照。结果显示:原代足细胞与永生化小鼠足细胞系比较均有nephrin基因的表达,而阴性对照组小鼠肝脏细胞未检测到该基因表达;与阳性对照组比较,原代培养的足细胞podocin表达水平升高,但P-cadherin表达水平相对较低,阴性对照组无podocin和P-cadherin的表达。见图 2。

|
| Lane 1:Immortal podocytes; Lane 2:Primary culture podocytes; Lane 3: Liver cells. 图 2 PCR法检测小鼠肾脏足细胞中nephrin、podocin和P-cadherin表达电泳图 Figure 2 Electrophoregram of nephrin, podocin, and P-cadherin in podocytes of mice detected by PCR |
|
|
足细胞作为体内永生化的细胞,足细胞损伤是影响肾小球正常功能,加重慢性肾脏病(CKD)进展的关键环节。目前已有的研究[4]报道中,多采用Peter Mundel教授的永生化小鼠足细胞系,该细胞株在美国模式菌种收集中心(ATCC)细胞库中无商品化销售,不仅存在获取困难且具有不能稳定表达足细胞固有分子nephrin[5]、易形成纤维化和基因转染效率低等问题[6]。
原代细胞培养能够较好地保留细胞的体内状态,与转基因的永生化细胞相比有很多天然优势[7],但是分离培养是限制实验室开展此项工作的瓶颈。已有的报道[8-9]主要是关于SD大鼠足细胞的原代培养,有关小鼠足细胞原代培养的研究较少,特别是C57/BL6J小鼠是基因敲除的主要小鼠品系,有关该品系小鼠足细胞原代培养的方法国内尚无相关报道。
本研究借鉴大鼠足细胞原代培养基的配制方法进行C57/BL6J小鼠足细胞培养,结果显示:未添加甲状腺素、前列腺素和氢化可的松的培养基可以作为小鼠肾小球的体外培养基,并不影响肾小球的贴壁效率(本研究中贴壁率为60%~70%,与国外文献[10]相似)。肾小球的消化酶选择被认为会影响肾小球的贴壁,进而影响小球中细胞的黏附和生长。有学者采用免疫磁珠消化,或者胶原酶温和处理肾小球[11]。考虑到免疫磁珠制备复杂,而胶原酶受到不同厂家消化时间的影响较大,不易摸索出稳定的条件,故本次实验仍采用胰酶作为消化酶,结果显示:该方法对C57/BL6J小鼠肾小球及球内细胞的贴壁无明显影响,且操作更加简便,实验重复性好,便于推广。考虑到肾小球的种植密度会影响贴壁,故在使用鼠胶原铺板的同时,选用10cm培养皿作为培养容器,以肾小球铺满培养皿底部为原则,并在悬置的前3d避免换液,减少对贴壁的干扰。
对于贴壁后的肾小球在操作中必须注意尽量少搬动培养皿,动作平稳轻柔。为了获得纯度高的足细胞,对于爬出肾小球的细胞需要在倒置相差显微镜下仔细观察形态,把握恰当的传代时机。内皮细胞尽管最早从肾小球中爬出,但其生长条件必须有内皮细胞生长因子,故KI-3T3不能满足其需要,培养中可见内皮细胞很快就漂起。接着从肾小球中爬出的是足细胞,刚爬出的足细胞呈鹅卵石样,围绕在肾小球的周边,在培养至第10~12天时培养皿中绝大部分为爬出的足细胞,此时开始传代。系膜细胞最晚从肾小球中爬出,一般是在第7天以后开始,第30天长满培养皿,故本研究选择在足细胞长满培养皿而系膜细胞尚未明显爬出时进行传代,既保证了纯度又可获得较高数量的原代足细胞。已知永生化的小鼠足细胞株低表达nephrin,这与体内足细胞高表达该分子情况不符[3]。为进一步证明本次原代培养的足细胞不仅在形态上,更主要是在细胞功能上能够代表体内足细胞的功能状态,本研究采用多个足细胞固有分子对此次分离培养的足细胞进行了鉴定。本研究中PCR法检测结果显示:原代培养的足细胞能够较好地表达nephrin,维持体内足细胞的这一生物学特点。同时与nephrin有“cross-talk”的分子podocin在原代培养的足细胞中表达稳定,与体内足细胞的特点相符合,而永生化的足细胞podocin的表达水平很低,不利于开展该分子的体外研究。原代培养的足细胞P-cadherin的表达较低,这可能与消化酶影响足细胞的黏附功能有关。
综上所述,本研究建立了简便易行的小鼠足细胞原代培养方法,实验证实该方法分离的足细胞不仅在形态上且在分子表达上具有典型的足细胞固有特点。原代培养足细胞数量和纯度有限等问题尚需进一步研究。
| [1] | Zhang L, Wang F, Wang L, et al. Prevalence of chronic kidney disease in China:a cross-sectional survey[J]. Lancet, 2012, 379(9818): 815–822. DOI:10.1016/S0140-6736(12)60033-6 |
| [2] | Asanuma K, Mundel P. The role of podocytes in glomerular pathobiology[J]. Clin Exp Nephrol, 2003, 7(4): 255–259. DOI:10.1007/s10157-003-0259-6 |
| [3] | 范青锋, 丁洁. 肾小球足细胞系的研究进展[J]. 实用儿科临床杂志, 2005, 20(1): 71–72. |
| [4] | Shankland SJ, Pippin JW, Reiser J, et al. Podocytes in culture:past, present, and future[J]. Kidney Int, 2007, 72(1): 26–36. DOI:10.1038/sj.ki.5002291 |
| [5] | Chittiprol S, Chen P, Petrovic-Djergovic D, et al. Marker expression, behaviors, and responses vary in different lines of conditionally immortalized cultured podocytes[J]. Am J Physiol Renal Physiol, 2011, 301(3): F660–F671. DOI:10.1152/ajprenal.00234.2011 |
| [6] | Greka A, Mundel P. Cell biology and pathology of podocytes[J]. Annu Rev Physiol, 2012, 74: 299–323. DOI:10.1146/annurev-physiol-020911-153238 |
| [7] | Krtil J, Plátenik J, Kazderová M, et al. Culture methods of glomerular podocytes[J]. Kidney Blood Press Res, 2007, 30(3): 162–174. DOI:10.1159/000102520 |
| [8] | Katsuya K, Yaoita E, Yoshida Y, et al. An improved method for primary culture of rat podocytes[J]. Kidney Int, 2006, 69(11): 2101–2106. DOI:10.1038/sj.ki.5000398 |
| [9] | Kabgañi N, Grigoleit T, Schulte K, et al. Primary cultures of glomerular parietal epithelial cells or podocytes with proven origin[J]. PLoS One, 2012, 7(4): e34907. DOI:10.1371/journal.pone.0034907 |
| [10] | Appel D, Kershaw DB, Smeets B, et al. Recruitment of podocytes from glomerular parietal epithelial cells[J]. J Am Soc Nephrol, 2009, 20(2): 333–343. DOI:10.1681/ASN.2008070795 |
| [11] | Katsuya K, Yaoita E, Yoshida Y, et al. An improved method for primary culture of rat podocytes[J]. Kidney Int, 2006, 69(11): 2101–2106. DOI:10.1038/sj.ki.5000398 |
 2017, Vol. 43
2017, Vol. 43


