扩展功能
文章信息
- 张连芝, 洪敏, 程熠
- ZHANG Lianzhi, HONG Min, CHENG Yi
- NV蛋白酶冻干工艺的相关技术参数
- Relative parameters of lyophilization of NV protease
- 吉林大学学报(医学版), 2017, 43(01): 181-185
- Journal of Jilin University (Medicine Edition), 2017, 43(01): 181-185
- 10.13481/j.1671-587x.20170136
-
文章历史
- 收稿日期: 2016-08-10
2. 吉林大学基础医学院生物化学与分子生物学系, 吉林 长春 130021;
3. 吉林大学第一医院转化医学研究院, 吉林 长春 130061
2. Department of Biochemistry and Molecular Biology, Jilin University, Changchun 130021, China;
3. Institute of Translational Medicine, First Hospital, Jilin University, Changchun 130061, China
我国的沙蚕种类约80多种,主要的养殖品种有日本刺沙蚕(Neathes japonica)、多齿围沙蚕(Perinereis nuntia)和双齿围沙蚕(Perinereis aibuhitensis)等,北方(辽宁、山东和河北)以日本刺沙蚕居多,南方(江苏、福建和浙江)以双齿围沙蚕为主。NV蛋白酶(曾用名:溶栓素)是一种本课题组首先分离纯化的丝氨酸蛋白水解酶[1],该酶已在Swiss prot蛋白库中著录(著录号为P83433),申请了我国专利(申请号为02144828.0)并获得专利公开(公开号为1500873)。本文作者在完成NV蛋白酶纯化工艺和质量标准的基础上[2-4],进一步获得NV蛋白酶药理学研究数据[5-6]。本研究旨在为NV蛋白酶的冻干工艺确定相关技术参数。
1 材料与方法 1.1 主要试剂Sephadex G-15购自美国Pharmacia公司,PierceTM BCA Protein Assay Kit购自美国Thermo Fisher Scientific公司,偶氮酪蛋白、d-10樟脑磺酸、六次甲基四胺和Tween 80均购自美国Sigma-Aldrich公司,其他药品购自北京化学试剂公司。
1.2 NV蛋白酶的活性测定在0.01mol·L-1 Na2HPO4-NaH2PO4(pH 7.3)缓冲条件下制备NV蛋白酶溶液,分别检测4℃~45℃时NV蛋白酶的活性。分别使用0.01 mol·L-1的不同pH缓冲液(表 1),预洗脱Sephadex G-15色谱柱,冻干制备的NV蛋白酶上样洗脱,分别制备在0.01 mol·L-1上述缓冲体系下的NV蛋白酶溶液并检测其活性。
| pH | Buffer |
| 1.0 | KCl-HCl |
| 2.0 | Citric acid-Na2HPO4 |
| 3.0 | Citric acid-Na2HPO4 |
| 4.0 | Citric acid-Na2HPO4 |
| 5.0 | Citric acid-Na2HPO4 |
| 6.0 | Citric acid-Na2HPO4 |
| 7.0 | Citric acid-Na2HPO4 |
| 8.0 | Citric acid-Na2HPO4 |
| 9.0 | Glycine-NaOH |
| 10.0 | Glycine-NaOH |
NV蛋白酶活性检测采用偶氮酪蛋白方法:经卡马斯亮蓝G-250染料结合法定量后,配成浓度为0.2 g·L-1的NV蛋白酶溶液。50 μL NV蛋白酶溶液与500 μL 0.5%偶氮酪蛋白溶液混合,在37℃条件下保温10 min。加入10%三氯乙酸溶液1 mL,以Parafilm薄膜封住管口,于振荡器上振荡。10 000 r·min-1离心2 min,将上清液移入比色皿,以上述相应pH值的缓冲液为空白对照,在440 nm处测定吸光度(A)值。活性检测分别重复3次。
1.3 NV蛋白酶的二级结构检测采用62ADS型圆二色谱仪(美国AVIV公司)表征NV蛋白酶的二级结构。采用1 g·L-1 d-10樟脑磺酸水溶液,以1 mm的吸收池校正仪器。试剂用水为经石英双蒸馏水器蒸馏的新双蒸馏水,所有试剂皆为现用现配,并用高纯度氮气饱和。NV蛋白酶远紫外圆二色谱测定选用光程为1 mm的吸收池,在200~250 nm间扫描。测试前充分恒温(2h),每个测试结果均为3次单独测定的平均结果。蛋白质二级结构的计算采用奇异值分解最小二乘法计算,结构数据微分分析采用Origin 6.0软件,双变量相关性分析采用SPSS 10.0数据分析软件。
1.4 NV蛋白酶的冻干过程0.01 mol·L-1 Na2HPO4-NaH2PO4(pH 7.3)缓冲条件下制备的NV蛋白酶溶液装入5 mL西林瓶,将西林瓶置于冻干托盘,放置到预先灭菌处理的VirTis Advantage冻干机中。启动真空泵,将冷冻仓真空度降为200 Torr。启动搁板制冷,-40℃预冻4 h。将搁板温度升至-10℃,第一阶段干燥时间13.5h。将搁板温度升至0℃,第二阶段干燥时间8h,至冷冻仓真空度为250 Torr,终止冻干。启动压盖程序,将西林瓶封严。
1.5 NV蛋白酶冻干品复溶后浊度测定吸取硫酸肼溶液5mL与六次甲基四胺溶液5mL于100 mL容量瓶中混匀。25℃±3℃下静置反应24h。冷后用水稀释至标线,混匀。此溶液浊度(单位:NTU)为400NTU。吸取浊度标准液0、0.50、1.25、2.50、5.00、10.00和12.50 mL,置于比色管中,加水至标线。摇匀后,即得浊度为0.4、10.0、20.0、40.0及80.0NTU的标准系列。于680 nm波长测定浊度标准液吸光度(A)值,计算标准曲线回归方程。吸取NV蛋白酶冻干品生理盐水复溶液于比色管中测定A值,由标准曲线回归方程计算样品浊度。
1.6 不同浓度Tween 80条件下NV蛋白酶冻干品的复溶对NV蛋白酶样品分别添加0.015%、0.010%和0.015%的Tween 80,采用2.0、2.5和3.0℃·min-1冷冻速率冻干,其余冻干技术参数见1.4。
2 结果 2.1 不同温度下NV蛋白酶二级结构和活性在4℃~45℃范围内, NV蛋白酶α-螺旋结构比率和活性随温度升高呈下降趋势,β-折叠结构比率变化不明显。NV蛋白酶活性与温度呈正相关关系(r=0.753, P < 0.01)。α-螺旋结构比率与温度和活性均呈负相关关系(r=-0.968, P < 0.01)。NV蛋白酶β-折叠结构比率与温度和活性均无相关关系(P>0.05)(图 1)。经奇异值分解最小二乘法计算和结构数据微分分析,α-螺旋结构是维持NV蛋白酶在不同温度条件下的主要结构构象,2种结构变化的相变点为36.8℃。

|
| 图 1 不同温度下NV蛋白酶二级结构和活性 Figure 1 Secondary structures and activities of NV protease at different temperatures |
|
|
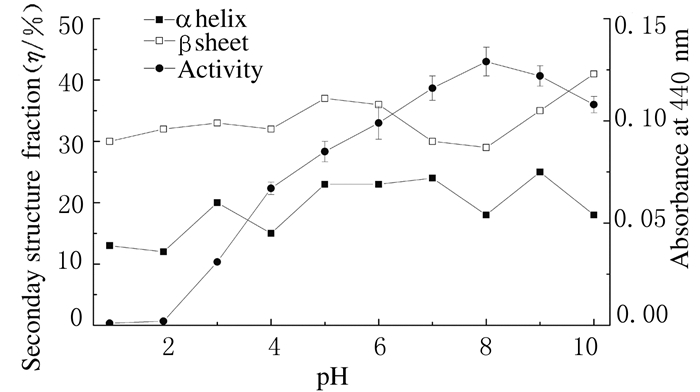
在pH值1~10范围内,NV蛋白酶活性与pH值呈正相关关系(r=0.924, P < 0.01)。NV蛋白酶α-螺旋结构比率和β-折叠结构比率呈波动变化;α-螺旋结构比率与pH值无相关性(P>0.05),而与活性呈正相关关系(r=0.721, P < 0.01);NV蛋白酶β-折叠结构比率与pH值和活性均无相关性(P>0.05)。见图 2。
|
| 图 2 不同pH值时NV蛋白酶二级结构与活性 Figure 2 Secondary structures and activities of NV protease at different pH values |
|
|
在预冻阶段内温度下降曲线与隔板温度下降曲线基本保持一致,只是其斜率略低。在第一干燥阶段,样品温度(Curve 1)随隔板升温而升温,隔板温度(Curve 2)达到预定温度后基本维持不变,而样品温度波动较大,10.5h后样品温度波动幅度逐渐缩小。在第二干燥阶段,样品温度随隔板上升斜率较第一干燥阶段有所提高,隔板温度达到预定温度后基本维持不变,而样品温度有小幅波动,22h后样品温度逐渐接近隔板温度。在第一和第二干燥阶段,冷凝器温度(Curve 3)基本维持在-45℃~-40℃,冷凝器在第二干燥阶段温度波动比第一干燥阶段明显减少。在预冻阶段内,冻干仓压力(Curve 4)下降迅速。在第一干燥阶段的初始阶段(4.0~7.5h),冻干仓压力随隔板升温而提高;在中间阶段(7.5~12.0 h),冻干仓压力波动较大,与样品温度波动有一定的一致性;在结尾阶段(12.0~13.5h),冻干仓压力波动渐趋平静。在第二干燥阶段,冻干仓压力在小幅上升后,逐渐下降,与样品温度变化趋势相反。见图 3。

|
| Curve 1:Sample temperature; Curve 2:Heater temperature; Curve 3:Cooler temperature; Curve 4:Lyophilization chamber pressure. 图 3 NV蛋白酶的冻干曲线 Figure 3 Lyophilization curves of NV protease |
|
|
NV蛋白酶冻干品复溶后浊度随平均冷冻速率的上升而明显上升,NV蛋白酶冻干品复溶后活性随平均冷冻速率的上升而缓慢下降。见图 4。

|
| 图 4 不同平均冷冻速率时NV蛋白酶浊度和活性 Figure 4 Turbidities and activities of NV protease with different average freezing rates |
|
|
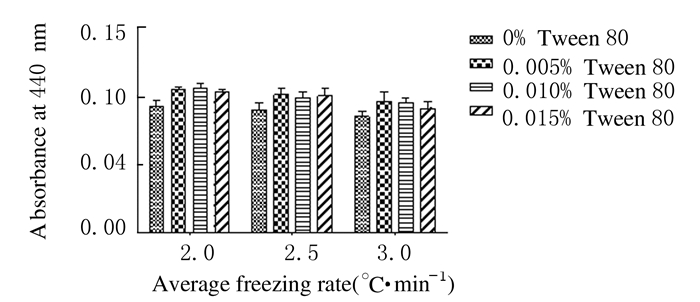
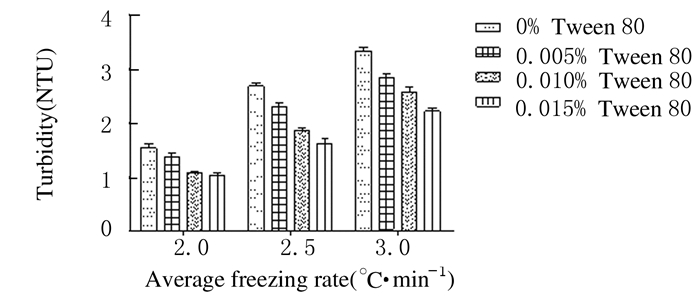
添加0.005% Tween 80后各冷冻速率组(2.0、2.5和3.0℃·min-1) NV蛋白酶活性明显增加(图 5)。添加0.015% Tween 80后各冷冻速率组(2.0、2.5和3.0℃·min-1) NV蛋白酶浊度明显降低。见图 6。
|
| 图 5 添加不同浓度Tween 80后NV蛋白酶的活性 Figure 5 Activities of NV protease after adding different concentrations of Tween 80 |
|
|
|
| 图 6 添加不同浓度Tween 80后NV蛋白酶的浊度 Figure 6 Turbidities of NV protease after adding different concentrations of Tween 80 |
|
|
干燥过程是药品生产环节中成本最高的,而蛋白药物的冻干又是所有药品干燥过程中最为昂贵的。蛋白药物的冻干过程伴随着蛋白变性,复溶后蛋白药物能否保证充分的溶解度和活性是冻干工艺研究的关键。
蛋白质二级结构是确定蛋白药物的冻干工艺的重要数据,冻干过程中势必出现由温度的降低导致的蛋白质二级结构变化[7-8]。蛋白的缓冲溶液组成成分的温度-溶解度曲线差别较大,冻干过程中同样产生由pH的改变导致的蛋白质二级结构变化[9]。由于NV蛋白酶纯化和保存缓冲体系是pH值为7.3的Na2HPO4-NaH2PO4,Na2HPO4的溶解度随温度下降而降低,NV蛋白酶在冻干的初始阶段势必会经过温度和pH值降低的双重过程。蛋白结构是维持其活性的关键,本实验根据现有的仪器条件首先研究了温度、pH值对NV蛋白酶二级结构和活性的影响。本研究结果显示:α-螺旋结构是维持NV蛋白酶在不同温度条件下的主要结构构象,在低温条件下所维持的结构比率高于其在高温条件下所维持的结构比率,而且α-螺旋结构比率变化与pH值变化不相关。因此,NV蛋白酶具有一定的抵抗冻干过程中温度和pH值降低的能力。
平均冷冻速率是降低冻干药品生产时间成本的关键[10]。本研究结果显示:NV蛋白酶冻干品复溶后浊度随平均冷冻速率的上升而明显上升,表明NV蛋白酶在冻干过程中存在蛋白表面变性。蛋白表面变性是蛋白冷冻变性的重要组成;与急速冷冻相比,慢速冷冻所形成的冰-液界面相对面积较小,因此慢速冷冻的蛋白产品比急速冷冻产品的浊度明显降低[11-12]。此外,本文作者还发现:NV蛋白酶冻干品复溶后活性随平均冷冻速率的上升而缓步下降,该结果与Sarciaux等[12]和Strambini等[13]研究结果一致。Strambini等[13]研究发现:冷冻过程伴随蛋白质天然折叠的解开和二级、三级结构的破坏,但这一过程是部分可逆的。本文作者研究Tween 80作为冻干变性防护剂的可能性发现:Tween 80能够明显提高NV蛋白酶复溶活性和溶解度,0.01% Tween 80可以作为平衡NV蛋白酶复溶活性和溶解度的权宜浓度;平均冷冻速率2.0℃·min-1可以作为降低冻干药品生产时间成本的权宜冷冻速率参数。本研究结果可以与Chang等[11]研究结果相互印证。
Tween 80是非离子型表面活性剂。研究[14]发现:离子型表面活性剂容易使蛋白变性,而非离子型表面活性剂通常不导致蛋白变性。Tween 20和Tween 80是蛋白制剂中广为使用的表面活性稳定剂,过氧化物是Tween 20和Tween 80的主要污染物[15]。Knepp等[16]研究发现:Tween 20和Tween 80的过氧化物可以导致蛋白的氧化降解。因此,目前Tween 80作为NV蛋白酶冻干变性防护剂的研究尚缺少Tween 80的过氧化物含量和NV蛋白酶降解的检测。此外,由于Tween 80对蛋白的圆二色谱干扰较大,未能获得添加Tween 80的NV蛋白酶圆二色谱数据。
综上所述,NV蛋白酶具有一定的抵抗冻干过程中温度和pH降低的能力,NV蛋白酶复溶活性和溶解度受平均冷冻速率的影响。0.01% Tween 80和2.0℃·min-1平均冷冻速率是NV蛋白酶生产性冻干的有效技术选择。
| [1] | 程熠, 史方亮, 王之光, 等. 溶栓素的纯化研究[J]. 白求恩医科大学学报, 2001, 27(1): 9–11. |
| [2] | 程熠, 洪敏, 李奇, 等. 阴、阳离子交换示差组合色谱法的设计及在纤溶酶纯化中的应用[J]. 吉林大学学报:医学版, 2005, 31(5): 699–701. |
| [3] | 程熠, 洪敏, 张云龙. 溶栓素产品纯度的检测[J]. 吉林大学学报:医学版, 2004, 30(5): 816–818. |
| [4] | 程熠, 洪敏, 张云龙. 溶栓素定量方法的筛选系统[J]. 吉林大学学报:医学版, 2004, 30(6): 981–983. |
| [5] | 李奇, 洪敏, 付海英. 溶栓素抗凝血和抗血栓形成作用的实验研究[J]. 吉林大学学报:医学版, 2004, 30(3): 401–404. |
| [6] | 李奇, 迟秀梅, 石立红, 等. N-V蛋白酶体内外纤维蛋白溶解活性的实验研究[J]. 中国药理学通报, 2006, 22(8): 976–979. |
| [7] | Peters BH, Staels L, Rantanen J, et al. Effects of cooling rate in microscale and pilot scale freeze-drying-variations in excipient polymorphs and protein secondary structure[J]. Eur J Pharm Sci, 2016, 95: 72–81. DOI:10.1016/j.ejps.2016.05.020 |
| [8] | Ulrichs T, Drotleff AM, Ternes W. Determination of heat-induced changes in the protein secondary structure of reconstituted livetins (water-soluble proteins from hen's egg yolk) by FTIR[J]. Food Chem, 2015, 172: 909–920. DOI:10.1016/j.foodchem.2014.09.128 |
| [9] | Park J, Nagapudi K, Vergara C, et al. Effect of pH and excipients on structure, dynamics, and long-term stability of a model IgG1 monoclonal antibody upon freeze-drying[J]. Pharm Res, 2013, 30(4): 968–984. DOI:10.1007/s11095-012-0933-z |
| [10] | Depaz RA, Pansare S, Patel SM. Freeze-drying above the glass transition temperature in amorphous protein formulations while maintaining product quality and improving process efficiency[J]. J Pharm Sci, 2016, 105(1): 40–49. DOI:10.1002/jps.24705 |
| [11] | Chang BS, Kendrick BS, Carpenter JF. Surface-induced denaturation of proteins during freezing and its inhibition by surfactants[J]. J Pharm Sci, 1996, 85(12): 1325–1330. DOI:10.1021/js960080y |
| [12] | Sarciaux JM, Hageman MJ. Effects of bovine somatotropin (rbSt) concentration at different moisture levels on the physical stability of sucrose in freeze-dried rbSt/sucrose mixtures[J]. J Pharm Sci, 1997, 86(3): 365–371. DOI:10.1021/js960217k |
| [13] | Strambini GB, Gabellieri E. Proteins in frozen solutions:evidence of ice-induced partial unfolding[J]. Biophys J, 1996, 70(2): 971–976. DOI:10.1016/S0006-3495(96)79640-6 |
| [14] | Jiang S, Nail SL. Effect of process conditions on recovery of protein activity after freezing and freeze-drying[J]. Eur J Pharm Biopharm, 1998, 45(3): 249–257. DOI:10.1016/S0939-6411(98)00007-1 |
| [15] | Cleland JL, Powell MF, Shire SJ. The development of stable protein formulations:a close look at protein aggregation, deamidation, and oxidation[J]. Crit Rev Ther Drug Carrier Syst, 1993, 10(4): 307–377. |
| [16] | Knepp VM, Whatley JL, Muchnik A, et al. Identification of antioxidants for prevention of peroxide-mediated oxidation of recombinant human ciliary neurotrophic factor and recombinant human nerve growth factor[J]. PDA J Pharm Sci Technol, 1996, 50(3): 163–171. |
 2017, Vol. 43
2017, Vol. 43


