扩展功能
文章信息
- 刘洋, 怀施涛, 付文博, 宋亚芹, 卢沐, 庞丽娟, 魏育涛
- LIU Yang, HUAI Shitao, FU Wenbo, SONG Yaqin, LU Mu, PANG Lijuan, WEI Yutao
- 冠心病伴心外膜脂肪增厚大鼠模型的制备
- Establishment of rat models of coronary atherosclerotic heart disease complicated with epicardial adipose tissue thickening
- 吉林大学学报(医学版), 2017, 43(01): 176-180
- Journal of Jilin University (Medicine Edition), 2017, 43(01): 176-180
- 10.13481/j.1671-587x.20170135
-
文章历史
- 收稿日期: 2016-06-18
2. 新疆维吾尔族自治区人民医院心内科, 新疆 乌鲁木齐 830000;
3. 石河子大学医学院病理教研室, 新疆 石河子 832000;
4. 石河子大学医学院第一附属医院心胸外二科, 新疆 石河子 832008
2. Department of People's Hospital, Xinjiang Uygur Autonomous Region, Urumqi 830000, China;
3. Department of Pathology, School of Medical Sciences, Shihezi University, Shihezi 832000, China;
4. Department of Cardiothoracic Surgery, First Affiliated Hospital, School of Medical Sciences, Shihezi University, Shihezi 832008, China
冠状动脉粥样硬化性心脏病(coronary atherosclerotic heart disease, CAD)是世界上严重危害人类生命健康的心血管疾病[1]。心外膜脂肪(epicardial adipose tissue,EAT)沉积在心肌表面,主要沿冠状动脉走向分布,由冠状动脉分支供血,与心肌之间无筋膜阻隔,具有活跃的自分泌及旁分泌功能,通过旁分泌作用于邻近的冠状动脉或心脏组织,还能表达与动脉粥样硬化形成有关的多种生物活性因子,从而影响CAD的发生与发展[2-3]。最近研究[4]显示:EAT厚度与CAD具有高度的相关性。但是,目前关于EAT与CAD相关性的研究绝大多数局限于临床患者的研究,难以排除其他疾病因素的干扰。本研究通过建立稳定可靠的CAD伴EAT增厚SD大鼠模型,有效控制其他疾病变量,以期提高EAT增厚在CAD发生发展中作用机制研究的可信度。
1 材料与方法 1.1 实验动物、主要试剂和器材SPF级雄性SD大鼠50只,体质量(200±10) g,购自新疆医科大学实验动物中心,动物合格证号:SCXK (新) 2013-0001。正常饲料喂养1周后,随机分为对照组(15只)和模型组(35只),饲养于新疆医科大学实验动物中心。维生素D3注射液(上海通用药业股份有限公司,国药准字H31021404),高脂饲料及基本饲料(江苏协同医药生物工程有限责任公司)。电子天平(LT1000B,江苏常熟市大量仪器有限责任公司),全自动生化分析仪(Modual DPP,德国罗氏公司),多功能光学显微镜及图像采集系统(BX40,日本Olympus公司),超高分辨率小动物超声实时分子影像系统(Vevo 2100,加拿大VisualSonics公司)。
1.2 大鼠食饵性CAD伴EAT增厚模型建立对照组和模型组大鼠分别喂饲正常基本饲料和高脂饲料,模型组大鼠于0、30、60和90 d腹腔注射维生素D3 (20万U·kg-1),对照组大鼠同步给予等量生理盐水。继续饲养至210d。高脂饲料配方:3%胆固醇、0.5%胆酸钠、0.2%丙硫氧嘧啶、10%精制糖、10%猪油和76.3%基本饲料。
1.3 记录大鼠一般情况和体质量分别于各组大鼠喂养第0、30、60、90、120、150、180和210天观察其饮食量、皮毛情况、精神状态、行为活动和爪甲有无破损等,测量其体质量(g)。
1.4 实验取材①血清:造模结束后,予大鼠10%水合氯醛腹腔注射麻醉,剂量为3 mL·kg-1。眼内眦静脉丛取血3~4 mL,以2000 r·min -1离心15 min后取血清1 mL,-80℃冷冻保存。若血量无法取够,则用镊子摘除大鼠眼球,继续取血,并依上法离心、保存。②心脏组织:大鼠依上法麻醉取血后,将心脏取出并置于4℃预冷的保存液中,轻轻挤压心脏排出残留血液后,10%甲醛固定心肌组织(含冠状动脉)。
1.5 大鼠血脂及动脉粥样硬化指数(AI)[5]测定取各组大鼠制备的血清1 mL,采用全自动生化分析仪测定血清总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、高密度脂蛋白胆固醇(high density lipoprotein,HDL-c)和低密度脂蛋白胆固醇(low density lipoprotein,LDL-c)水平。计算AI,AI=(TC-HDL-c) /HDL-c。
1.6 大鼠EAT厚度的测定[6]造模结束前2周,采用超高分辨率小动物超声实时分子影像系统(Vevo2100)测量大鼠EAT厚度。大鼠取左侧卧位,用超高频率的电子线阵探头在胸骨旁左心长轴观检查,以主动脉瓣环为定位标志,显示右室游离壁前方EAT,在右心室游离壁前方近房室沟最厚处、垂直于主动脉瓣环测量EAT,超声心动图采用浅表模式,心外膜脂肪在超声图上表现为心肌外侧和心包脏层之间的相对低回声区,在舒张末期停帧、冻结图像,记录3个心动周期,取平均值。
1.7 大鼠血管狭窄程度的计算采用面积法计算血管狭窄程度:首先在正常管腔和最狭窄处分别取一横截面,然后测量正常管腔直径(a)和最狭窄处的管腔直径(b),其狭窄程度=(a2-b2)/a2。
1.8 大鼠心肌组织病理形态检查将固定好的标本常规脱水,石蜡包埋,制成4μm厚的横断切片,将切片固定于载玻片上,HE染色,光镜下观察大鼠心肌组织病理形态表现。
1.9 统计学分析采用GraphPad Prism 5及SPSS 19.0统计学软件进行制图及统计学处理。大鼠体质量和血清TC、TG、LDL-c、HDL-c水平及AI值、EAT厚度均以x±s表示,组间两两比较采用独立样本t检验。以P < 0.05表示差异有统计学意义。
2 结果 2.1 大鼠一般状态观察和体质量造模120~210 d时,对照组大鼠进食良好,皮毛光滑,活泼好动; 与对照组比较,模型组大鼠明显瘦弱,皮毛光泽黯淡,活动减少,精神萎靡,少数出现鼻角流血,极个别甚至出现偏瘫现象。大鼠喂饲90d之前,对照组和模型组大鼠体质量均有所增加,增加速度相近或模型组略高,组间比较差异无统计学意义(P>0.05);90~180 d,模型组大鼠较对照组体质量增加速度减慢;180~210 d,模型组大鼠体质量逐渐降低,对照组大鼠体质量增速减慢。见图 1。
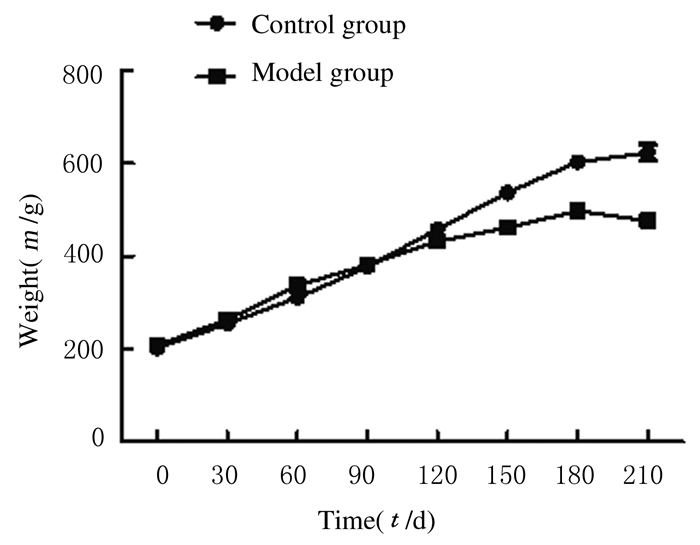
|
| 图 1 不同时间点2组大鼠体质量 Figure 1 Body weights of rats in two groups at different time points |
|
|
与对照组比较,模型组大鼠血清TC、TG和LDL-c水平明显升高(P < 0.05或P < 0.01),HDL-c水平明显降低(P < 0.05)。见表 1。与对照组(1.28±0.31)比较,模型组大鼠AI值(15.74±2.45)明显升高(P < 0.01)。
| [x±s, cB /(mmol·L-1)] | |||||
| Group | n | TC | TG | LDL-c | HDL-c |
| Control | 15 | 2.66±0.52 | 0.87±0.11 | 2.24±0.37 | 1.94±0.26 |
| Model | 35 | 5.83±1.27* | 2.42±0.49** | 4.56±1.59* | 0.29±0.08* |
| *P < 0.05, **P < 0.01 compared with control group. | |||||
造模210d时,与对照组(0.234mm±0.011 mm)比较,模型组大鼠EAT厚度(0.700 mm±0.029 mm)明显增加(P < 0.05)。
2.4 2组大鼠冠状动脉和心肌组织病理形态表现①冠状动脉:模型组大鼠冠状动脉出现内皮损伤并有大量典型粥样斑块形成,甚至出现钙化;大量脂肪细胞堆积于内膜,使内膜增厚;内膜遭破坏,内皮细胞缺失,内弹力板断裂;中膜平滑肌细胞排列紊乱并且增多,中膜增厚;冠脉狭窄面积占总截面85%以上(据面积法计算出狭窄程度约为85.21%)。对照组大鼠冠状动脉内膜、中膜未见增厚,血管壁完整,未见血管狭窄及其他异常。见图 2(插页四)。②心肌组织:模型组大鼠心肌间小血管出现内皮损伤并有典型粥样斑块形成;内膜下可见大量泡沫细胞,内膜明显增厚,内皮细胞缺失;血管周围可见脂肪细胞,并有钙盐沉积;血管狭窄85%以上(据面积法计算出狭窄程度约为88.89%)。对照组大鼠心肌间小血管未发现粥样斑块,内膜完整且未见增厚和血管狭窄,心肌细胞排列整齐、规则,未见血管周围异常。见图 3(插页四)。

|
| A:Control groups B: Model group. 图 2 大鼠冠状动脉病理形态及现(HE.×400) Figure 2 Pathomorphology of coronary arteries of rats (HE, ×400) |
|
|
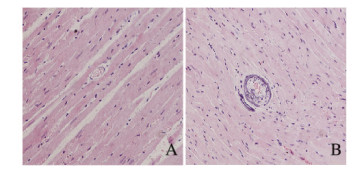
|
| A:Control group; B: Model group. 图 3 大鼠心肌组织病理形态表现(HE.×200) Figure 3 Pathomorphology of myocardium tissue of rats (HE, ×200) |
|
|
在前期建立CAD模型大鼠实验过程中解剖发现:模型组大鼠心包膜EAT明显厚于对照组,推测建立的大鼠CAD模型伴有EAT增厚。经不断改善实验方法,现模型建立稳定。本研究结果显示:模型组大鼠EAT厚度较对照组增厚,且差异有统计学意义,证实了前期研究的推测。
食饵法建立模型符合人类饮食特点,且大鼠属于杂食性动物,比草食性动物或谷食性动物更接近人类饮食习惯;机械损伤法建立模型快速并且粥样硬化的部位明确,但对于冠脉粥样硬化的建模致死率较高;基因敲除法建立的模型可系统性研究某个基因与CAD的关系,但费用高昂且不是本研究的目的。因此本文作者选择食饵法,采用高脂饲料联合维生素D3建立大鼠CAD伴EAT增厚模型。
胆固醇可引起高脂血症,损伤动脉内皮,导致血液单核细胞吸附,并刺激平滑肌细胞增殖,从而促进泡沫细胞形成,进而堆积成粥样斑块[7-8]。胆酸钠可刺激肝细胞分泌胆汁,促进脂肪乳化为微粒,从而促进胆固醇的吸收。研究[9]表明:丙硫氧嘧啶对升高血胆固醇水平起到关键作用。本实验中0~59d模型组大鼠体质量增幅明显,60~179 d增幅平缓,180~210 d体质量反而下降。药红梅等[9]在建立CAD大鼠模型过程中发现:加有丙硫氧嘧啶的2组大鼠体质量在前2周处于增长趋势,而之后就出现增长缓慢,甚至是体质量减轻,并一直维持到实验结束。本实验中大鼠体质量结果与其比较趋势上基本一致,提示这种体质量增长逐渐受限的现象可能与丙硫氧嘧啶使用有关。
维生素D可导致血钙升高,破坏动脉管壁内皮,有利于血浆脂质侵入并损伤血管壁,形成动脉粥样硬化[10]。维生素D还可促使钙盐在动脉中膜沉积,使平滑肌细胞变性或钙化[11]。本文作者在预实验中,按照参考文献[12]中的方法对大鼠使用70万U·kg-1维生素D3,但造成大鼠于1~3周时间段内死亡,死亡率达20%。后查阅文献[13]推测可能系维生素D3中毒引起。因此为了实验顺利进行,改进维生素D3用量为20万U·kg-1,从第0天开始腹腔注射,每月1次,共4次,结果表明:维生素D3用量的改进既保证了足够的维生素D3用量,又使得单次用量不足以造成大鼠死亡。
本研究中生化结果显示:与对照组比较,模型组大鼠血清TC、TG、LDL-c水平和AI值明显升高,而HDL-c水平降低。本研究中病理结果显示:模型组大鼠冠状动脉有大量典型粥样斑块形成,甚至出现钙化,心肌间小血管出现内皮损伤并有典型粥样斑块形成,血管周围伴有脂质沉积以及钙盐沉积;而对照组大鼠冠状动脉未出现粥样斑块,且未发现肌间小血管有粥样硬化改变及心肌组织异常;EAT厚度测量结果显示:模型组大鼠EAT厚度明显大于对照组且差异有统计学意义,这种表现与有关文献[14]中关于CAD患者EAT增厚的报道相符。所以本实验CAD大鼠伴EAT增厚模型建立是成功的。与其他CAD大鼠建模方法不同的是:本方法造模时间长,长达7个月之久,符合CAD患者的老龄化特征。本实验180 d时,解剖大鼠时已经发现模型组大鼠EAT较厚,而150 d时未发现模型组大鼠EAT增厚,所以结合模型组大鼠体质量变化及一般状况观察结果,建议选择180~210 d的模型大鼠用于EAT对CAD发生发展影响机制的研究。
本课题组前期研究[15]发现:CAD与非CAD患者比较,EAT厚度增加,EAT中脂联素水平降低,IL-6、TNF-α水平升高。Bachar等[16]研究发现:CAD患者EAT厚度大于非CAD患者,且EAT对症状不典型的CAD患者发生心血管事件具有预测价值。有研究[17-18]显示:手术切除EAT后可减缓CAD发生,说明EAT厚度是CAD的一项独立危险因素。因此EAT具有非常重要的基础研究价值,并且很可能是CAD诊断及治疗的潜在靶点[19]。
本实验采用高剂量维生素D3联合高脂饲料喂养SD大鼠210d后,成功建立了CAD伴EAT增厚SD大鼠模型,该模型可用于EAT在CAD中病理生理及分子生物学等方面作用的研究。通过对EAT的研究,可以逐步发掘EAT通过哪些途径或因子影响CAD的发生和发展,从而为临床上诊断和治疗CAD提供新思路。
| [1] | Keil JE, Sutherland SE, Knapp RG, et al. Mortality rates and risk factors for coronary disease in black as compared with white men and women[J]. N Engl J Med, 1993, 329(2): 73–78. DOI:10.1056/NEJM199307083290201 |
| [2] | Iacobellis G, Pistilli D, Gucciardo M, et al. Adiponectin expression in human epicardial adipose tissue in vivo is lower in patients with coronary artery disease[J]. Cytokine, 2005, 29(6): 251–255. |
| [3] | Dey D, Nakazato R, Li D, et al. Epieardial and thoracic fat-Noninvasive measurement and clinical implications[J]. Cardiovasc Diagn Ther, 2012, 2(2): 85–93. |
| [4] | Ahn SG, Lim HS, Joe DY, et al. Relationship of epieardial adipose tissue by echocardiography to coronary artery disease[J]. Heart, 2008, 94(3): e7. DOI:10.1136/hrt.2007.118471 |
| [5] | Renuka PM, Samidha GJ, Bhagyeshri NR. Development of an experimental diet model in rats to study hyperlipidemia and insulin resistance, markers for coronary heart disease[J]. Indian J Pharmacol, 2014, 46(3): 270–276. DOI:10.4103/0253-7613.132156 |
| [6] | Amit B, Alexander S, Juqian Z, et al. High-frequency speckle tracking echocardiography in the assessment of left ventricular function and remodeling after murine myocardial infarction[J]. Am J Physiol Heart Circ Physiol, 2014, 306(9): H1371–H1383. DOI:10.1152/ajpheart.00553.2013 |
| [7] | Yang PY, Rui YC, Jin YX, et al. Antisense oligodeoxynucleotide inhibits vascular endothelial growth factor expression in U937 foam cells[J]. Acta Pharmacol Sin, 2003, 24(6): 610–614. |
| [8] | Yang PY, Rui YC, Li K, et al. Expression of intercellular adhesion molecule-1 in U937 foam cells and inhibitory effect of imperatorin[J]. Acta Pharmacol Sin, 2002, 23(4): 327–330. |
| [9] | 药红梅, 吕吉元. 几种冠状动脉粥样硬化大鼠模型建立方法比较[J]. 中西医结合心脑血管病杂志, 2011, 9(4): 450–451. |
| [10] | 孙安阳, 俞彰, 钟慈声, 等. 大鼠动脉钙超负荷模型的建立及确证[J]. 中华医学杂志, 1999, 79(10): 769–772. |
| [11] | Bennani-Kabchi N, Kehel L, Bouayadi EF, et al. New model of atherosclerosis in insulin resistant sand rats:hypercholesterolemia combined with D2 vitamin[J]. Atherosclerosis, 2000, 150(1): 55–61. DOI:10.1016/S0021-9150(99)00365-2 |
| [12] | Li W, Tang CS, Jin HF, et al. Effects of onion extract on endogenous vascular H2S and adrenomedulin in rat atherosclerosis[J]. Curr Pharm Biotechnol, 2011, 12(9): 1427–1439. DOI:10.2174/138920111798281135 |
| [13] | 李同达, 曹洪欣, 徐慧, 等. 冠状动脉粥样硬化大鼠实验动物模型的改进与评价[J]. 中国实验动物学报, 2013, 21(6): 32–36. |
| [14] | Jeong JW, Jeong MH, Yun KH, et al. Echocardiographic epicardial fat thickness and coronary artery disease[J]. Circ J, 2007, 71(4): 536–539. DOI:10.1253/circj.71.536 |
| [15] | Zhou Y, Wei YT, Chen XZ, et al. Decreased adiponectin and increased inflammation expression in epicardial adipose tissue in coronary artery disease[J]. Cardiovasc Diabetol, 2011, 10(2): 1–9. |
| [16] | Bachar GN, Dicker D, Kornowski R, et al. Epicardial adipose tissue as a predictor of coronary artery disease in asymptomatic subjects[J]. Am J Cardiol, 2012, 110(4): 534–538. DOI:10.1016/j.amjcard.2012.04.024 |
| [17] | McKenney ML, Schultz KA, Boyd JH, et al. Epicardial adipose excision slows the progression of porcine coronary atherosclerosis[J]. J Cardiothorac Surg, 2014, 9(1): 1–24. DOI:10.1186/1749-8090-9-1 |
| [18] | Yañez-Rivera TG, Baños-Gonzalez MA, Ble-Castillo JL, et al. Relationship between epicardial adipose tissue, coronary artery disease and adiponectin in a Mexican population[J]. Cardiovasc Ultrasound, 2014, 12(12): 1–6. |
| [19] | 李新刚, 陶红, 胡荣, 等. 心外膜脂肪体积与2型糖尿病早期心功能相关性研究[J]. 中国实用内科杂志, 2016, 36(10): 878–881. |
 2017, Vol. 43
2017, Vol. 43


