扩展功能
文章信息
- 林元强, 张根茂, 隋国庆, 郭力, 李鹤群, 唐力东, 王辉
- LIN Yuanqiang, ZHANG Genmao, SUI Guoqing, GUO Li, LI Hequn, TANG Lidong, WANG Hui
- 超声造影与常规超声引导在肝脏肿物穿刺活检中应用效果的比较
- Comparison of application effects bwtween contrast-enhanced ultrasound and conventional ultrasound in liver neoplasm biopsy
- 吉林大学学报(医学版), 2017, 43(01): 164-169
- Journal of Jilin University (Medicine Edition), 2017, 43(01): 164-169
- 10.13481/j.1671-587x.20170133
-
文章历史
- 收稿日期: 2016-10-19
2. 吉林大学中日联谊医院物资供应部, 吉林 长春 130033
2. Department of Material Supply, China-Japan Union Hospital, Jilin University, Changchun 130033, China
肝实质性肿物的发病率较高,其病因包括恶性肿瘤(原发性肝癌、转移性肝癌)、良性肿瘤(肝腺瘤、血管瘤)或硬化结节等[1]。早期诊断对于下一步治疗方案的制定十分重要。通过穿刺活检获取病理学结果是诊断肝肿物的“金标准”[2-5]。超声引导下穿刺活检是最常用的方法,其临床应用越来越广泛[6-7]。穿刺活检取材仅代表局部的病变,不同病灶或同一病灶的不同部位可共存不同的病理类型,肝肿物穿刺活检的成功率为61%~98%[8-9],仅取材不足的发生率就可高达15%,必要时需再次穿刺活检[3];特别是部分多发、体积较小、坏死不全的肿物,常不能获得满意的病理学结果,影响疾病的诊断和治疗[10-12]。超声造影引导肝肿物穿刺活检是一种新兴的方法,国内外虽有相关的报道,但未对影响活检准确率的因素进行分析。本研究应用超声造影引导肝肿物穿刺活检并与常规超声引导对比,探讨其临床应用价值,同时探讨影响肝肿物活检准确率的相关因素,为肝肿物的早期诊断提供依据。
1 资料与方法 1.1 研究对象选取2013年1月-2016年4月就诊于本院肝胆外科的71例肝脏肿物患者作为研究对象。入组标准:①因不明性质肝肿物就诊;②可行肝肿物穿刺活检,无相关禁忌证;③均于穿刺后行肝肿物切除术,并行病理学检查;④预期生存期大于6个月。排出标准:①既往有肝脏手术史;②并发其他恶性肿瘤,怀疑转移性肝肿物;③急性感染期;④全身衰竭或并发其他终末期疾病,如心力衰竭、肝肾功能衰竭等。
71例患者共计73枚肿物,根据穿刺方法分为2组,其中44例患者45枚肿物行常规超声引导下穿刺(常规超声组),27例患者28枚肿物行超声造影引导下穿刺(超声造影组),所有患者均完善相关检查,经伦理委员会批准,并签署知情同意书。
1.2 主要仪器深圳Mindray公司DC-8EXP超声诊断仪,配置2~6MHz凸阵探头、实时CEUS成像分析软件;意大利Bracco Suisse SA公司Sonovue注射用六氟化硫微泡;美国Bard公司MC1616一次性活检针。
1.3 方法2组患者先行常规二维超声检查,记录肝内肿物的数目,活检目标肿物的大小、回声的均匀程度、边界及血流分级。①常规超声组患者超声选择穿刺点,选取途经正常肝组织的最短路径,注意避让Glisson系统及相邻脏器,术区及周围皮肤常规强力碘消毒,铺无菌巾单,套无菌探头套,局麻生效后经皮经肝穿刺,穿刺针沿预订针道进至肝肿物内,扣动扳机,活检3次,记录穿刺深度(穿刺目标与穿刺点的距离),复查彩超,包扎,制动观察2h。②超声造影组患者选择肿物及正常肝组织显示清晰全面切面为造影区。造影区及周围皮肤常规强力碘消毒,套无菌探头套,进入造影模式,经肘静脉团注超声造影剂Sonovue1.8mL,观察肿物造影剂充盈廓清状态,指导活检;依据造影结果选择穿刺目标点,选取途经正常肝组织的最短穿刺路径,注意避让Glisson系统及相邻脏器,铺无菌巾单,局麻生效后经皮经肝穿刺,沿预订针道进至目标活检点,扣动扳机,活检3次,记录穿刺深度,复查,包扎,制动观察2h。对于出血、疼痛的患者,严密观测生命体征变化,积极对症处置。标本均固定于10%甲醛溶液中,送病理科行组织病理学检查。所有患者行肝肿物切除术后,术后标本行组织病理学检查。
1.4 判定方法肿物的回声均匀程度依据超声显示分为均匀、不均匀不伴液化、不均匀伴液化。肿物血流分布依据Adler的半定量法分为5级[13]:0级,肿物边缘及内部均无血流分布;Ⅰ级,肿物边缘及内部存在1~2个点状血流分布;Ⅱ级,肿物边缘及内部存在3~4个点状或短线状血流分布;Ⅲ级,肿物内部或边缘存在较多血流,呈斑块或树枝状;Ⅳ级,肿物边缘及内部存在丰富血流,呈片状或网状。穿刺病理报告显示取材含病变组织并能够进行病理诊断即为取材满意。穿刺结果能够判断出肿物良恶性即为获得穿刺病理诊断。
1.5 统计学分析采用SPSS 19.0统计软件进行统计学分析。2组患者年龄、肿物大小、穿刺深度和体质量指数(BMI)以x±s表示,组间比较采用两独立样本t检验。肝脏肿物活检准确率以百分率(%)表示,组间及组内比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果 2.1 2组患者基本情况和肝脏肿物特点2组患者的基本情况及穿刺目标肿物特征见表 1。2组患者各项特征比较差异均无统计学意义(P>0.05)。
| Group | n | Age (year) | Gender (Male/Female) |
No.of tumors (n) | Tumor diameter (d/cm) | Echo uniformity | Margin (Clear/Vague) | Blood flow classification | Puncture depth (l/cm) |
BMI (kg·m-2) | ||||||||
| 1 | 2 | >2 | Homogenous | Inhomogenous without liquefaction |
Inhomogenous with liquefaction |
Level 0 | LevelⅠ | level Ⅱ | level Ⅲ | level Ⅳ | ||||||||
| Conventional ultrasound | 44 | 56.0±7.5 | 27/17 | 43 | 1 | 0 | 4.4±2.9 | 21 | 19 | 5 | 24/21 | 12 | 10 | 8 | 7 | 8 | 7.8±4.9 | 21.2±2.9 |
| Contrast-enhanced ultrasound | 27 | 58.0±8.4 | 11/16 | 26 | 1 | 0 | 3.9±3.2 | 13 | 9 | 6 | 16/12 | 5 | 4 | 6 | 7 | 6 | 8.2±5.3 | 20.8±2.5 |
73枚肝肿物均一次穿刺成功,病理回报均取材满意,能够进行病理学诊断。常规超声组典型病例超声影像见图 1,超声造影组典型病例超声影像见图 2。
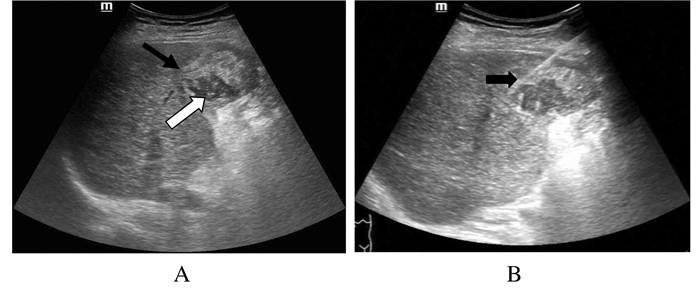
|
A:An uneven echo neoplasm ( ) inside right liver lobe, with rough boundary, and irregular liquefaction areas inside dark space ( ) inside right liver lobe, with rough boundary, and irregular liquefaction areas inside dark space ( ); B:Visible biopsy needle ( ); B:Visible biopsy needle ( ).
图 1 常规超声引导下肝肿物穿刺活检
Figure 1 Liver tumor biopsy guided by conventional ultrasound ).
图 1 常规超声引导下肝肿物穿刺活检
Figure 1 Liver tumor biopsy guided by conventional ultrasound
|
|
|
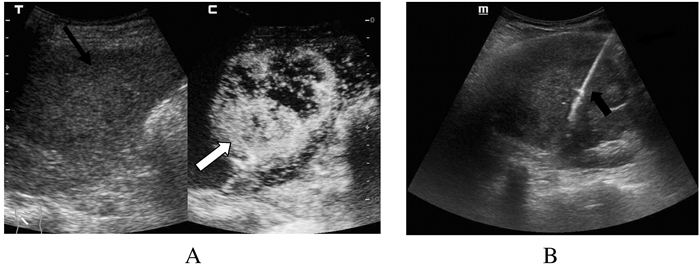
|
A:An uneven echo neoplasm ( ) inside right liver lobe, the active part was filled with a large number of contrast agent ( ) inside right liver lobe, the active part was filled with a large number of contrast agent ( ); B:Visible biopsy needle ( ); B:Visible biopsy needle ( )
图 2 超声造影引导下肝肿物穿刺活检
Figure 2 Liver tumor biopsy guided by contrast-enhanced ultrasound )
图 2 超声造影引导下肝肿物穿刺活检
Figure 2 Liver tumor biopsy guided by contrast-enhanced ultrasound
|
|
|
常规超声组患者术后诊断恶性肿瘤38枚(肝细胞癌24枚,胆管细胞癌7枚,混合性肝癌7枚),良性肿瘤7枚(血管瘤4枚,肝腺瘤1枚,炎症1枚,硬化结节1枚);穿刺活检诊断为恶性肿瘤29枚,良性肿瘤4枚,误诊4枚,不确定8枚。超声造影组患者术后诊断恶性肿瘤25枚(肝细胞癌18枚,胆管细胞癌4枚,混合性肝癌3枚),良性肿瘤3枚(硬化结节2枚,血管瘤1枚);穿刺活检诊断为恶性肿瘤23枚,良性肿瘤3枚,误诊1枚,不确定1枚。常规超声组的准确率为73.33%,超声造影组的准确率为92.86%(χ2=4.245,P<0.05);常规超声组敏感性为76.32%,超声造影组的敏感性为92.00%(χ2=2.574,P>0.05);常规超声组的特异性为57.14%,超声造影组的特异性为100%(χ2=1.837,P>0.05)。肝脏肿物穿刺活检结果见表 2。
| Group | Pathology after operation |
Biopsy | Accuracy (η/%) |
Sensibility (η/%) |
Specificity (η/%) |
||
| Malignant | Benign | Uncertain | |||||
| Conventional ultrasound | |||||||
| Malignant Benign |
38 7 |
29 1 |
3 4 |
6 2 |
73.33 | 76.32 | 57.14 |
| Contrast-enhanced unltrasound | |||||||
| Malignant Benign |
25 3 |
23 0 |
1 3 |
1 0 |
92.86* | 92.00 | 100.00 |
| χ2 | 4.245 | 2.574 | 1.837 | ||||
| P | 0.039 | 0.109 | 0.175 | ||||
| *P<0.05 compared with conventional ultrasound group. | |||||||
①常规超声组直径0~2cm肿物活检准确率为36.36%,直径2~4cm肿物活检准确率为91.30%(χ2=11.54,P<0.05);超声造影组直径0~2cm肿物活检准确率为66.67%,与常规超声组比较差异无统计学意义(χ2=0.884,P>0.05)。②常规超声组穿刺深度<5cm肿物活检准确率为95.83%,>5cm肿物活检准确率为47.62%(χ2=16.67,P<0.05);超声造影组穿刺深度>5cm肿物活检准确率为88.89%,与常规超声组比较差异有统计学意义(χ2=7.42,P<0.05)。③常规超声组回声均匀肿物活检准确率为95.00%,回声不均(伴及不伴液化)肿物活检准确率为54.17%(χ2=9.66,P<0.05);超声造影组回声不均肿物活检准确率为86.67%,与常规超声组比较差异有统计学意义(χ2=4.08,P<0.05)。④常规超声组边界清晰肿物活检准确率为96.00%,边界不清肿物活检准确率为48.00%(χ2=13.31,P<0.05);超声造影组边界不清肿物的活检准确率为83.00%,与常规超声组比较差异有统计学意义(χ2=4.08,P<0.05)。⑤常规超声组血流0~Ⅰ级肿物活检准确率为54.55%,Ⅱ~Ⅳ级肿物活检准确率为95.45%(χ2=9.82,P<0.05);超声造影组血流0~Ⅰ级肿物活检准确率为77.78%,与常规超声组比较差异无统计学意义(χ2=1.453,P>0.05)。⑥常规超声组患者肝细胞癌、胆管细胞癌和混合细胞癌活检准确率分别为83%、71%和57%,超声造影组患者肝细胞癌、胆管细胞癌和混合细胞癌活检准确率分别为94%、100%和67%,2组患者肝细胞癌、胆管细胞癌和混合细胞癌活检准确率比较差异均无统计学意义(P>0.05)。
2.4 2组患者肝脏肿物穿刺后并发症所有患者穿刺后观察2~4h,均无出血、胆汁漏等并发症发生, 无与穿刺相关的死亡发生。7例患者出现穿刺点周围疼痛,经过观察对症处置后缓解。随访3个月,均无针道种植的发生。
3 讨论超声造影是利用静脉超声造影剂使病灶散射回声增强,提高超声影像的分辨力,很好地反映组织的血流灌注情况[14],可为肿瘤定性及可能的组织分化程度提供有效信息[15]。超声造影能够显示肿物内微血管分布,帮助分辨活性、坏死区域,肿瘤在生长过程中因细胞生长速度远快于微血管的生长速度,使得部分区域缺血出现变性坏死,常规超声对于坏死组织不易区分[16],而超声造影可以轻易分辨坏死区域,其在各期均无造影剂充盈[17],活性区域可见造影剂充盈。不同病理类型肿物造影剂充盈廓清具有一定的特点,组织血流灌注各不相同,可以辅助临床医生判断疾病性质及合理选择穿刺点[18]。超声造影相继被应用于各种肿物的穿刺活检中,2004年Schlottmann等[19]和Bang等[20]分别进行了超声造影用于肝脏穿刺活检的报道。
文献[21]报道:超声造影可以提高穿刺1~2次的满意取材率,但简单依据肉眼判断取材是否满意具有很大的主观性, 因此本研究依据病理报告, 凡是含病变组织并能够进行病理学诊断的取材均为取材满意。本研究71枚肝脏肿物均穿刺3次,穿刺病理回报均能够进行病理学诊断,取材满意。同时超声造影充分显示了微血管及组织血流灌注特点,指导活检明显提高了活检准确性,本研究超声造影组活检准确率(92.86%)明显高于常规超声组(73.33%)。
影响活检准确率的因素很多,肿物的数目、目标肿物的大小、穿刺深度、回声均匀度、边界、血流分布和病理类型只是诸多因素中的一部分。文献[22-23]报道:多发肿物容易坏死,活检准确率降低,但肿物超过3枚的患者多不适合外科手术,故排除在本研究之外。目标肿物较小会增加穿刺难度,降低穿刺的准确性;较大肿物的中心容易发生缺血坏死,降低标本取材量。本研究常规超声组直径0~2 cm肿物的活检准确率明显低于直径2~4 cm肿物的活检准确率,当肿物直径>4 cm时准确率又逐渐降低, 但可能受制于本研究样本较少的缺陷,并未发现显著性差异。深度越深,超声分辨率越低、穿刺准确性及取材量均降低,常规超声组穿刺深度<5 cm的活检准确率明显高于穿刺深度>5 cm的肿物;超声造影组应用超声造影引导后>5 cm肿物的活检准确率明显升高。肿物发生变性或者坏死时回声均匀度会发生不同程度变化,部分肿物表现为回声不均匀伴或不伴液化,典型病变取材量会降低,活检准确率下降,常规超声组回声均匀肿物活检准确率明显高于回声不均匀肿物(伴液化及不伴液化),超声造影组应用超声造影引导明显提高回声不均肿物的活检准确率。边界清与不清会影响取材的代表性,常规超声组边界清晰肿物的活检准确率明显高于边界不清肿物的准确率,超声造影组应用超声造影引导可以更加准确地界定典型病变区域,明显提高边界不清肿物的活检准确率。血流可以反映肿物的活性程度,血流越多,活性成分比例越高,活检准确率越高,常规超声组0~Ⅰ级肿物活检准确率明显低于Ⅱ~Ⅳ级肿瘤。本研究结果显示:病理类型对于肿物活检准确率并无明显影响,2组患者肝细胞癌、胆管细胞癌和混合细胞癌活检准确率比较差异无统计学意义。转移性肝肿物,病程进入中晚期,多不适合外科手术,故排除在本研究之外。
对于直径<2 cm、回声不均匀(伴或不伴液化)、边界不清、血流0~Ⅰ级和穿刺深度>5 cm的肝肿物,常规超声引导活检准确率低。对于肿物直径<2 cm和血流0~Ⅰ级的肝肿物,应用超声造影引导并不能明显提高穿刺活检准确率;对于回声不均匀、边界不清、穿刺深度>5 cm的肿物,应用超声造影引导能明显提高活检准确率;但对于提高整体的活检准确率,超声造影引导具有明显的差别,这对于肝肿物的早期诊断具有重要意义。由于本研究的样本数量较少,所以需要继续进行大样本的研究。
综上所述,超声造影引导可以明显提高肝脏肿物的活检准确率;对于肿物直径<2 cm、回声不均匀(伴或不伴液化)、边界不清、血流0~Ⅰ级及穿刺深度>5 cm的肝脏肿物,常规超声引导穿刺的活检准确率相对较低,建议在超声造影引导下进行穿刺活检。
| [1] | Palma RM, Bielsa S, panades MJ, et al. Diagnostic yield of fine-needle aspiration puncture for cytology of multifocal liver lesions:A comparison between image-guided and blind aspirations[J]. Rev Clin Esp (Barc), 2013, 213(9): 435–439. DOI:10.1016/j.rce.2013.06.008 |
| [2] | van der Perren K, Haers H, van derVekens E, et al. Description of the use of contrast-enhanced ultrasonography in four dogs with pancreatictumours[J]. J Small Animpract, 2014, 55(3): 164–169. |
| [3] | Francque SM, De Pauw FF, van den Steen GH, et al. Biopsy offocal liverlesions:guidelines, comparison of techniques and cost-analysis[J]. Acta Gastroenterol Belg, 2003, 66(2): 160–165. |
| [4] | Nobili V, Comparcola D, Sartorelli MR, et al. Blind and ultrasound-guided percutaneous liver biopsy in children[J]. Pediatr Radiol, 2003, 33(11): 772–775. DOI:10.1007/s00247-003-1044-0 |
| [5] | Rossi P, Sileri P, Gentileschi P, et al. Percutaneous liver biopsy using an ultrasound-guided subcostal route[J]. Dig Dis Sci, 2001, 46(1): 128–132. DOI:10.1023/A:1005571904713 |
| [6] | Makhlouf HR, Abdul-Al HM, Goodman ZD. Diagnosis of focal nodular hyperplasia of the liver by needle biopsy[J]. Hum Pathol, 2005, 36(11): 1210–1216. DOI:10.1016/j.humpath.2005.08.014 |
| [7] | Bialecki ES, Ezenekwe AM, Brunt EM, et al. Comparison of liver Biopsy andnoninvasive methods for diagnosis of hepatocellular carcinoma[J]. Clin Gastroenterol Hepatol, 2006, 4(3): 361–368. DOI:10.1016/S1542-3565(05)00977-8 |
| [8] | Yu SC, Liew CT, Lau WY, et al. US guided percutaneous biopsy of small hepaticlesions[J]. Radiology, 2001, 218(1): 195–199. DOI:10.1148/radiology.218.1.r01ja02195 |
| [9] | Poynard T, Ratziu V, Bedossa P, et al. Appropriateness of liver biopsy[J]. Can J Gastroenterol, 2000, 14(6): 543–548. DOI:10.1155/2000/107982 |
| [10] | Uchino K, Tateishi R, Nakagawa H, et al. Uninodular combined hepatocellular and cholangio carcinoma with multiple non-neoplastic hypervascular lesions appearing in the liver of a patient with HIV and HCV coinfection[J]. J Clin Virol, 2013, 57(2): 173–177. DOI:10.1016/j.jcv.2013.01.012 |
| [11] | Kim TK, Jang HJ. Contrast-enhanced ultrasound in the diagnosis of nodules in liver cirrhosis[J]. World J Gastroenterol, 2014, 20(13): 3590–3596. DOI:10.3748/wjg.v20.i13.3590 |
| [12] | Sporea I, Martie A, Bota S, et al. Characterization of focal liver lesions using contrast enhanced ultrasound as a firstline method:a large monocentric experience[J]. J Gastrointestin Liver Dis, 2014, 23(1): 57–63. |
| [13] | Adler DD, Carson PL, Rubin JM, et al. Doppler ultrasound color flow imaging in the study of breast cancer:preliminary findings[J]. Ultrasound Med Biol, 1990, 16(6): 553–559. DOI:10.1016/0301-5629(90)90020-D |
| [14] | Liu J, Qian LX. Therapeutic efficacy comparison of radiofrequency ablation in hepatocellulai carcinoma and metastatic liver cancer[J]. Exp Ther Med, 2014, 7(4): 897–900. |
| [15] | Chiorean L, Cantisani V, Jenssen C, et al. Focal masses in a non-cirrhotic liver:The additional benefit of CEUS over baseline imaging[J]. Eur Radiol, 2015, 84(9): 1636–1643. DOI:10.1016/j.ejrad.2015.05.007 |
| [16] | Solbiati L, Ierace T, Tonolini M, et al. Guidance and monitoring of radiofrequency liver tumor ablation with contrast enhanced ultrasound[J]. Eur J Radiol, 2004, 51(Suppl): S19–S23. |
| [17] | Liu GJ, Lu MD, Xie XY, et al. Real-time contrast-enhanced ultrasound imaging of infected focal liver lesions[J]. J Ultrasound Med, 2008, 27(4): 657–666. DOI:10.7863/jum.2008.27.4.657 |
| [18] | Bouhlel N, Coron A, Barrois G, et al. Dual-mode registration of dynamic contrast-enhanced ultrasound combining tissue and contrast sequences[J]. Ultrasonics, 2014, 54(5): 1289–1299. DOI:10.1016/j.ultras.2014.01.005 |
| [19] | Schlottmann K, Klebl F, Zorger N, et al. Contrast-enhanced ultrasound allows for interventions of hepatic lesions which are invisible on convential B-mode[J]. Z Gastroenterol, 2004, 42(4): 303–310. DOI:10.1055/s-2004-812712 |
| [20] | Bang N, Bachmann Nielsen M, Vejborg I, et al. Clinical report:contrast enhancement of tumor perfusion as a guidance for biopsy[J]. Eur J Ultrasound, 2000, 12(2): 159–161. DOI:10.1016/S0929-8266(00)00108-7 |
| [21] | 吴薇, 陈敏华, 严昆, 等. 超声造影对提高肝肿瘤穿刺活检诊断率的应用价值[J]. 中华医学杂志, 2006, 86(2): 116–120. |
| [22] | Kim TK, Jang HJ. Contrast-enhanced ultrasound in the diagnosis of nodules in liver cirrhosis[J]. World Gastroenterol, 2014, 20(13): 3590–3596. DOI:10.3748/wjg.v20.i13.3590 |
| [23] | 于刚, 于又曦, 张平, 等. 原发性肝脏癌肉瘤1例报告[J]. 临床肝胆病杂志, 2015, 31(11): 1899–1901. |
 2017, Vol. 43
2017, Vol. 43


