扩展功能
文章信息
- 李艳凤, 王洪波, 高阳, 郑雨轩, 刘丽
- LI Yanfeng, WANG Hongbo, GAO Yang, ZHENG Yuxuan, LIU Li
- 支气管哮喘患儿血清骨膜蛋白水平变化及其意义
- Change of serum periostinlevel in children with bronchial asthma and significance
- 吉林大学学报(医学版), 2017, 43(01): 101-105
- Journal of Jilin University (Medicine Edition), 2017, 43(01): 101-105
- 10.13481/j.1671-587x.20170120
-
文章历史
- 收稿日期: 2016-06-23
2. 吉林大学第一医院转化医学研究院, 吉林 长春 130061
2. Institute of Translational Medicine, First Hospital, Jilin University, Changchun 130061, China
支气管哮喘(bronchial asthma)简称哮喘,是呼吸内科常见的慢性疾病,临床表现以反复发作的喘息、气促和咳嗽等可逆性气流受限为主。哮喘发病的年龄范围十分广泛,但约半数患者为16岁以下儿童。目前研究[1]显示:哮喘是一种由多种炎症细胞及其炎症因子参与的慢性变态反应性炎症性疾病,其发生与患者气道高反应性有关。目前对于哮喘的病因和发病机制尚不明确,但近年来血清标志物检测对于哮喘诊断方面的价值日益凸显[2]。Parulekar等[3]研究显示:在Th2介导的气道炎性反应中有骨膜蛋白(periostin)的表达;2013年,Kanemitsu等[4]发现:罗氏单抗对于改善血清中高骨膜蛋白水平哮喘患者的肺功能更为有效。目前对于哮喘患儿外周血中骨膜蛋白水平的研究较少,本研究着重探讨哮喘患儿外周血中骨膜蛋白水平与气道高反应性的关系,并初步阐明其作用机制。
1 资料与方法 1.1 一般资料随机选取2014年1-12月吉林大学第一医院小儿呼吸一科收治的支气管哮喘患儿(年龄≤16岁)65例作为观察组,其中男性38例,女性27例;年龄4~16岁,平均年龄(10.5±5.8)岁;发病时间3~18个月,平均发病时间(9.4±7.3)个月;根据哮喘非发作期病情严重程度分级,其中间歇发作19例,轻度持续27例,中度持续19例。另随机选取同时期门诊体检结果为健康的儿童50人作为对照组,其中男性29人,女性21人;年龄3~16岁,平均年龄(8.7±6.6)岁。2组儿童性别和年龄等一般临床资料比较差异无统计学意义(P>0.05)。本研究经吉林大学第一医院伦理委员会审查通过,所有儿童均有监护人签署知情同意书。
1.2 入选标准纳入标准[5-6]:①观察组患儿诊断符合《儿童支气管哮喘诊断和防治指南》中支气管哮喘的诊断标准,且均为首次诊断为支气管哮喘;②无其他已知的食物和药物过敏史;③就诊前3个月内未使用过免疫抑制剂或激素;④对照组儿童就诊前无喘息史,且1个月内未发生感染。排除标准[7-8]:①观察组患儿哮喘急性加重,需使用糖皮质激素治疗者;②呼出气一氧化氮(FeNO)≥20ppb或皮肤点刺实验阳性者;③就诊前1个月内胸部正、侧位片显示有肺实质病变者。
1.3 检测方法观察组儿童纳入研究后,4周内不得使用治疗哮喘相关药物,排除此期间内因哮喘急性发作需要药物治疗者。4周后,观察组儿童于就诊当日上午8:00~9:00点空腹抽取肘正中静脉血5mL,采用酶联免疫吸附测定(ELISA)法检测血清中骨膜蛋白水平,检测外周血中IgE和嗜酸细胞阳离子蛋白(eosinophil cationic protein,ECP)水平及嗜酸性粒细胞计数,并检测FeNO (ppb)、1秒用力呼气容积占预计值百分比(Forced expiratory volume in one second/predicted value, FEV1%pred)、用力肺活量(forced vital capacity, FVC)和FEV1/FVC比值等呼吸功能指标。ELISA试剂盒购自卡迈舒(上海)生物科技有限公司,所有操作均严格按照说明书操作。对照组儿童检测指标和时间间隔与观察组患儿相同。
1.4 统计学分析采用SPSS 19.0统计软件进行统计学分析。外周血中骨膜蛋白、IgE、ECP水平和嗜酸性粒细胞计数、FeNO、FEV1%pred、FVC及FEV1/FVC以x±s 表示,组间比较采用两独立样本t检验。骨膜蛋白预测哮喘的诊断可靠性和最佳界点分析采用受试者工作特征曲线(ROC曲线)。骨膜蛋白水平与嗜酸性粒细胞计数、ECP、FeNO、IgE、FEV1%pred、FVC及FEV1/FVC的相关性分析采用Pearson线性相关分析法。以P<0.05为差异有统计学意义。
2 结果 2.1 2组受试者各项检测指标与对照组比较,观察组患儿血清骨膜蛋白、IgE、ECP水平及嗜酸性粒细胞计数和FeNO均明显升高(P<0.01),FEV1%pred和FEV1/FVC比值均明显降低(P<0.01),2组间FVC比较差异无统计学意义(P>0.05)。见表 1。
| (x±s) | |||||||||
| Group | n | Periostin[ρB/(μg·L-1)] | IgE[λB/(IU·mL-1)] | Eosinophil (mL-1) | ECP[ρB/ (μg·L-1)] | FeNO (ppb) | FEV1%pred (η/%) | FVC (η/%) | FEV1/FVC |
| Control | 50 | 70.24±11.99 | 58.17±17.02 | 103.96±7.62 | 5.88±1.29 | 9.53±2.64 | 100.7±6.1 | 96.9±4.3 | 0.928±0.037 |
| Observation | 65 | 77.61±18.73* | 224.30±49.83* | 462.75±18.40* | 43.86±15.94* | 17.39±1.57* | 82.9±9.4* | 91.7±8.8 | 0.819±0.072* |
| *P<0.01 compared with control group | |||||||||
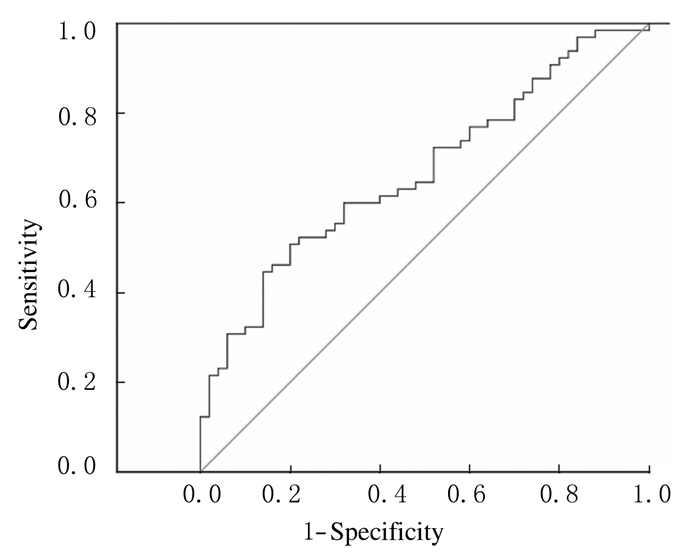
ROC曲线结果:采用血清骨膜蛋白水平诊断哮喘,其ROC曲线下面积(AUC)=0.668,P=0.02,骨膜蛋白水平界点为80.89 μg·L-1(95%CI:0.570~0.766),此时其灵敏度为29.23%,特异度为92.00%,假阳性率为70.77%,假阴性率为8.00%。见图 1。
|
| 图 1 骨膜蛋白诊断哮喘的ROC曲线 Figure 1 ROC curve of periostin to dignose asthma |
|
|
哮喘患儿血清骨膜蛋白水平与ECP、IgE、FEV1%pred、FVC和FEV1/FVC比值无相关关系(P>0.05),与嗜酸性粒细胞计数和FeNO呈正相关关系(r=0.519,P=0.019;r=0.602,P=0008)。见表 2。
| Indicator | Periostin | |
| r | P | |
| Eosinophil | 0.519 | 0.019 |
| ECP | 0.051 | 0.779 |
| FeNO | 0.602 | 0.008 |
| IgE | 0.303 | 0.087 |
| FEV1%pred | 0.068 | 0.504 |
| FVC | 0.134 | 0.241 |
| FEV1/FVC | -0.016 | 0.483 |
骨膜蛋白是成束蛋白家族(fasciclin protein family)中的一员,其相对分子质量为90 000,最早在小鼠成骨细胞中被发现,并被命名为特异性成骨细胞因子2(osteoblast specific factor-2,OSF-2),后更名为Preiostin[9]。骨膜蛋白在肺、骨、皮肤和乳腺组织中均有不同程度表达,而在胰腺、肝脏、结直肠和淋巴结中几乎不表达。Lv等[10]发现:骨膜蛋白在受伤的血管和上皮细胞向间叶细胞转化中呈高表达。目前,对于骨膜蛋白在肿瘤中作用的研究较多,Ohta等[11]在非小细胞肺癌组织中发现:骨膜蛋白可以作为αvβ3、αvβ5和α4β6的配合体,影响癌细胞的迁移,并且认为血清中高水平的骨膜蛋白与肿瘤的转移和预后不良相关。国外新近研究[12-13]显示:骨膜蛋白可能与Th2介导的气道炎症反应有关,在IL-4和IL-13介导的信号通路下游均发现有骨膜蛋白的表达。据此推测骨膜蛋白也可能与哮喘的发生发展有关。
本研究结果显示:观察组患儿血清骨膜蛋白水平、IgE水平、ECP水平、嗜酸性粒细胞计数和FeNO均明显高于对照组(P<0.05),而FEV1%pred和FEV1/FVC比值均明显低于对照组(P<0.05),与Yamaguchi等[14]的研究结果相似,提示血清骨膜蛋白水平升高与哮喘有关联。Agrawal等[15]发现:哮喘患者的气道上皮细胞中骨膜蛋白mRNA表达水平明显高于健康对照组,该结果与本研究结果相似。骨膜蛋白是一种间皮细胞分泌的蛋白,主要表达在骨组织、心肌、血管和皮肤组织中。目前研究[16-17]显示:骨膜蛋白与多种整合素有关联,且与细胞的增殖、重建以及血管的生成有关。本研究只检测了哮喘患儿血清骨膜蛋白水平,由于儿童的骨组织处于生长时期,故可能其血清骨膜蛋白水平较成年人稍高,而这是否与哮喘好发于儿童有关目前尚不清楚,有待进一步研究。
本研究同时分析了血清骨膜蛋白水平与哮喘的关系,结果显示:采用血清骨膜蛋白水平诊断哮喘,其AUC=0.668,P=0.02,骨膜蛋白水平界点为80.89 μg·L-1(95%CI:0.570~0.766),此时其灵敏度为29.23%,特异度为92.00%,假阳性率为70.77%,假阴性率为8.00%。目前对于哮喘的检查有支气管镜、痰液检查和呼气检查,但具有浪费时间、价格较贵和具有侵袭性等不足,除此之外,这些检查项目无法广泛地应用于哮喘的初期筛查。本研究结果提示:根据血清骨膜蛋白水平对儿童哮喘的早期筛查作用较差(AUC=0.668,灵敏度为29.23%),但可与其他血清标志物共同检测,作为鉴别哮喘与其他呼吸道阻塞性疾病的指标。本研究得到的骨膜蛋白水平界点与Izuhara等[18]研究结果稍有差异,这可能是由于地域、环境等因素或样本量较小造成的。
近年来,在有关哮喘病因的学说中,炎症学说得到广泛认可。外源性过敏原刺激肥大细胞释放的炎性介质(如白三烯、血小板活化因子和嗜酸性粒细胞趋化因子等)可以使气道被嗜酸性粒细胞等炎性细胞所浸润,这些炎性细胞释放的ECP和主要碱性蛋白(MBP)等可以破坏黏膜上皮,增加血管通透性,造成组织水肿,从而诱发哮喘。新近研究[19]表明:哮喘患者Th1功能受到抑制,而Th2功能亢进,Th2分泌的IL-4和IL-13可以促进B细胞产生IgE。本研究结果显示:哮喘患儿血清骨膜蛋白水平与ECP、IgE、FEV1%pred、FVC和FEV1/FVC比值均无相关性,与嗜酸性粒细胞计数和FeNO呈正相关关系,且差异有统计学意义。Ingram等[20-21]发现:哮喘患者外周血和气道中嗜酸性粒细胞计数与血清中骨膜蛋白水平呈正相关关系,与本次研究结果相似。提示可以将Th2介导的炎性反应过程作为治疗哮喘的靶点,而骨膜蛋白水平可以作为检测哮喘治疗效果的一项指标。
综上所述,骨膜蛋白水平在哮喘患儿外周血中明显升高,可以作为初步排查儿童哮喘的指标,抑制Th2介导的炎性反应过程是治疗哮喘的靶点。
| [1] | Beasley R, Semprini A, Mitchell EA. Risk factors for asthma:is prevention possible[J]. Lancet, 2015, 386(9998): 1075–1085. DOI:10.1016/S0140-6736(15)00156-7 |
| [2] | Bartminski G, Crossley M, Turcanu V. Novel biomarkers for asthma stratification and personalized therapy[J]. Expert Rev Mol Diagn, 2015, 15(3): 415–430. DOI:10.1586/14737159.2015.988613 |
| [3] | Parulekar AD, Atik MA, Hanania NA. Periostin, a novel biomarker of TH2-driven asthma[J]. Curr Opin Pulm Med, 2014, 20(1): 60–65. DOI:10.1097/MCP.0000000000000005 |
| [4] | Kanemitsu Y, Matsumoto H, Izuhara K, et al. Increased periostin associates with greater airflow limitation in patients receiving inhaled corticosteroids[J]. J Allergy Clin Immunol, 2013, 132(2): 305–312. DOI:10.1016/j.jaci.2013.04.050 |
| [5] | Nair P, Kraft M. Serum periostin as a marker of T (H)2-dependent eosinophilic airway inflammation[J]. J Allergy Clin Immunol, 2012, 130(3): 655–656. DOI:10.1016/j.jaci.2012.07.021 |
| [6] | Bobolea I, Barranco P, DelPozo V, et al. Sputum periostin in patients with different severe asthma phenotypes[J]. Allergy, 2015, 70(5): 540–546. DOI:10.1111/all.12580 |
| [7] | Anastasilakis AD, Polyzos SA, Makras P, et al. Circulating periostin levels do not differ between postmenopausal women with normal and low bone mass and are not affected by zoledronic acid treatment[J]. Horm Metab Res, 2014, 46(2): 145–149. |
| [8] | Thomson NC, Chaudhuri R, Spears M, et al. Serum periostin in smokers and never smokers with asthma[J]. Respir Med, 2015, 109(6): 708–715. DOI:10.1016/j.rmed.2015.03.009 |
| [9] | Okamoto M, Hoshino T, Kitasato Y, et al. Periostin, a matrix protein, is a novel biomarker for idiopathic interstitial pneumonias[J]. Eur Respir J, 2011, 37(5): 1119–1127. DOI:10.1183/09031936.00059810 |
| [10] | Lv Y, Wang W, Jia WD, et al. High preoparative levels of serum periostin are associated with poor prognosis in patients with hepatocellular carcinoma after hepatectomy[J]. Eur J Surg Oncol, 2013, 39(10): 1129–1135. DOI:10.1016/j.ejso.2013.06.023 |
| [11] | Ohta N, Kurakami K, Ishida A, et al. Roles of TGF-beta and periostin in fibrosclerosis in patients with IgG4-related diseases[J]. Acta Otolaryngol, 2013, 133(12): 1322–1327. DOI:10.3109/00016489.2013.831187 |
| [12] | Gordon ED, Sidhu SS, Wang ZE, et al. A protective role for periostin and TGF-β in IgE-mediated allergy and airway hyperresponsiveness[J]. Clin Exp Allergy, 2012, 42(1): 144–155. DOI:10.1111/j.1365-2222.2011.03840.x |
| [13] | Matsusaka M, Kabata H, Fukunaga K, et al. Phenotype of asthma related with high serum periostin levels[J]. Allergol Int, 2015, 64(2): 175–180. DOI:10.1016/j.alit.2014.07.003 |
| [14] | Yamaguchi Y, Ono J, Masuoka M, et al. Serum periostin levels are correlated with progressive skin sclerosis in patients with systemic sclerosis[J]. Br J Dermatol, 2013, 168(4): 717–725. DOI:10.1111/bjd.2013.168.issue-4 |
| [15] | Agrawal S, Townley RG. Role of periostin, FENO, IL-13, lebrikzumab, other IL-13 antagonist and dual IL-4/IL-13 antagonist in asthma[J]. Expert Opin Biol Ther, 2014, 14(2): 165–181. DOI:10.1517/14712598.2014.859673 |
| [16] | Song JS, You JS, Jeong SI, et al. Serum periostin levels correlate with airway hyper-responsiveness to methacholine and mannitol in children with asthma[J]. Allergy, 2015, 70(6): 674–681. DOI:10.1111/all.2015.70.issue-6 |
| [17] | Wagener AH, de Nijs SB, Lutter R, et al. External validation of blood eosinophils, FE (NO) and serum periostin as surrogates for sputum eosinophils in asthma[J]. Thorax, 2015, 70(2): 115–120. DOI:10.1136/thoraxjnl-2014-205634 |
| [18] | Izuhara Y, Matsumoto H, Kanemitsu Y, et al. GLCCI1 variant accelerates pulmonary function decline in patients with asthma receiving inhaled corticosteroids[J]. Allergy, 2014, 69(5): 668–673. DOI:10.1111/all.12400 |
| [19] | Kim MA, Shin YS, Pham LD, et al. Adult asthma biomarkers[J]. Curr Opin Allergy Clin Immunol, 2014, 14(1): 49–54. DOI:10.1097/ACI.0000000000000028 |
| [20] | Ingram JL, Kraft M. IL-13 in asthma and allergic disease:asthma phenotypes and targeted therapies[J]. J Allergy Clin Immunol, 2012, 130(4): 829–842. DOI:10.1016/j.jaci.2012.06.034 |
| [21] | 湛洁谊, 卢慧敏, 林穗玲. 哮喘患儿外周血CD4+CD25nt/hiCD127lo调节性T细胞的测定及临床意义[J]. 中国实验诊断学, 2016, 20(1): 78–80. |
 2017, Vol. 43
2017, Vol. 43


