扩展功能
文章信息
- 斯琴, 关英慧, 唐颖, 李晓丹, 陈丽燕, 许力军
- SI Qin, GUAN Yinghui, TANG Ying, LI Xiaodan, CHEN Liyan, XU Lijun
- IL-33和sST2在恶性胸腔积液和结核性胸腔积液患者胸腔积液和外周血中的表达水平及其临床意义
- Expression levels of IL-33 of interleukin -33 and sST2 in pleural effusion and peripheral blood of patients with malignant and tuberculous pleural effusion and their clinical significances
- 吉林大学学报(医学版), 2017, 43(01): 91-95
- Journal of Jilin University (Medicine Edition), 2017, 43(01): 91-95
- 10.13481/j.1671-587x.20170118
-
文章历史
- 收稿日期: 2016-07-08
恶性胸腔积液(malignant pleural effusion, MPE)是胸膜被肿瘤细胞侵犯而产生,提示疾病的预后不良,患者仅有4个月的中位生存期[1]。肿瘤微环境造成的免疫抑制会使CD4+Th1细胞及CD8+CTLs处于一种免疫无能状态,因此寻找可以活化肿瘤浸润性淋巴细胞(TILs),逆转其无反应性,改变肿瘤微环境的新的分子和途径,已成为肿瘤免疫治疗的一大热点。近期研究[2]表明:白细胞介素33(interleukin-33,IL-33)在许多肿瘤发生发展过程中持续异常表达并起着重要作用,其IL-33/ST2轴信号通路亦成为多种致瘤信号的交汇点。IL-33协同T细胞抗原受体(Tcell receptor, TCR)信号及IL-12可以促进小鼠细胞毒性T细胞1(Tc1)干扰素γ(IFN-γ)的分泌,在小鼠B16黑色素瘤荷瘤模型中,肿瘤微环境表达的IL-33明显提高肿瘤浸润CD8+T细胞IFN-γ的分泌,并且能延缓肿瘤的生长。可溶性ST2(sST2)为IL-33的可溶性受体,即分泌型ST2,可分泌到细胞外,多在皮肤(包括成纤维细胞)、乳腺和视网膜中诱导表达,由9个氨基酸组成的独特C端序列。sST2能够结合并中和IL-33,起诱饵受体的作用。但目前相关研究仍较少,且其作用机制尚不明确。结核性胸腔积液(tuberculous pleural effusion,TPE)主要见于结核性胸膜炎,TPE是Th1细胞因子如IFN-γ和肿瘤坏死因子α(TNF-α)等占主导地位的免疫环境[3-4],IL-33诱发Th1细胞因子IFN-γ的增加[5],另一方面IFN-γ和TNF-α可以上调IL-33的表达[6]。本研究通过检测MPE和TPE患者胸腔积液和外周血中IL-33及sST2的表达水平,旨在探讨IL-33和sST2在胸腔积液产生中的作用。
1 资料与方法 1.1 研究对象随机筛选2015年1-12月在本院住院的经临床诊断为渗出性胸腔积液患者,根据内科胸腔镜病理检查结果,最终本研究共纳入患者72例,其中MPE42例,TPE30例。健康对照组38人,均为本院体检正常者。所有受试者均签署知情同意书,并由伦理委员会批准。
1.2 研究对象纳入和排除标准符合以下其中1项并除外其他原因所引起的胸腔积液者可诊断为TPE:①经胸腔积液检查凡能检测到抗酸杆菌,和(或)在胸膜活检样本发现肉芽肿样改变者,并能排除其他原因所导致的肉芽肿性胸膜炎;②根据Light标准胸腔积液若符合渗出液改变,胸腔积液细胞成分以淋巴细胞为主,胸腔积液中的腺苷脱氨酶(ADA)>40 U·L-1,结核菌素试验(即皮肤纯蛋白衍化物试验)结果为阳性; 通过抗结核治疗,胸腔积液吸收,并且临床症状缓解。
符合下列3项者可诊断为MPE:①影像学结果符合原发性支气管肺癌并发胸腔积液;②经纤维支气管镜或胸腔镜取得的肺部组织活检其病理学确诊为肺癌;③胸腔积液脱落细胞学检查检测到转移性肿瘤细胞。
符合以下任意1项者即可排除:①在入院前既往3个月内曾接受任何有创性胸膜腔检查和(或)治疗,或者罹患胸部外伤者;②曾接受过任何抗肿瘤或抗结核治疗的患者;③使用过糖皮质激素、非甾体抗炎药或免疫抑制剂者;④并发其他免疫性疾病的患者;⑤胸腔积液病因诊断不明确者。
1.3 采用酶联免疫吸附测定(ELISA)法检测胸腔积液和血清中IL-33和sST2表达水平在预先包被的IL-33抗体/sST2抗体微孔中,依序加入待检测标本、标准品和辣根过氧化物酶标记的检测抗体,经过温育并彻底洗涤。采用底物四甲基联苯胺显色,其在过氧化物酶催化下转化成蓝色,在酸作用下变化成最终的黄色。颜色的深浅变化与样品中IL-33和sST2水平呈正相关关系。用酶标仪在450nm波长下测定吸光度(A)值,并计算样品表达水平。
1.4 受试者工作特征曲线(ROC曲线)癌胚抗原(CEA)在肿瘤细胞侵袭胸膜时产生,恶性胸腔积液中CEA水平较血清增高的早且明显。应用SPSS20.0软件绘制ROC曲线,确定IL-33表达水平和sST2/IL-33比值鉴别MPE与TPE的最佳阈值、敏感度及特异度,并与CEA进行对比。
1.5 统计学分析采用SPSS20.0软件进行统计学分析。胸腔积液和血清中IL-33和sST2的表达水平以x±s表示,组间比较采用两独立样本t检验。采用Spearman秩相关分析检验各组患者胸腔积液与其相对应的血清中IL-33和sST2表达水平的相关性。
2 结果 2.1 各组受试者胸腔积液和血清中IL-33及sST2表达水平MPE组和TPE组患者血清中IL-33及sST2表达水平比较差异无统计学意义(P>0.05),但均明显高于健康对照组(P < 0.01)。TPE组患者胸腔积液中IL-33表达水平明显高于其相应血清水平(P < 0.01),MPE组患者胸腔积液中IL-33表达水平明显低于其相应血清水平(P < 0.05),TPE组患者胸腔积液中IL-33表达水平明显高于MPE组(P < 0.05)。TPE组患者胸腔积液中sST2表达水平明显低于其相应血清水平(P < 0.01),MPE组患者胸腔积液中sST2表达水平与其相应血清水平比较差异无统计学意义(P>0.05),TPE组患者胸腔积液中sST2水平明显低于MPE组(P < 0.01)。见表 1。
| [x±s,ρB/(ng·L-1)] | ||||||
| Group | n | IL-33 | sST2 | |||
| Pleural effusion | Serum | Pleural effusion | Serum | |||
| Normal | 38 | - | 50.15±2.02 | - | 1 200.0±281.0 | |
| MPE | 42 | 52.66±10.60△ | 59.24±17.40* | 1 144.0±215.2 | 1 230.0±347.1* | |
| TPE | 30 | 82.38±23.46△△# | 73.09±17.36* | 746.9±42.7△△## | 1 437.0±482.3* | |
| “-”:No data; *P<0.01 vs normal group;△P<0.05,△△P<0.01 vs serum; #P<0.05, ##P<0.01 vs MPE group. | ||||||
MPE组与TPE组患者胸腔积液和其相应血清中IL-33表达水平均呈正相关关系(rMPE=0.930 4,rTPE=0.990 7,P <0.01);MPE组患者胸腔积液中sST2表达水平与其相应血清中sST2表达水平呈正相关关系(r=0.934 5,P <0.01),但TPE患者胸腔积液与血清中sST2表达水平无相关性(r=0.142 7, P>0.05)。
2.3 2组患者ROC曲线ROC曲线中,胸腔积液中IL-33表达水平和sST2/IL-33比值作为鉴别MPE和TPE的诊断指标明显优于胸腔积液中CEA表达水平,且其联合诊断价值较其任意一种指标的敏感度和特异度均高,IL-33表达水平和sST2/IL-33比值鉴别MPE与TPE的最佳阈值分别为17.08ng·L-1和15.06。在鉴别MPE和TPE的诊断中,CEA敏感度和特异度分别为85.7%和92.3%,IL-33的敏感度和特异度分别为96.7%和92.9%,sST2/IL-33比值的敏感度和特异度分别为96.8%和95.9%,sST2/IL-33比值与CEA联合诊断的敏感度和特异度分别为99.5%和99.6%。见图 1。
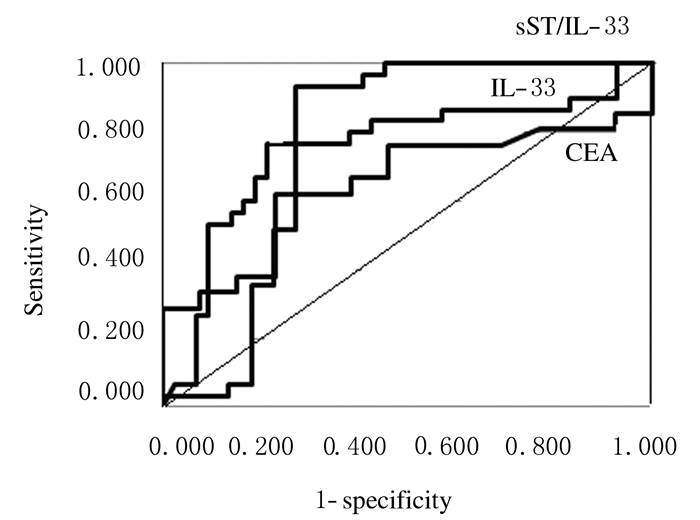
|
| 图 1 2组患者的ROC曲线 Figure 1 ROC ofpatients in two groups |
|
|
渗出性胸腔积液中最常见的是肿瘤所致的MPE和结核杆菌所致的TPE,虽然目前对二者的发病原理、鉴别诊断及其免疫调控因素等研究越来越全面和系统,但其鉴别仍面临困难,因为二者有着相似的临床表现和实验室检测结果,且有时缺少病理学和病因学证据[7]。MPE的产生机制是肿瘤细胞侵袭壁层胸膜淋巴微孔和(或)纵隔淋巴结导致局部淋巴回流阻碍,从而限制胸腔积液的重吸收而促使其产生。尽管许多肿瘤引起淋巴阻塞,但阻碍胸腔积液的吸收并不是导致MPE形成的唯一原因。最近研究[8]认为:MPE的产生是一个繁杂的生物学反应,是在胸膜微环境中肿瘤细胞与宿主脉管系统和免疫系统相互作用的结果。TPE主要见于结核性胸膜炎,其病理学特点是机体对胸膜腔内抗原及结核分枝杆菌的高敏性T细胞介导的反应。结核分枝杆菌感染机体后促使间质细胞、成纤维细胞大量释放IL-33等细胞因子,激发Th2免疫应答反应而分泌各种细胞因子,集中多种免疫细胞如淋巴细胞、巨噬细胞和单核细胞等到结核分枝杆菌侵入部位,逐渐形成结核肉芽肿,抑制结核分枝杆菌的扩散并杀灭结核分枝杆菌。
IL-33是一种新型的属于白细胞介素1(IL-1)家族的细胞因子[9],可表达于上皮细胞、内皮细胞及感染期的组织基质细胞和骨髓细胞。ST2可表达于多种免疫细胞,其在感染或损伤时通过增进Th2型细胞因子的释放发挥生物学作用。本研究结果显示:TPE患者胸腔积液中IL-33表达水平明显高于其相应血清水平,IL-33可能参加了结核性胸膜炎的结核病免疫和迟发性变态反应;MPE患者胸腔积液中IL-33表达水平明显低于其相应血清水平,且低于TPE患者,但MPE患者胸水中sST2水平明显高于TPE患者。目前对IL-33/sST2轴的肿瘤免疫作用研究尚存在争议。本文作者推测:IL-33可能通过调节CD8+T、NK、NKT、Th1和Th2等免疫细胞进而影响肿瘤的生长、转移及预后等病理过程。有研究者[10]通过小鼠转基因技术发现:小鼠转移性Lewis肺癌和B16黑色素瘤模型中IL-33可抑制肿瘤生长和转移。IL-33的2种亚型在Tc1荷瘤小鼠实验中诱发记忆CD8+T细胞,同时伴随肿瘤细胞的完全消退[11]。sST2在乳腺癌基因敲除小鼠模型中可减慢肿瘤的生长、血管形成及转移[12]。上述数据支持IL-33/sST2轴可能具有增强肿瘤监测、减轻抗肿瘤免疫及肿瘤进展的作用。同时IL-33亦有着相悖的生物作用,研究[13]显示:IL-33可能通过增加肿瘤内免疫抑制性细胞的数量和遏制固有抗肿瘤免疫作用而促使乳腺癌的发展和转移。研究[14]显示:IL-33促进胃癌细胞的侵袭及转移,且通过敲除ST2基因可抑制IL-33对胃癌细胞的促进作用。总之,IL-33/sST2轴在肿瘤逃逸和肿瘤血管生长中可能起着双重作用,即通过激发NK细胞、CD8+T细胞的免疫活性和增加其数量进一步促进细胞因子分泌,负向调节肿瘤细胞的发生发展;又通过增加瘤内免疫抑制性细胞数量促进肿瘤细胞的生长和增殖、转移,以及促进血管的生长[15]。本研究中,MPE患者胸腔积液中IL-33表达水平较低而sST2表达水平较高考虑可能与其对肿瘤有双重调控作用有关。
本研究中IL-33的相关性分析结果显示:MPE和TPE患者胸腔积液和血清中IL-33表达水平均呈正相关关系,提示IL-33参与恶性和结核性胸腔积液的产生。
本研究中ROC曲线结果显示:胸腔积液中IL-33表达水平对TPE的最佳诊断阈值为17.08 ng·L-1,灵敏度和特异度分别为96.7%和92.9%,提示胸腔积液中IL-33表达水平对于鉴别TPE和MPE有重要的诊断价值;ROC曲线结果显示:采用胸腔积液中sST2表达水平鉴别TPE和MPE的灵敏度和特异度均不高,但sST2/IL-33比值在鉴别二者时具有诊断价值,其对MPE的最佳诊断阈值为15.06,灵敏度和特异度分别为96.8%和95.5%,且联合胸腔积液中CEA表达水平检测对MPE的诊断敏感度明显增高。
肿瘤微环境中Th2型细胞因子和ST2L占据优势状态,IL-33/sST2信号通路可能作用于肿瘤微环境中的各种成分,启动下游信号通路的NF-κB等,促进Th2型细胞因子释放[16],并共同维持着肿瘤微环境中Th2的优势状态。逆转Th2优势对增进机体免疫、抑制肿瘤具有重要意义[17]。IL-33作为新发现的IL-1家族新成员,其在血清中的表达水平与许多肿瘤的发展阶段相关[18]。sST2负向调节IL-33/sST2信号轴,抗IL-33抗体或sST2可有效地阻遏IL-33/sST2轴信号通路。IL-33/sST2信号通路也可能通过与肿瘤微环境中免疫细胞相互作用而增强机体的抗肿瘤免疫,并延长患者的生存期。目前IL-33/sST2轴在肿瘤及结核免疫学机制方面的作用尚不明确,深入研究肿瘤微环境中的细胞分化调节可为Th1/Th2免疫应答中如何平衡IL-33/sST2提供依据,为肿瘤治疗提供新的靶点和途径。另外,进一步研究肺结核病程中IL-33/sST2信号轴的变化及其作用机制可能为结核病的鉴别诊断、病情监测及治疗提供新的思路。
| [1] | Heffner JE, Nietert PJ, Barbieri C. Pleural fluid pH as a predictor of survival for patients with malignant pleural effusions[J]. Chest, 2000, 117(1): 79–86. DOI:10.1378/chest.117.1.79 |
| [2] | 周全, 吴熊焰, 刘炳亚, 等. IL-33及其受体与肿瘤发生、发展关联性的研究进展[J]. 外科理论与实践, 2013, 18(6): 581–585. |
| [3] | Hooper CE, Lee YC, Maskell NA. Interferon-gamma release assays for the diagnosis of TB pleural effusions:hype or real hope[J]. Curr Opin Pulm Med, 2009, 15(4): 358–365. DOI:10.1097/MCP.0b013e32832bcc4e |
| [4] | Seiscento M, Vargas FS, Acencio MM, et al. Pleural fluid cytokines correlate with tissue inflammatory expression in tuberculosis[J]. Int J Tuberc Lung Dis, 2010, 14(9): 1153–1158. |
| [5] | Blom L, Poulsen LK. IL-1 family members IL-18 and IL-33 upregulate the inflammatory potential of differentiated human Th1 and Th2 cultures[J]. J Immunol, 2012, 189(9): 4331–4337. DOI:10.4049/jimmunol.1103685 |
| [6] | Masamune A, Watanabe T, Kikuta K, et al. Nuclear expression of interleukin-33 in pancreatic stellate cells[J]. Am J Physiol Gastrointest Liver Physiol, 2010, 299(4): G821–G832. DOI:10.1152/ajpgi.00178.2010 |
| [7] | Wu YB, Ye ZJ, Qin SM, et al. Combined detections of interleukin 27, interferon-γ, and adenosine deaminase in pleural effusion for diagnosis of tuberculous pleurisy[J]. Chin Med J, 2013, 126(17): 3215–3221. |
| [8] | Stathopoulos GT, Kalomenidis I. Malignant pleural effusion:tumor-host interactions unleashed[J]. Am J RespirCrit Care Med, 2012, 186(6): 487–492. DOI:10.1164/rccm.201203-0465PP |
| [9] | Liew FY, Pitman NI, McInnes IB. Disease-associated functions of IL-33:the new kid in the IL-1 family[J]. Nat Rev Immunol, 2010, 10(2): 103–110. DOI:10.1038/nri2692 |
| [10] | Gao K, Li X, Zhang L, et al. Transgenic expression of IL-33 activates CD8(+) T cells and NK cells and inhibits tumor growth and metastasisin mice[J]. Cancer Lett, 2013, 335(2): 463–471. DOI:10.1016/j.canlet.2013.03.002 |
| [11] | Villarreal DO, Wise MC, Walters JN, et al. Alarmin IL-33 acts as an immuneadjuvant to enhance antigen-specific tumor immunity[J]. Cancer Res, 2014, 74(6): 1789–1800. DOI:10.1158/0008-5472.CAN-13-2729 |
| [12] | Guo L, Junttila IS, Paul WE. Cytokine-induced cytokine production by conventional and innate lymphoid cells[J]. Trends Immunol, 2012, 33(12): 598–606. DOI:10.1016/j.it.2012.07.006 |
| [13] | Jovanovic IP, Pejnovic NN, Radosavljevic GD, et al. Interleukin-33/ST2 axis promotes breast cancer growth and metastases by facilitating intratumoral accumulation of immunosuppressive and innate lymphoid cells[J]. Int J Cancer, 2014, 134(7): 1669–1682. DOI:10.1002/ijc.v134.7 |
| [14] | Yu XX, Hu Z, Shen X, et al. IL-33 promotes gastric cancer cell invasion and migration via ST2-ERK1/2 pathway[J]. Dig Dis Sci, 2015, 60(5): 1265–1272. DOI:10.1007/s10620-014-3463-1 |
| [15] | 邓旭, 卢斌峰, 蒋敬庭. IL-33及其受体ST2在抗病毒和抗肿瘤免疫应答中的意义[J]. 临床检验杂志, 2015, 33(2): 130–133. |
| [16] | 李苑博, 张继红, 符爽, 等. IL-33在肿瘤中作用的研究进展[J]. 现代肿瘤医学, 2016, 24(5): 843–847. |
| [17] | 明浩, 李翀, 蒋敬庭. IL-33呼吸系统疾病中的作用机制与意义[J]. 现代免疫学, 2015, 35(5): 437–440. |
| [18] | Chen XJ, Huang YD, Li N, et al. Correlations between serum IL33 and tumor development:a meta-analysis[J]. Asian Pac JCancer Prev, 2014, 15(8): 3503–3505. DOI:10.7314/APJCP.2014.15.8.3503 |
 2017, Vol. 43
2017, Vol. 43


