扩展功能
文章信息
- 马春虎, 程露阳, 刘镭, 许亚娜, 赵恩宏, 刘承一, 王立新, 夏爱华, 敬鑫垚, 刘兴华
- MA Chunhu, CHENG Luyang, LIU Lei, XU Yana, Zhao Enhong, LIU Chengyi, WANG Lixin, XIA Aihua, JING Xinyao, LIU Xinghua
- 外周血癌细胞中多种肿瘤标记物基因检测预测乳腺癌患者转移和预后的意义
- Significance of detection of multiple marker genes in cancer cells in peripheral blood in predication of metastases and prognosis of breast cancer patients
- 吉林大学学报(医学版), 2017, 43(01): 85-90
- Journal of Jilin University (Medicine Edition), 2017, 43(01): 85-90
- 10.13481/j.1671-587x.20170117
-
文章历史
- 收稿日期: 2016-09-27
2. 承德医学院基础医学院免疫学教研室, 河北 承德 067000;
3. 河北省承德市妇幼保健院妇幼产房, 河北 承德 067000;
4. 承德医学院附属医院肿瘤科, 河北 承德 067000
2. Department of Immunology, School of Basic Medical Sciences, Chengde Medical College, Chengde 067000, China;
3. Maternal and Child Delivery Room, Chengde Maternal and Child Health-Care Hospital, Chengde 067000, China;
4. Department of Oncology, Affiliated Hospital, Chengde Medical College, Chengde 067000, China
乳腺癌是全世界范围内第二大恶性肿瘤,也是女性最常见的恶性疾病之一。虽然目前依据美国癌症联合委员会(AJCC) TNM分期标准来对乳腺癌进行临床分期和预后评价[1],但仍有约30%的淋巴结阴性转移的患者最终出现了转移或复发[2]。这是由于应用目前检测手段无法发现的潜在肿瘤细胞已经随着淋巴循环或血循环途径发生了远处转移[3]。因此, 发现可靠的外周血肿瘤标记物对准确预测早期乳腺癌的转移、补充临床分期方法和判断预后均具有重要意义。
由于乳腺癌具有高异质性以及肿瘤细胞在宿主压力下不断发生基因突变,单一的肿瘤标记物不能持续、特异地表达于所有的乳腺癌肿瘤细胞。应用肿瘤标记物CK19检测乳腺癌外周血时的阳性率仅为43.9%[4],而联合多种肿瘤标记物进行检测能够极大地提高其诊断的阳性率和特异性。另外,外周血中的循环癌细胞数目极少,目前巢式PCR是最敏感的方法,能够在1×107个细胞中检测到1个癌细胞,相当于在10mL血中有4个肿瘤细胞就能检测到[5-6]。本研究通过肿瘤基因组解剖计划(CGAP)提供的SAGE (Serial Analysis of Gene Expression)数据库鉴定了一组可用于检测乳腺癌外周血的肿瘤标记物基因[7],应用定量巢式PCR方法检测该组基因在乳腺癌外周血中的表达水平,在国内首次建立了计算相对循环癌细胞数(relative cancer cell load, Lc)公式,并分析Lc值与乳腺癌临床分期、转移和预后的关联。
1 资料与方法 1.1 临床资料收集2009年11月-2013年12月在承德医学院附属医院肿瘤科和承德市妇幼保健院住院的病历资料完整的乳腺癌患者外周血标本142例,均为女性,年龄21~82岁,中位年龄52岁。抽血前均未接受化学治疗和放射治疗。所有患者均行手术治疗,手术后均经病理确诊。其中浸润性导管癌98例,单纯癌7例,湿疹样癌5例,髓样癌19例,浸润性小叶癌13例;伴有远处转移21例;Ⅰ和Ⅱ期乳腺癌患者89例,Ⅲ和Ⅳ期乳腺癌患者53例;雌激素受体(ER)阳性101例,孕激素受体(PR)阳性89例,人类表皮生长因子受体2(HER2)阳性50例。正常对照组60人, 均为女性,年龄22~76岁,中位年龄49岁,经胸片和B超检查未发现乳腺相关性疾病。
1.2 候选肿瘤标记物基因筛选利用CGAP提供的SAGE Genie数据库(http://cgap.nci.nih.gov/SAGE),选取数字基因表达演示(DGED)工具。选择乳腺癌组织和正常白细胞2个池,设置F值为16,即表达差异大于16倍以上,即P=0.01。差异表达的基因按差异显著性高低排序,比对出在短序列标签文库和长序列标签文库中都出现的差异基因,作为候选基因。
1.3 总RNA提取和cDNA合成将3~5mL外周血置于淋巴细胞分离液上,密度梯度离心法分离单个核淋巴细胞。细胞计数后,按1×106mL-1在1.5 mL Eppendorf管中加入适量TRIzol试剂,提取总RNA。分光光度法测定纯度后取5 μgRNA,按逆转录试剂盒(QIAGEN)操作步骤进行逆转录,获得cDNA。
1.4 半定量巢式PCR法检测乳腺癌外周血癌细胞第1轮PCR反应体系:2.5 μL外周血的cDNA模板,0.2 μmol·L-1外侧引物(引物序列见表 1),0.2 mmol·L-1 dNTP,50 mmol·L-1Tris-HCl (pH 8.3),10 mmol·L-1 KCl,5 mmol·L-1 (NH4)2SO4,2 mmol·L-1 MgCl2,0.75 U Taq polymerase,总体积为25 μL。反应条件:94℃变性20s,62℃退火20s,72℃延伸40s,35个循环后,再72℃延伸10min。取2 μL第1轮PCR的产物作为第2轮的模板,20μL PCR反应体系:0.25 μmol·L-1内侧引物,SYBR Green PCR master mix (上海基康生物技术有限公司)。反应条件:94℃变性4min;94℃、15s, 58℃、30s,72℃、35s,共40个循环扩增。GAPDH为内参照,每个样本的每个待测项目均检测3次, 取平均值。记录各样品的Ct值,并计算各组目的基因的相对表达水平。计算公式为:标记物基因的ΔCt=标记物基因的Ct-GAPDH的Ct;ΔΔCt=肿瘤的ΔCt -正常对照的ΔCt;肿瘤标记物基因的相对表达水平Q=2-ΔΔCt。由于标记基因的转录量的不同, 本研究首先标准化了每个标记物基因的差异表达。为计算Lc值,应用一种半定量的方法将几种肿瘤标记物的表达率相加。标准化差异表达率公式:Eij=(Qij-Qj平均值)/σj,Qij代表某患者在表达某个肿瘤标记物时的相对表达水平,Qj平均值代表某个肿瘤标记物基因相对表达水平的平均值,σj代表142例乳腺癌患者表达某一基因时表达率的标准差。某一患者的
| Marker gene | Primer sequence |
| FAM83A | Outer_F 5′-CGCCACTGTGTACTTCCAGACCGTCAAGC-3′ |
| Outer_R5′-CCTCGGCGGTTCTGCTCATGCTCCACTC-3′ | |
| Inner_F5′-GTGGGGTGTTCGTTTGTG-3′ | |
| Inner_R5′-GCTTGGAGGAGGCGTAG-3′ | |
| NPY1R | Outer_F 5′-GCGTTCCAAAATGTAACACTTGATGCGTACA-3′ |
| Outer_R 5′-CATCTGTGTGCATCGTGGACATGGCTATTGT-3′ | |
| Inner_F 5′-CACTCTTCTCTTGGTGCTG-3′ | |
| Inner_R 5′-GTTTTTGTTCAGGAACCCA-3′ | |
| KRT19 | Outer_F5′-AAGCTAACCATGCAGAACCTCAACGACCGC-3′ |
| Outer_R5′-TTTTATTGGCAGGTCAGGAGAAGAGCC-3′ | |
| Inner_F5′-CAGCCACTACTACACGACC-3′ | |
| Inner_R5′-ACCTCATATTGGCTTCGCA-3′ | |
| GAPDH | F5′-ACCACAGTCCATGCCATC-3′ |
| R5′-TCCACCACCCTGTTGCTGTA-3′ |
对142例乳腺癌患者进行了平均38个月的跟踪随访,随访患者每3~6个月复查1次,包括胸片和腹部B超等。
1.6 统计学分析采用SPSS 16.0统计学软件包进行统计分析。肿瘤标记物表达水平和Lc值以x±s表示,组间均数比较采用t检验或方差分析。绘制Kaplan-Meier生存曲线,采用Log-rank计算Lc值大于2的乳腺癌患者组和Lc值小于2的乳腺癌患者组生存时间的差异。
2 结果 2.1 乳腺癌患者外周血中高表达基因的鉴定在SAGE文库中,比对出在10bp的短标签文库(short tags)和17 bp的长标签文库(long tags)中共同出现的基因,最终筛选出23个在乳腺癌中高表达的基因。采用巢式PCR方法在43例乳腺癌和20名正常对照组研究对象外周血中进行验证,最终筛选出一组可用于检测外周血的肿瘤标记物基因:FAM83A (NM_032899.4)、NPY1R (NM_000909.5)和KRT19(NM_002276)。其中,NPY1R在43例乳腺癌外周血标本中有14例阳性表达,而FAM83A有16例阳性表达,但在正常对照组研究对象外周血中无阳性表达;KRT19在乳腺癌中有21例阳性表达,而在正常对组研究对象中有1例阳性表达。
2.2 各组研究对象3种肿瘤标记物表达水平和阳性表达率乳腺癌组患者外周血中FAM83A mRNA、NPY1R mRNA和KRT19 mRNA表达水平明显高于正常对照组(P<0.001)(表 2)。本研究设定特异性为100%的界限值,FAM83A、NPY1R和KRT19在乳腺癌外周血中的阳性表达率分别为33.1%(47/142)、38.7%(55/142)和43.7%(62/142);在142例乳腺癌患者中至少表达FAM83A、NPY1R和KRT19中一种肿瘤标记物的患者有113例,阳性表达率高达79.6%,随着肿瘤标记物数目的增加,阳性表达率也明显增加。
| (n=3, x±s) | |||
| Group | FAM83A | NPY1R | KRT19 |
| Normal control | -8.31±1.92 | -8.21±2.91 | -7.41±2.43 |
| Breast cancer | -4.68±3.11 | -3.93±3.53 | -2.91±4.20 |
| P | <0.001 | <0.001 | <0.001 |
142例乳腺癌患者的平均Lc值为2.30±1.84。临床Ⅲ和Ⅳ期乳腺癌患者的Lc值明显高于临床Ⅰ和Ⅱ期患者(P<0.001),发生远处转移的乳腺癌患者Lc值明显高于未发生远处转移的患者(P<0.001),说明在外周血中检测该组肿瘤标记物的表达可用于预测乳腺癌的转移。Lc值与肿瘤大小、病理类型及ER、PgR、HER2/neu状态或患者年龄无关联(P>0.05)。见表 3。另外,本研究还发现肿瘤标记物NPY1R在ER、PR或HER2/neu阳性患者组中的表达率分别为43.6%(44/101)、44.9%(40/89)和50.0%(25/50),明显高于ER、PR或HER2/neu阴性患者[26.8%(11/41)、28.3%(15/53)和32.6%(30/92)](P<0.05)。
| (n=3, x±s) | |||
| Clinicopathologic characteristic | n | Lc | P |
| Age (year) | |||
| < 50 | 56 | 2.18±0.63 | 0.089 |
| ≥50 | 86 | 2.78±0.45 | |
| Pathology | |||
| Invasive ductal carcinoma | 98 | 2.18±0.43 | |
| Simple cancer | 7 | 2.24±0.36 | |
| Eczematous cancer | 5 | 2.48±0.78 | 0.147 |
| Medullary carcinoma | 19 | 2.41±0.89 | |
| Invasive lobular carcinoma | 13 | 2.28±0.56 | |
| Tumor size | |||
| ≤2cm | 75 | 2.29±0.26 | 0.062 |
| > 2cm | 67 | 2.81±0.45 | |
| Clinical stage | |||
| Ⅰ, Ⅱ | 89 | 1.48±0.83 | <0.001 |
| Ⅲ,Ⅳ | 53 | 3.72±2.23 | |
| Distant metastases | |||
| No | 121 | 1.71±0.82 | <0.001 |
| Yes | 21 | 5.54±2.44 | |
| Estrogen receptor status | |||
| Positive | 101 | 2.49±0.51 | 0.074 |
| Negative | 41 | 2.27±0.46 | |
| Progesterone receptor status | |||
| Positive | 89 | 2.79±0.16 | 0.102 |
| Negative | 53 | 2.49±0.65 | |
| HER-2/neu receptor status | |||
| Positive | 50 | 2.74±0.61 | 0.110 |
| Negative | 92 | 2.55±0.56 | |
对142例接受手术治疗的乳腺癌患者进行了平均38个月的随访,随访期间死亡36例(25.4%),生存106例(74.6%),无复发生存67例(47.2%),生存时间大于3年的乳腺癌患者平均Lc值为2.84,而生存时间小于3年的乳腺癌患者平均Lc值为1.88。因此,以Lc=2作为界线将患者分为2组,Lc值大于2组的乳腺癌患者87例,其中死亡30例;Lc值小于2组的乳腺癌患者55例,其中死亡6例。通过分析Kaplan-Meier生存曲线,Log-rank计算结果证实:Lc值小于2组乳腺癌患者的生存时间明显长于Lc值大于2组乳腺癌患者(P=0.005)。见图 1。
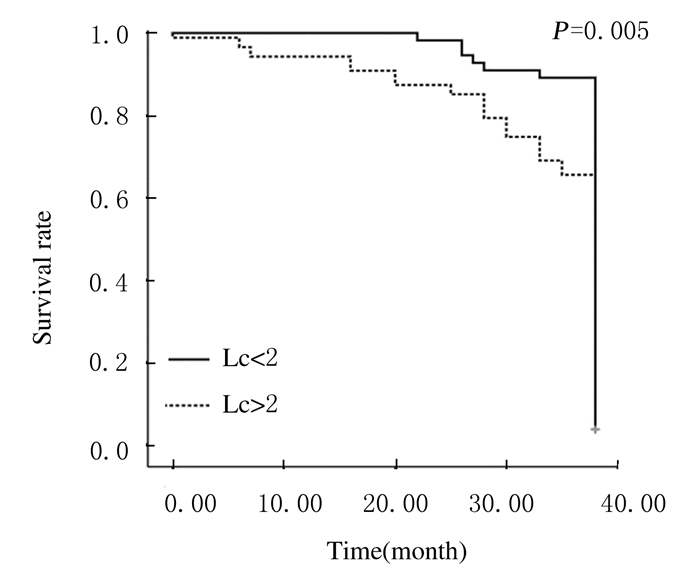
|
| 图 1 不同Lc值乳腺癌患者的生存曲线 Figure 1 Survival curves of breast cancer patients with different Lc values |
|
|
检测癌症患者血液循环中的肿瘤细胞已经成为癌症诊断和监测预后的有力工具[8]。本研究基于芯片分析结果筛选了一组能够检测乳腺癌患者外周血癌细胞的标记物,结果表明:采用SAGE Genie数据库中的数字基因表达演示(DGED)工具在2个库中筛选差异表达基因具有明显的优势,但是要求数据库中目的基因的表达序列标签数目要充分[9]。基因表达系列分析通过快速及详细地分析成千上万个表达序列标签(express sequenced tags,EST),进而寻找表达丰度不同的SAGE标签序列,最终发现新的未知的序列。通过分析SAGE数据库网站能够分析一个基因的SAGE标签表达水平。SAGE技术对于寻找新的肿瘤特异性或相关性表达基因、详细分析肿瘤基因的表达谱、发现肿瘤标志物,以及研究肿瘤发病的分子机制都具有重要的作用[10]。
由于不同患者的个体差异和肿瘤标志物在不同肿瘤病灶表达的异质性,限制了单个肿瘤标志物检测的能力。Pantel[11]研究证实:在乳腺癌患者外周血中同时检测多个肿瘤标志物是更加可靠的方法,联合检测β-人绒毛膜促性腺激素(HCG-β)、癌基因受体(c-Met)、β1乙酰氨基半乳糖基转移酶和黑色素瘤相关抗原A3(MAGE-A3)时,正常人外周血中均未被检测到,而乳腺癌细胞系和原发性乳腺癌组织能够表达这几种标记物;该研究对65例乳腺癌患者的血液标本进行了评估,在20%乳腺癌患者外周血中至少有2种肿瘤标志物表达,32%的乳腺癌患者外周血中有4种肿瘤标记物表达,为了寻找检测乳腺癌外周血循环癌细胞的肿瘤标记物,本研究在SAGE文库中选择了乳腺癌组织和正常白细胞2个池,在17 bp的长标签文库和10bp的短标签文库中共同出现的基因中最终筛选出23个在乳腺癌中高表达的差异基因。
差异表达基因能否作为用于诊断和预后的肿瘤标记物还需要RT-PCR实验进一步证实。本研究鉴定了一组新的能够用于检测乳腺癌外周血癌细胞的肿瘤标记物基因(FAM83A、NPY1R和KRT19) [12-14], 这3种肿瘤标志物均具有在乳腺癌组织中高表达、但在正常外周血细胞中不表达或低表达的特点。KRT19高表达于上皮细胞,而FAM83A是一个相对较新的肿瘤标志物,本课题组曾在前期的研究中鉴定了该基因的表达谱,结果表明:FAM83A mRNA在40例乳腺癌标本中有21例表达(52.5%),50例乳腺癌标本中有24例表达(48.0%),12例直肠癌中4例表达(33.3%),10例胃癌中3例表达(33.3%),但在正常组织(n=16)中均为阴性表达。
NPY1R是最早被克隆和鉴定的神经肽Y (NPY)受体。最新研究[15]证实:85%的原发性乳腺癌表达Y1亚型受体,而正常乳腺组织则表达Y2亚型。神经肽Y主要由下丘脑合成,经过垂体门脉系统最终到达垂体,参与调控包括促性腺激素(FSH/LH)、生长激素(GH)和泌乳素(PRL)等垂体激素的合成及分泌[16]。雌激素、孕激素、NPY及其受体的关系能够用来解释雌、孕激素、促黄体酮激素的增加与NPY水平变化的协同作用。逆转录PCR实验[17]证实:经雌激素处理的大鼠下丘脑Y1R mRNA水平增加,雌激素的增加能够上调Y1R的表达,反过来Y1R也能调控雌激素诱导的乳腺癌细胞的增殖。本研究结果也显示:乳腺癌患者外周血中NPY1R的表达水平与雌激素和孕激素有关联,ER和PR阳性表达患者NPY1R mRNA表达水平明显高于ER和PR阴性表达患者;结果提示:NPY1R在乳腺癌中可能是通过雌激素、孕激素介导的信号传导通路而发挥作用的,但其具体作用机制还有待进一步探讨。
本研究结果显示:单独使用肿瘤标志物NPY1R对乳腺癌外周血进行检测时,并不比其他已知的肿瘤标志物检测阳性率高,但NPY1R在乳腺癌细胞中的表达显示出与其他肿瘤标志物的显著互补性。因此,联合NPY1R对乳腺癌患者外周血癌细胞进行检测能显著提高诊断阳性率。本研究结果显示:FAM83A和KRT19联合检测的敏感性为62.0%,而当结合了NPY1R时,阳性表达率增加到79.6%。另外,在增加了阳性率的同时并未增加检测的假阳性率。本研究应用定量巢式PCR方法检测了乳腺癌患者的循环癌细胞中肿瘤标记物基因FAM83A、NPY1R和KRT19的表达,通过公式计算乳腺癌患者外周血中Lc值,并证实了Lc值对预测乳腺癌患者转移和预后具有重要意义。
| [1] | Yang Y, Im SA, Kim TY, et al. Abstract P3-11-15:Different clinical usefulness of AJCC response criteria according to the subtypes in stage Ⅱ/Ⅲ breast cancer patients after neoadjuvant chemotherapy[J]. Cancer Res, 2015, 75(9): 11–15. |
| [2] | Wolmark N, Mamounas EP, Baehner FL, et al. Prognostic impact of the combination of recurrence score and quantitative estrogen receptor expression (ESR1) on predicting late distant recurrence risk in estrogen receptor-positive breast cancer after 5 years of tamoxifen:results from NRG Oncology/National Surgical Adjuvant Breast and Bowel project B-28 and B-14[J]. J Clin Oncol, 2016, 34(20): 2350–2358. DOI:10.1200/JCO.2015.62.6630 |
| [3] | Khoja L, Lorigan P, Dive C, et al. Circulating tumour cells as tumour biomarkers in melanoma:detection methods and clinical relevance[J]. Ann Oncol, 2015, 26(1): 33–39. DOI:10.1093/annonc/mdu207 |
| [4] | Zhao S, Yang H, Zhang M, et al. Circulating tumor cells (CTCs) detected by triple-marker EpCAM, CK19, and hMAM RT-PCR and their relation to clinical outcome in metastatic breast cancer patients[J]. Cell Biochem Biophys, 2013, 65(2): 263–273. DOI:10.1007/s12013-012-9426-2 |
| [5] | Yamamoto H, Murata K, Fukunaga M, et al. Micrometastasis volume in lymph nodes determines disease recurrence rate of stage Ⅱ colorectal cancer:a prospective multicenter trial[J]. Clin Cancer Res, 2016, 22(13): 3201–3208. DOI:10.1158/1078-0432.CCR-15-2199 |
| [6] | Ma LX, Cai QY, Yu P, et al. Specific detection of circulating tumor cells in peripheral blood by targeting gastrin releasing peptide receptors[J]. J Nucl Med, 2016, 57(9): 1220. |
| [7] | Chia NY, Tan P. Molecular classification of gastric cancer[J]. Ann Oncol, 2016, 27(5): 763–769. DOI:10.1093/annonc/mdw040 |
| [8] | Sargent DJ, Shi Q, Gill S, et al. Molecular testing for lymph node metastases as a determinant of colon cancer recurrence:results from a retrospective multicenter study[J]. Clin Cancer Res, 2014, 20(16): 4361–4369. DOI:10.1158/1078-0432.CCR-13-2659 |
| [9] | McCall MN, Almudevar A. Affymetrix GeneChip microarray preprocessing for multivariate analyses[J]. Brief Bioinform, 2012, 13(5): 536–546. DOI:10.1093/bib/bbr072 |
| [10] | Ting SL, Kwok SK, Tsang AHC, et al. The study on using passive RFID tags for indoor positioning[J]. Int J Engineer Business Manag, 2011, 3(1): 9–15. |
| [11] | Pantel K. Detection, clinical relevance and specific biological properties of disseminating cancer cells in breast cancer patients[J]. Cancer Res, 2009, 69(2): 233–240. |
| [12] | Qu YM, Liao GQ, Liu PH, et al. Clinical significance of expressions of tumor markers in peripheral blood in non-small cell lung cancer[J]. Zhonghua Yi Xue Za Zhi, 2010, 90(28): 1958–1962. |
| [13] | Liu L, Ma C, Xu Q, et al. A rapid nested polymerase chain reaction method to detect circulating cancer cells in breast cancer patients using multiple marker genes[J]. Oncol Lett, 2014, 7(6): 2192–2198. |
| [14] | Liu L, Xu Q, Cheng L, et al. NPY1R is a novel peripheral blood marker predictive of metastasis and prognosis in breast cancer patients[J]. Oncol Lett, 2015, 9(2): 891–896. |
| [15] | Ait-Mohand S, Dumulon-Perreault V, Benard F, et al. Design optimization of a new 64Cu/NOTA truncated NPY analog with improved stability and Y1 affinity, the first step toward successful breast cancer PET Imaging[J]. J Nucl Med, 2016, 57(suppl 2): 1076. |
| [16] | Shi ZG, Brooks VL. Select inhibition of arcuate NPY/AgRP neurons increases arterial pressure and sympathetic nerve activity in mice[J]. FASEB J, 2016, 30(suppl 1): 1235–1236. |
| [17] | Spencer B, Potkar R, Metcalf J, et al. Systemic central nervous system (CNS)-targeted delivery of neuropeptide Y (NPY) reduces neurodegeneration and increases neural precursor cell proliferation in a mouse model of Alzheimer disease[J]. J Biol Chem, 2016, 291(4): 1905–1920. DOI:10.1074/jbc.M115.678185 |
 2017, Vol. 43
2017, Vol. 43


