扩展功能
文章信息
- 孙迪, 王琪, 陈怀基, 许峰, 张月竹, 张天融, 刘洪泊, 叶琳
- SUN Di, WANG Qi, CHEN Haiji, XU Feng, ZHANG Yuezhu, ZHANG Tianrong, LIU Hongbo, YE Lin
- 塑化剂DEHP暴露人群血清甲状腺激素水平变化的Meta分析
- Changes of serum thyroid hormone levels in DEHP exposure population: A Meta-analysis
- 吉林大学学报(医学版), 2017, 43(01): 66-72
- Journal of Jilin University (Medicine Edition), 2017, 43(01): 66-72
- 10.13481/j.1671-587x.20170114
-
文章历史
- 收稿日期: 2016-09-26
邻苯二甲酸二乙基己基酯(di-2-ethylhexyl phthalate,DEHP)是邻苯二甲酸脂类(phthalic acid esters,PAEs)中的一种,作为塑化剂被广泛应用于各种塑料制品中,如医药制品、生活用品、食品包装、玩具和涂料等的生产[1-4]。DEHP与材料分子并非通过化学键结合,因此易从塑料制品中解离并迁移至外界环境[5],环境中的DEHP进入人体后可在肠道内水解为邻苯二甲酸单乙基己基酯(mono-2-ethylhexyl phthalate,MEHP),MEHP吸收入血后随尿液排出,因此常作为DEHP暴露的生物标记物。人群流行病学和毒理学研究[6-13]显示:DEHP作为一种环境内分泌干扰物(environmental endocrine disruptors,EEDs),具有生殖毒性、免疫毒性、胚胎毒性、肝脏毒性及致癌性等多种毒性作用,还可对人体脂代谢和糖代谢产生不良影响,并具有引起甲状腺激素代谢改变的类雌激素活性。甲状腺激素在许多生理过程中起着至关重要的作用,越来越多的证据显示DEHP暴露与甲状腺相关疾病的发生密切相关。目前已有多篇关于DEHP暴露对血清甲状腺激素水平影响的人群流行病学研究报道,但大多样本量较小,观察的结局指标不尽一致,且都是单个研究,并未见系统综述或Meta分析,结论尚具争议。Boas等[14]和Tsai等[15]检测青少年尿中MEHP和血清甲状腺激素水平的结果显示:DEHP暴露与血清甲状腺激素水平呈负相关关系。Johns等[16]检测439例孕妇尿MEHP和血清甲状腺激素结果显示:DEHP暴露可使血清促甲状腺激素(thyroid stimulating hormone,TSH)水平下降,四碘甲状腺原氨酸(thyroxine,T4)和游离四碘甲状腺原氨酸(free thyroxine,FT4)水平升高。
本文作者通过对目前公开发表的关于人群DEHP及其代谢产物MEHP水平与血清甲状腺相关激素水平关系的中文和英文文献进行Meta分析,以明确DEHP暴露与甲状腺激素水平的关系,为探索甲状腺疾病的发病原因以及确定塑化剂的暴露标准提供科学依据。
1 资料与方法 1.1 检索策略计算机检索PubMed、EMbase、中文期刊全文数据库(CNKI)、万方数据库和维普数据库。采用主题词、关键词进行检索,检索时间为建库至2016年7月1日之前。中文检索词:塑化剂、邻苯二甲酸酯、邻苯二甲酸二乙基己基酯、邻苯二甲酸单乙基己基酯和甲状腺激素。英文检索词:phthalic acid esters/phthalate、Di-(2-ethylhexyl) phthalate、mono-2-ethylhexyl phthalate、thyroid hormone。同时手工二次检索纳入文献的参考文献,以及会议、学术论文等。查找收集国内外发表的关于DEHP暴露及其代谢产物MEHP水平与人血清甲状腺相关激素水平关系的中文和英文文献。
1.2 文献纳入与排除标准纳入标准:①2016年7月1日之前公开发表的所有评价DEHP对甲状腺影响的人群流行病学队列研究、横断面研究和病例对照研究,语言为中文或英文。②年龄、性别、人群和种族不限的一般人群。③结局评价指标为DEHP暴露水平(尿MEHP水平),血清TSH、T4、FT4和三碘甲状腺原氨酸(triiodothyronin,T3)水平。④多个研究若采用同一人群,只纳入样本量较大的结果;同一研究若采用不同人群,则分别纳入。
排除标准:①资料信息不全、数据不完整、综述性和重复发表的文献。②原始研究中统计学处理的数据在本研究无法转化和应用的文献。
1.3 文献筛选、资料提取和质量评价由2位研究者独立按照纳入与排除标准逐一筛选文献,提取相关信息,缺少的资料信息尽量与作者联系予以补充,并交叉核对。制定数据提取表提取资料,提取表内容主要包括研究题目、第一作者、发表时间、研究时间、研究地点、样本量、暴露水平、激素种类、OR值或RR值及其95%CI等,应用Excel软件建立数据库。采用纽卡斯尔-渥太华量表(Newcastle-Ottawa scale,NOS)[17]对纳入文献进行质量评价,包括3大块共8个条目,具体包括研究人群选择、可比性和结果评价,NOS对文献质量的评价采用了星级系统的半量化原则,满分为9颗星,0~3颗星为低质量文献,4~6颗星为中质量文献,7~9颗星为高质量文献。
1.4 统计学分析采用RevMan 5.2软件进行Meta分析。对纳入文献进行异质性检验,若P>0.05,文献无异质性,采用固定效应模型;反之采用随机效应模型。分析结果以DEHP暴露水平(尿MEHP水平)与血清甲状腺激素水平相关性的OR值及其95%可信区间(CI)为效应指标进行合并效应量,应用公式β=ln (OR)转化为效应值β。发表偏倚采用STATA12.0软件中Egger’s检验进行分析。检验水准为α=0.05。
2 结果 2.1 文献纳入情况根据检索策略共检索相关文献104篇,排除动物实验、综述和个案报道后14篇,通读全文后剔除数据不全或无法转化和应用的文献,最终纳入7篇[12, 15-16, 18-21],参文[21]为同一研究采用不同人群,故分别纳入。其中,高质量文献1篇[21],中质量文献6篇,涉及中国、日本和美国等多个国家和地区,累计样本量5692例。纳入文献基本情况及质量评价见表 1。
| Study | Year | Country | Population | Age | Design | Sample | MEHP level | Hormone | Hormone level | OR | 95%CI | Score |
| Minatoya, et al.[18] | 2016 | Japan | Female | >18 | Cohort study | 328 | 10.6(6.3, 17.1) | TSH | 2.20(1.40, 4.00) | 0.040 | 0.007-0.230 | 6 |
| FT4 | 2.03 (1.79, 2.29) | 0.020 | 0.006-0.070 | |||||||||
| Johns, et al.[16] | 2016 | USA | Female | >18 | Case-control study | 439 | 9.83(3.52) | TSH | 1.31 (1.71) | 5.310 | 2.780-10.160 | 5 |
| FT4 | 0.99 (0.49) | 4.150 | 1.880-9.160 | |||||||||
| T3 | 171.00 (41.60) | 0.280 | 0.042-1.850 | |||||||||
| T4 | 10.2 0(2.04) | 1.290 | 0.717-2.320 | |||||||||
| Yao, et al.[19] | 2016 | China | Female | >18 | Cohort study | 2 521 | NR | TSH | 8.40(6.06, 13.43) | 0.101 | 0.069-0.147 | 6 |
| FT4 | 1.23(1.14, 1.33) | 0.013 | 0.008-0.020 | |||||||||
| T3 | 50.78(44.92, 57.94) | 0.453 | 0.116-1.771 | |||||||||
| T4 | 8.12(7.30, 8.99) | 0.163 | 0.102-0.261 | |||||||||
| Tsai, et al.[15] | 2016 | China | NL | <18 | Cohort study | 240 | 4, 77(1.90, 9.78) | TSH | 2.29(1.57, 3.05) | 0.002 | 0.001-0.006 | 5 |
| T3 | 140.00(124.00, 158.00) | 0.010 | 0.002-0.069 | |||||||||
| T4 | 9.70(8.60, 10.80) | 0.001 | 0.000-0.003 | |||||||||
| Johns, et al.[20] | 2015 | USA | Female | >18 | Cohort study | 81 | NR | TSH | 1.13 (1.62) | 2.790 | 0.419-18.600 | 4 |
| FT4 | 1.39 (0.32) | 8.020 | 4.200-15.300 | |||||||||
| Meeker, et al.[21] | 2011 | USA | NL | ≥20 | Cohort study | 1 346 | NR | TSH | NR | 0.002 | 0.000-0.033 | 7 |
| FT4 | NR | 0.004 | 0.001-0.012 | |||||||||
| T3 | NR | 0.780 | 0.332-1.830 | |||||||||
| T4 | NR | 0.140 | 0.089-0.220 | |||||||||
| Meeker, et al.[21] | 2011 | USA | NL | <20 | Cohort study | 329 | NR | TSH | NR | 0.012 | 0.002-0.063 | 7 |
| FT4 | NR | 0.004 | 0.001-0.018 | |||||||||
| T3 | NR | 2.410 | 1.314-4.420 | |||||||||
| T4 | NR | 0.050 | 0.013-0.190 | |||||||||
| Meeker, et al.[12] | 2007 | USA | Male | ≥20 | Case-control study | 408 | 7.95(3.16, 21.3) | TSH | 1.43(1.04, 1.95) | 0.970 | 0.900-1.040 | 6 |
| FT4 | 1.20(1.08, 1.40) | 0.013 | 0.004-0.042 | |||||||||
| T3 | 96.00(83.00, 108.00) | 0.021 | 0.010-0.041 | |||||||||
| NL: No limitation of gender; NR: No report; MEHP levels and hormones levels by mean (standard deviation) or median (25th, 75th percenties); MEHP level: μg·L-1, TSH: mIU·L-1, FT4: μg·L-1, T3: ng·dL-1, T4: μg·dL-1. | ||||||||||||
共有7篇文献[12, 15-16, 18-21]报道了DEHP暴露与血清TSH水平的关系。异质性检验结果显示:文献间存在异质性(P<0.05,I2=98%),因此采用随机效应模型。人群尿MEHP水平与血清TSH水平关系的Meta分析结果显示:OR=0.10(95%CI:0.02~0.44;P=0.002),表明DEHP暴露水平升高1 μg·L-1,血清TSH水平降低10%。见图 1。
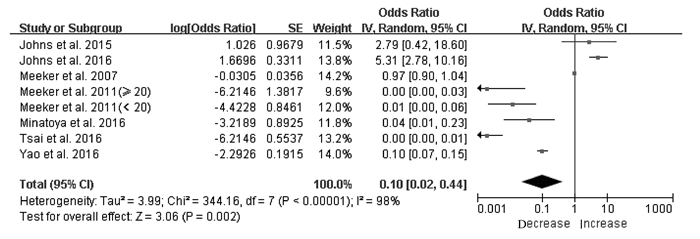
|
| 图 1 尿MEHP水平与血清TSH水平关系的森林图 Figure 1 Forest plot of association between urinary MEHP levels and serum TSH levels |
|
|
共有6篇文献[12, 16, 18-21]报道了DEHP暴露与血清FT4水平的关系。异质性检验结果显示:文献间存在异质性(P<0.05,I2=99%),因此采用随机效应模型。人群尿MEHP水平与血清FT4水平关系的Meta分析结果显示:OR=0.06(95%CI:0~0.79;P=0.03),表明DEHP暴露水平升高1 μg·L-1,血清FT4水平降低6%。见图 2。
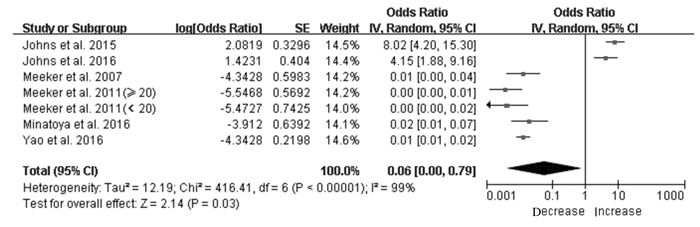
|
| 图 2 尿MEHP水平与血清FT4水平关系的森林图 Figure 2 Forest plot of association between urinary MEHP levels and serum FT4 levels |
|
|
共有5篇文献[12, 15-16, 19, 21]报道了DEHP暴露与血清T3水平的关系。异质性检验结果显示:文献间存在异质性(P<0.05,I2=96%),因此采用随机效应模型。人群尿MEHP水平与血清T3水平关系的Meta分析结果显示:OR=0.20(95%CI:0.03~1.45;P=0.11),表明DEHP暴露水平升高,对血清T3水平无明显影响。见图 3。
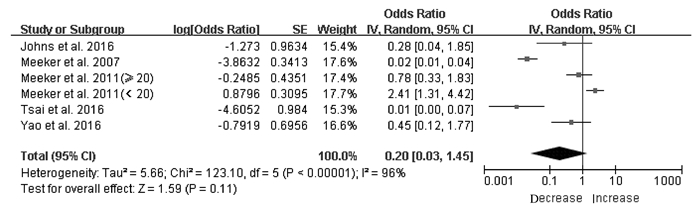
|
| 图 3 尿MEHP水平与血清T3水平关系的森林图 Figure 3 Forest plot of association between urinary MEHP levels and serum T3 levels |
|
|
共有4篇文献[15-16, 19, 21]报道了DEHP暴露与血清T4水平的关系。异质性检验结果显示:文献间存在异质性(P<0.05,I2=97%),因此采用随机效应模型。人群尿MEHP水平与血清T4水平关系的Meta分析结果显示:OR=0.07(95%CI:0.01~0.39;P=0.002),表明DEHP暴露水平升高1 μg·L-1,血清T4水平降低7%。见图 4。
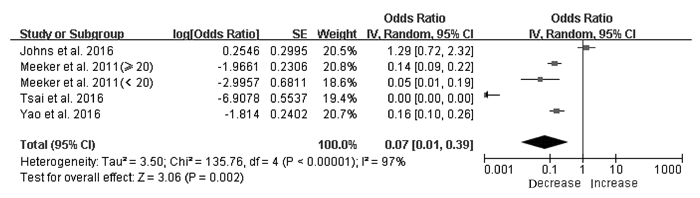
|
| 图 4 尿MEHP水平与血清T4水平关系的森林图 Figure 4 Forest plot of association between urinary MEHP levels and serum T4 levels |
|
|
Egger’s检验结果显示:纳入文献不存在明显的发表偏倚(TSH:P=0.133;FT4:P=0.918;T3:P=0.689;T4:P=0.365)。见表 2。
| Hormone | Std_Eff | Coef. | Std.Err. | t | P>|t| | 95%CI |
| TSH | Slope | 0.099 936 | 0.249 916 | 0.40 | 0.703 | -0.511 588-0.711 461 |
| Bias | -4.437 304 | 2.550 098 | -1.74 | 0.133 | -10.677 170-1.802 561 | |
| FT4 | Slope | -2.074 030 | 3.272 746 | -0.63 | 0.554 | -10.486 890-6.338 831 |
| Bias | -0.914 661 | 8.405 303 | -0.11 | 0.918 | -22.521 180-20.691 860 | |
| T3 | Slope | -0.174 123 | 2.507 402 | -0.07 | 0.948 | -7.135 788-6.787 541 |
| Bias | -2.351 185 | 5.463 168 | -0.43 | 0.689 | -17.519 370-12.817 000 | |
| T4 | Slope | 0.351091 | 2.161 724 | 0.16 | 0.881 | -6.528 480-7.230 663 |
| Bias | -7.481 601 | 7.018 330 | -1.07 | 0.365 | -29.817 060-14.853 860 |
近年来,甲状腺疾病的发病率持续增长,并且呈现低龄化趋势[22],据文献[23]报道:我国2000-2010年甲状腺癌发病率由2.51/10万上升至6.56/10万。动物毒理学研究结果[24-25]显示:DEHP暴露可对甲状腺产生毒性作用,引起甲状腺组织病理学改变,下调甲状腺激素运载蛋白基因转录水平,影响激素生物转运;或通过促进肝脏二磷酸尿苷葡萄糖醛酸基转移酶表达,加速甲状腺激素水解,从而降低血清甲状腺激素水平。但关于人群DEHP暴露与甲状腺激素水平关系的研究结论尚不一致。
本研究通过制定严格的纳入标准和排除标准,对目前公开发表的关于人群DEHP及其代谢产物MEHP水平与血清甲状腺相关激素水平关系的7篇文献进行Meta分析,明确DEHP暴露与甲状腺激素水平的关系。异质性检验结果显示:本次纳入的7篇文献存在异质性,可能的原因是研究对象的基线不一致及暴露水平不同所导致的。有研究[26]报道:邻苯二甲酸类的暴露程度与人群社会阶层和教育程度有关。由于本次研究纳入文献较少,不能对研究对象进行分层或亚组分析,因此纳入文献存在一定的异质性。
本Meta分析结果显示:DEHP暴露水平升高1 μg·L-1,血清TSH、FT4和T4水平分别降低了10%、6%和7%,血清T3水平无明显变化。上述结果可能是由于DEHP可降低甲状腺滤泡细胞钠碘转运体的生物活性,影响细胞摄碘能力,竞争性结合甲状腺激素受体,使激素的生物合成和转运受阻[27-28],从而使血清中甲状腺激素水平降低。此外,机体内甲状腺激素水平是由下丘脑-垂体-甲状腺轴精确调节,DEHP暴露可下调实验动物促甲状腺激素释放激素和TSH水平,甲状腺TSH受体蛋白表达降低,轴调节平衡被破坏,也可导致血清甲状腺激素水平下降[25, 29-31]。
但本次研究尚存在以下局限性:受各地经济文化差异影响,DEHP暴露水平无法控制,无法对地区进行分层,导致文献存在异质性;人群DEHP暴露与甲状腺激素水平关系的研究较少,无法对研究对象年龄差异进行控制,这可能会导致Meta分析结果出现混杂偏倚。关于塑化剂暴露水平与人群甲状腺激素水平的关系,尚需开展更多大样本、高质量的人群流行病学研究,并对研究地区和研究对象进行分层,为全面了解塑化剂的暴露情况和深入探索甲状腺疾病的病因提供可靠依据。
综上所述,人群DEHP暴露水平增加可不同程度降低血清甲状腺激素水平。
| [1] | Testai E, Hartemann P, Rastogi SC, et al. The safety of medical devices containing DEHP plasticized PVC or other plasticizers on neonates and other groups possibly at risk (2015 update)[J]. Regul Toxicol Pharmacol, 2016, 76(4): 209–210. |
| [2] | Al-Natsheh M, Alawi M, Fayyad M, et al. Simultaneous GC-MS determination of eight phthalates in total and migrated portions of plasticized polymeric toys and childcare articles[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2015, 985: 103–109. DOI:10.1016/j.jchromb.2015.01.010 |
| [3] | Al-Saleh I, Elkhatib R. Screening of phthalate esters in 47 branded perfumes[J]. Environ Sci Pollut Res Int, 2016, 23(1): 455–468. DOI:10.1007/s11356-015-5267-z |
| [4] | Wang J, Chen G, Christie P, et al. Occurrence and risk assessment of phthalate esters (PAEs) in vegetables and soils of suburban plastic film greenhouses[J]. Sci Total Environ, 2015, 523(8): 129–137. |
| [5] | Schettler T. Human exposure to phthalates via consumer products[J]. Int J Androl, 2006, 29(1): 134–139. DOI:10.1111/ija.2006.29.issue-1 |
| [6] | Liu T, Li N, Zhu J, et al. Effects of di-(2-ethylhexyl) phthalate on the hypothalamus-pituitary-ovarian axis in adult female rats[J]. Reprod Toxicol, 2014, 46: 141–147. DOI:10.1016/j.reprotox.2014.03.006 |
| [7] | Martins K, Applegate B, Hagedorn B, et al. Di (2-ethylhexyl) phthalate inhibits B cell proliferation and reduces the abundance of IgM-secreting cells in cultured immune tissues of the rainbow trout[J]. Fish Shellfish Immunol, 2015, 44(1): 332–341. DOI:10.1016/j.fsi.2015.02.037 |
| [8] | Lo D, Wang YT, Wu MC. Hepatoprotective effect of silymarin on di (2-ethylhexyl) phthalate (DEHP) induced injury in liver FL83B cells[J]. Environ Toxicol Pharmacol, 2014, 38(1): 112–118. DOI:10.1016/j.etap.2014.05.005 |
| [9] | Wang WL, Wu QY, Wang C, et al. Health risk assessment of phthalate esters (PAEs) in drinking water sources of China[J]. Environ Sci Pollut Res Int, 2015, 22(5): 3620–3630. DOI:10.1007/s11356-014-3615-z |
| [10] | Jia X, Harada Y, Tagawa M, et al. Prenatal maternal blood triglyceride and fatty acid levels in relation to exposure to di (2-ethylhexyl) phthalate:a cross-sectional study[J]. Environ Health Prev Med, 2015, 20(3): 168–178. DOI:10.1007/s12199-014-0440-4 |
| [11] | Rajesh P, Balasubramanian K. Di (2-ethylhexyl) phthalate exposure impairs insulin receptor and glucose transporter 4 gene expression in L6 myotubes[J]. Hum Exp Toxicol, 2014, 33(7): 685–700. DOI:10.1177/0960327113506238 |
| [12] | Meeker JD, Calafat AM, Hauser R. Di (2-ethylhexyl) phthalate metabolites may alter thyroid hormone levels in men[J]. Environ Health Perspect, 2007, 115(7): 1029–1034. DOI:10.1289/ehp.9852 |
| [13] | Huang PC, Kuo PL, Guo YL, et al. Associations between urinary phthalate monoesters and thyroid hormones in pregnant women[J]. Hum Reprod, 2007, 22(10): 2715–2722. DOI:10.1093/humrep/dem205 |
| [14] | Boas M, Hegedüs L, Feldt-Rasmussen U, et al. Association of thyroid gland volume, serum insulin-like growth factor-I, and anthropometric variables in euthyroid prepubertal children[J]. J Clin Endocrinol Metab, 2009, 94(10): 4031–4035. DOI:10.1210/jc.2009-0939 |
| [15] | Tsai HJ, Wu CF, Tsai YC, et al. Intake of Phthalate-tainted Foods and Serum Thyroid Hormones in Taiwanese Children and Adolescents[J]. Sci Rep, 2016, 6: 30589. DOI:10.1038/srep30589 |
| [16] | Johns LE, Ferguson KK, McElrath TF, et al. Associations between repeated measures of maternal urinary phthalate metabolites and thyroid hormone parameters during pregnancy[J]. Environ Health Perspect, 2016, 124(11): 1808–1815. |
| [17] | Wells GA, Shea BJ, O' Connell D, et al.The Newcastle-Ottawa Scale (NOS) for assessing the quality of nonrandomized studies in Meta-analysis[OL].http://www.ohri.ca/programs/clinical_epidemiology/oxford.htm. |
| [18] | Minatoya M, Naka Jima S, Sasaki S, et al. Effects of prenatal phthalate exposure on thyroid hormone levels, mental and psychomotor development of infants:The Hokkaido Study on Environment and Children's Health[J]. Sci Total Environ, 2016, 565: 1037–1043. DOI:10.1016/j.scitotenv.2016.05.098 |
| [19] | Yao HY, Han Y, Gao H, et al. Maternal phthalate exposure during the first trimester and serum thyroid hormones in pregnant women and their newborns[J]. Chemosphere, 2016, 157: 42–48. DOI:10.1016/j.chemosphere.2016.05.023 |
| [20] | Johns LE, Ferguson KK, Soldin OP, et al. Urinary phthalate metabolites in relation to maternal serum thyroid and sex hormone levels during pregnancy:a longitudinal analysis[J]. Reprod Biol Endocrinol, 2015, 13: 4. DOI:10.1186/1477-7827-13-4 |
| [21] | Meeker JD, Ferguson KK. Relationship between urinary phthalate and bisphenol A concentrations and serum thyroid measures in U.S.adults and adolescents from the National Health and Nutrition Examination Survey (NHANES) 2007-2008[J]. Environ Health Perspect, 2011, 119(10): 1396–1402. DOI:10.1289/ehp.1103582 |
| [22] | Larsen PR. Decade in review-thyroid disease:The endocrinology of thyroid disease from 2005 to 2015[J]. Nat Rev Endocrinol, 2015, 11(11): 634–636. DOI:10.1038/nrendo.2015.169 |
| [23] | Chen W, Zheng R, Zuo T, et al. National cancer incidence and mortality in China, 2012[J]. Chin J Cancer Res, 2016, 28(1): 1–11. |
| [24] | Zhai W, Huang Z, Chen L, et al. Thyroid endocrine disruption in zebrafish larvae after exposure to mono-(2-ethylhexyl) phthalate (MEHP)[J]. PLoS One, 2014, 9(3). |
| [25] | Liu C, Zhao L, Wei L, et al. DEHP reduces thyroid hormones via interacting with hormone synthesis-related proteins, deiodinases, transthyretin, receptors, and hepatic enzymes in rats[J]. Environ Sci Pollut Res Int, 2015, 22(16): 12711–12719. DOI:10.1007/s11356-015-4567-7 |
| [26] | Casas L, Fernández MF, Llop S, et al. Urinary concentrations of phthalates and phenols in a population of Spanish pregnant women and children[J]. Environ Int, 2011, 37(5): 858–866. DOI:10.1016/j.envint.2011.02.012 |
| [27] | Shen O, Du G, Sun H, et al. Comparison of in vitro hormone activities of selected phthalates using reporter gene assays[J]. Toxicol Lett, 2009, 191(1): 9–14. DOI:10.1016/j.toxlet.2009.07.019 |
| [28] | Wenzel A, Franz C, Breous E, et al. Modulation of iodide uptake by dialkyl phthalate plasticisers in FRTL-5 rat thyroid follicular cells[J]. Mol Cell Endocrinol, 2005, 244(1/2): 63–71. |
| [29] | Erkekoglu P, Giray BK, Kizilgun M, et al. Thyroidal effects of di-(2-ethylhexyl) phthalate in rats of different selenium status[J]. J Environ Pathol Toxicol Oncol, 2012, 31(2): 143–153. DOI:10.1615/JEnvironPatholToxicolOncol.v31.i2 |
| [30] | 李庆, 刘婵, 夏佳佳, 等. 成人生长激素缺乏症患者内脏脂肪指数与心血管疾病风险因素的相关性研究[J]. 解放军医学杂志, 2016, 41(10): 842–846. |
| [31] | 田园如画, 周中和, 陈会生. 腺苷酸活化蛋白激酶在缺血预处理诱导的神经保护的作用[J]. 解放军医学杂志, 2015, 40(5): 366–371. |
 2017, Vol. 43
2017, Vol. 43


