扩展功能
文章信息
- 张玮航, 张虎, 李英姿, 汪德州, 张艳, 宋文植
- ZHANG Weihang, ZHANG Hu, LI Yingzi, WANG Dezhou, SONG Wenzhi
- 3D打印激光快速成型牙种植体的制备及其机械性能分析
- Preparation of 3D printing laser rapid prototyping dental implants and analysis on their mechanical properties
- 吉林大学学报(医学版), 2017, 43(01): 52-56
- Journal of Jilin University (Medicine Edition), 2017, 43(01): 52-56
- 10.13481/j.1671-587x.20170111
-
文章历史
- 收稿日期: 2016-10-28
种植义齿被称为“人类的第三副牙齿”,以种植体为人工牙根替代天然牙根并修复上部牙冠结构,具有舒适、恢复咀嚼效率高和不损伤邻牙的特点,已成为口腔临床修复牙列缺损与牙列缺失的首选治疗方案。但目前的种植义齿修复多为二期手术植入种植体,不仅疗程长,患者在等候拔牙创愈合过程中丧失了部分宝贵的骨量,而且常用的进口种植体价格昂贵,多为采用铸造工艺批量生产的型号统一、形态规则的种植体,无法满足临床上个性化和一些解剖结构特殊患者的需求,因此如何实现个性化即刻种植已成为目前口腔种植领域的研究热点和发展方向。
以数字化、网络化、个性化和定制化为特点的3D打印技术是新制造技术的代表,其使口腔临床实现个性化即刻种植成为可能。激光快速成型技术作为金属3D打印技术的一种,可以直接将3D计算机辅助设计(3D CAD)转化为实物,获得几乎任意形状的高精度金属零件[1],因此本文作者设想可根据不同患者牙位,打印出符合不同牙槽窝形态的个性化种植体,不仅有利于提高即刻种植的初期稳定性和临床成功率,还可以缩短疗程,降低治疗成本,而且有望实现种植体国产化进程。种植体作为生物医用植入材料,代替牙齿行使咬牙合和咀嚼等功能,除具有良好的生物相容性还必须具有良好的机械性能[2]。因此本研究拟通过3D打印激光快速成型技术制备牙科钛合金种植体材料,并测试其机械性能,以期为3D打印种植体的研发和临床应用奠定基础。
1 材料与方法 1.1 实验材料和设备①实验材料:TC4(Ti-6Al-4V)钛合金粉(山东省莱芜市奥星粉末材料有限公司),粉体粒度15~45 μm,化学成分(质量分数,%):5.5~6.5 Al,3.5~4.5 V,0.20 O,0.015 H,0.05 N,0.08 C,0.30 Fe,0.04 Si,其余为Ti。②实验设备:FORWEDO LM120激光熔化3D打印机(哈尔滨福沃德多维智能装备有限公司),RTP-1600真空退火炉(韩国Ecopia公司),D/MAX 2000/PC型X-射线衍射仪(日本理学公司),能谱仪(美国EDSX-Falcon公司),DMI3000M金相显微镜(德国徕卡公司),TECH FM-700显微硬度测试仪(日本FUTURE-TECH公司),WDW-200微机控制电子式万能试验机(吉林省长春市科新试验仪器有限公司),JSM-5500LV扫描电子显微镜(日本电子株式会社)。
1.2 激光打印快速成型钛合金牙种植体材料的制备在计算机上以V5R20 CATIA三维模型设计软件(法国达索公司)建立3D打印牙种植体和标准试件数据模型:①直径4.1 mm×13 mm圆柱型种植体模型;②10.0 mm×10.0 mm×1.0 mm标准试件;③拉伸试件:原标距长度55 mm,平行长度75 mm,宽10 mm,厚2 mm (国家GB-T 228.1-2010标准[3])。分别在FORWEDO LM120激光熔化3D打印机上打印完成钛合金牙种植体及标准试件。3D打印工艺参数为:激光功率200 W,扫描速度400 mm·s-1,每层扑粉厚度50 μm,光斑直径75 μm,,经过逐层熔结叠加完成打印,冷却,全程氩气保护, 真空退火炉中退火(750℃、0.5 h),自然冷却,金相抛光机抛光备用。
1.3 检测内容和方法①X射线衍射(XRD)检测:扫描速度4°·min-1,扫描角度30°~90°,在X-射线能谱(EDS)分析仪上进行定量化学组分分析;②金相显微镜下观察试件组织形貌;③显微硬度测试仪测定试件维氏硬度:硬度载荷200 g,加载时间10s,每个试件随机测10个点,计算试件硬度范围; ④拉伸实验:将10个拉伸试件置于微机控制电子式万能试验机上进行拉伸实验,拉伸时使用位移控制,加载速度为1 mm·min-1,3D打印试件的抗拉强度、屈服强度和延伸率按下列公式计算,拉伸强度(σb)=Fb/So,屈服强度(Re)=Fe/So,延伸率(δ)=ΔL/L×100% (Fb:最大拉伸应力;So:原始横截面积;Fe:屈服点的应力;L:原标距长度;ΔL:总变形长度);⑤扫描电镜下观察试件断面形貌。
2 结果 2.1 3D打印钛合金材料试件激光熔化3D打印机打印出的种植牙见图 1A,未打磨抛光镶嵌实验试件见图 1B,拉伸实验试件见图 1C。

|
| A:Dental implat; B, C:Test specimens 图 1 3D打印钛合金材料试件 Figure 1 Samples of titanium alloy made by 3D printing technology |
|
|
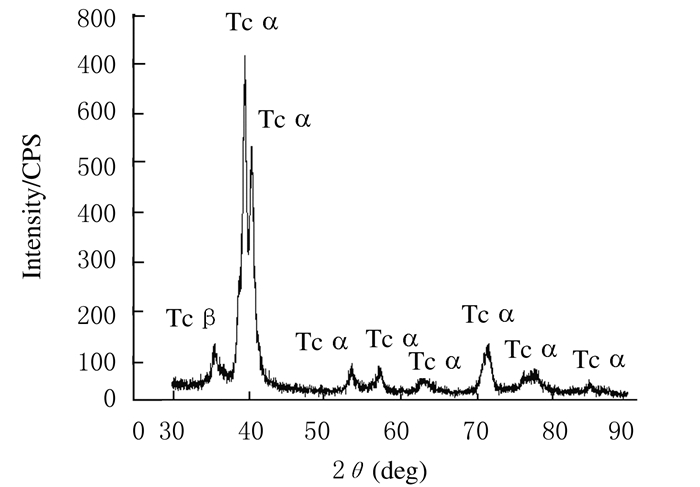
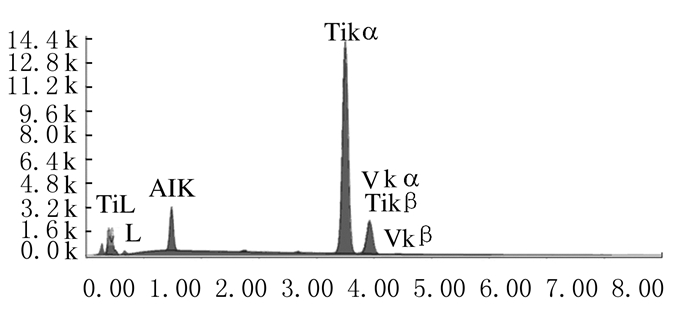
3D打印试件XRD图谱中,可见XRD曲线中第一个峰显示为β相组成,其余均显示为α相组成(图 2);EDS分析结果显示:3D打印过程中粘结剂以及熔融金属时的高热都会使钛合金发生物理和微小化学变化,3D打印钛合金试件中元素含量(质量分数)分别为5.59%Al、3.67%V和90.74%Ti,与原粉体基本一致(图 3)。
|
| 图 2 3D打印试件XRD图谱 Figure 2 XRD map of 3D printing sample |
|
|
|
| 图 3 3D打印种植体能谱分析结果 Figure 3 EDS of 3D printing dental implant |
|
|
金相显微镜下观察:退火前后可见3D打印钛合金材料为典型的网篮状结构,退火后的显微结构比退火前更加均匀。见图 4(插页三)。

|
| A:Before annealing; B:After annealing. 图 4 3D打印钛合金材料试件显微结构(×200) Figure 4 Microstructure of 3D printing titanium alloy dental material sample (×200) |
|
|
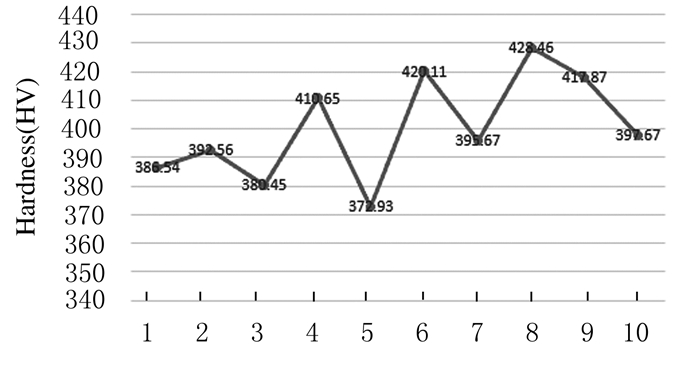
显微硬度测试仪检测,3D打印钛合金种植体材料维氏硬度范围为372.93~428.46 HV。见图 5。
|
| 图 5 3D打印种植体材料显微硬度 Figure 5 Micro hardness of 3D printing dental implants material |
|
|
3D打印钛合金材料标准试件的拉伸强度为(1 821.7±146.2) MPa,屈服强度为(1 355.9±109.7) Mpa,延伸率为(31.3±1.8)%,本实验条件下制备的3D打印快速成型钛合金材料可满足国家GB-T 13810-2007标准[4]中牙种植体材料机械性能要求。
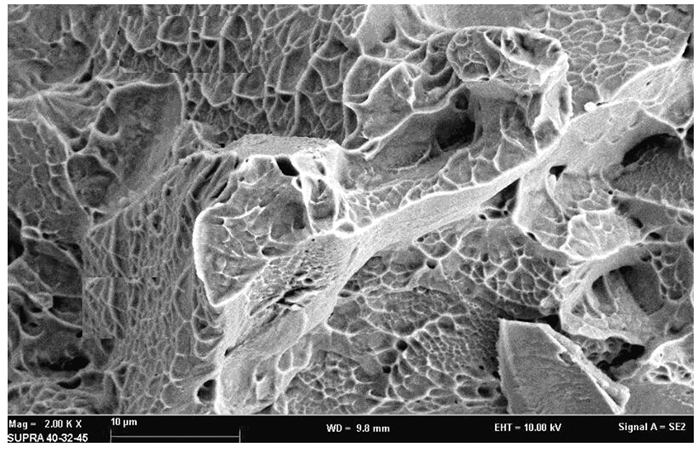
2.6 3D打印钛合金材料试件断面形貌扫描电镜下观察:3D打印钛合金材料试件断面密布大小不一的韧窝,为典型韧性断裂形态。见图 6。
|
| 图 6 3D打印种植体断面扫描电镜图(×2 000) Figure 6 SEM sectiongraph of 3D printing dental implants (×2 000) |
|
|
3D打印技术是目前先进制造技术的重要发展方向,是在计算机中将3D CAD模型分成若干层,通过3D打印设备在一个平面上按照3D CAD层图形,将塑料、金属甚至生物组织活性细胞等材料烧结或者黏合在一起,然后再一层一层地叠加起来。通过每一层不同图形的累积,最后形成一个三维物体[5-6]。利用3D打印金属快速成型技术可以直接获得几乎任意形状、具有完全冶金结合和高精度的近乎致密金属零件[7-8],因此被广泛地应用到医疗领域[9-12],可以成型具有复杂结构且与生物体具有良好相容性的植入体,如个性化骨科手术模板、个性化股骨植入体和个性化牙冠牙桥植入体等。3D打印技术的出现使口腔临床实现个性化即刻种植成为可能,与传统种植方式比较,个性化设计即刻种植有如下优点[13]:①口腔即刻种植,避免了拔牙创愈合过程中的骨量丧失,减少了后期进行骨增量手术的可能性,降低了治疗成本;②个性化设计制造的种植体与拔牙窝形态高度密合,不仅增加种植体初期稳定性,提高种植成功率,而且使植体颈部与拔牙窝间间隙减小,不用或少用骨粉和骨胶原;③直接恢复患者前牙区的美观功能,更加符合患者美观要求;④缩短疗程,减低患者痛苦;⑤3D打印不仅可以实现种植体的个性化设计,而且在实体制造中省去了冗长而昂贵的模具制造过程,符合节能环保理念;⑥3D打印技术可以制造出几何形态复杂、孔隙结构梯度变化的个性化种植体,该新材料新技术制造的个性化种植体不仅具有良好的生物相容性,而且能满足各种特殊解剖结构患者的需求。
目前,采用3D打印技术制备牙种植体已成为口腔医学领域的研究热点。3D打印技术制备牙种植体将改变以往传统种植体铸造加工的制备模式,大大降低成本并推进临床种植义齿向个性化即刻种植方式的转变。本文作者以3D打印激光快速成型技术制备出钛合金牙种植体并研究其机械性能,以期为应用3D打印技术制备牙种植体和制备满足即刻种植要求的个性化牙种植体奠定基础。
本实验中设计了长10.0 mm、直径4.1 mm的种植体计算机模型和不同尺寸的标准试件模型,通过3D打印技术完成植体和试件的快速成型,XRD结果显示:3D打印成型的钛合金材料微观结构大部分由α相组成,β相含量较少,其蠕变强度较高,有利于抵抗种植体在口腔中受到长期的咀嚼力;打印成型后EDS结果显示:试件化学元素组成仍与原始粉体基本一致,符合国家GB-T 3620.1-2007标准[14]中TC4钛合金的化学元素组成,说明3D打印过程中粘结剂和熔融金属时的高热并未使钛合金发生影响性能的化学变化;金相显微镜下观察:钛合金试件中片状α相和晶间β相相互交织,形成网篮状组织,是典型的快速凝固状态下的组织形貌,退火后3D打印试件的微观组织结构较退火前更为均匀,未见气孔和裂纹等缺陷,保证了3D打印钛合金种植体材料良好的机械性能。
金属硬度与加工工艺和合金中的元素组成等有关,3D打印TC4钛合金的硬度接近于牙釉质且远高于牙本质和骨松质[15],因此3D打印种植材料需在一定程度上降低硬度,与松质骨硬度相近,才可减小对骨质的磨损,有利于种植体在口腔内的稳定性。
本研究中3D打印种植体材料的拉伸强度、屈服强度和延伸率均符合国家GB-T 13810-2007标准中有关外科植入用钛合金材料的要求;扫描电镜观察:3D打印钛合金材料断面可见大小不一的韧窝状结构,为典型的韧性断裂形态,说明其韧性较好,有利于承担口腔咀嚼过程中的复杂受力状态。因此本文作者认为:本研究条件下制备的3D打印钛合金材料的微观结构和机械性能均可满足口腔牙种植体材料要求。
目前口腔牙种植体材料多为纯钛材料,仍存在与天然骨组织生物力学相容性差的问题。3D打印牙种植体材料仍需在材料成分和材料结构上加以改进,比如在钛合金等基础材料中加入硅基材料以降低其弹性模量,使其力学性质更接近于天然骨组织;或在种植体打印设计时设计为梯度孔隙结构,中间为高强度致密结构,植体表面设计为模拟松质骨孔隙的多孔结构,以达到更好的骨诱导及骨整合效果[16]。
本研究应用3D打印激光快速成型技术制备牙种植体并对其材料机械性能等进行研究,结果表明:3D打印快速成型技术制备的钛合金材料可满足牙种植体材料要求。本研究结果为应用3D打印快速成型技术制备牙种植体和将3D打印技术用于口腔个性化即刻种植提供了实验依据。
| [1] | 杨永强, 刘洋, 宋长辉. 金属零件3D打印技术现状及研究进展[J]. 机电工程技术, 2013, 42(4): 1–7. |
| [2] | Zadpoor AA, Hedayati R. Analytical relationships for prediction of the mechanical properties of additively manufactured porous biomaterials[J]. J Biomed Mater Res A, 2016, 104(12): 3164–3174. DOI:10.1002/jbm.a.35855 |
| [3] | GB-T.228.1-2010.金属材料拉伸试验第1部分:室温实验方法[S].北京:中国标准出版社, 2008. |
| [4] | GB-T.13810-2007.外科植入物用钛及钛合金加工材[S].北京:中国标准出版社, 2007. |
| [5] | O'Brien CM, Holmes B, Faucett S, et al. Three-dimensional printing of nanomaterial scaffolds for complex tissue regeneration[J]. Tissue Eng Part B Rev, 2015, 21(1): 103–114. DOI:10.1089/ten.teb.2014.0168 |
| [6] | Levine JP, Patel A, Saadeh PB, et al. Computer-aided design and manufacturing in craniomaxillofacial surgery:The new state of the art[J]. J Craniofac Surg, 2012, 23: 288–293. DOI:10.1097/SCS.0b013e318241ba92 |
| [7] | Poh PSP, Chhaya MP, Wunner FM, et al. Polylactides in additive biomanufacturing[J]. Adv Drug Deliv Rev, 2016, 107: 228–246. DOI:10.1016/j.addr.2016.07.006 |
| [8] | Horn TJ, Harrysson OL. Overview of current additive manufacturing technologies and selected applications[J]. Sci Prog, 2012, 95: 255–282. DOI:10.3184/003685012X13420984463047 |
| [9] | Alhnan MA, Okwuosa TC, Sadia M, et al. Emergence of 3D printeddosage forms:opportunities and challenges[J]. Pharm Res, 2016, 33: 1817–1832. DOI:10.1007/s11095-016-1933-1 |
| [10] | Mulford JS, Sina B, Mackay N. Three-dimensional printing in orthopaedic surgery:review of current and future applications[J]. ANZ J Surg, 2016, 86: 648–653. DOI:10.1111/ans.13533 |
| [11] | Chen ST, Chang CJ, Su WC, et al. 3-D titanium mesh reconstruction of defective skull after frontal craniectomy in traumatic brain injury[J]. Injury, 2015, 46: 80–85. DOI:10.1016/j.injury.2014.09.019 |
| [12] | Malhotra K, Sharma A, Giraddi G, et al. Versatility of titanium 3D plate in comparison with conventional titanium miniplate fixation for the management of mandibular fracture[J]. J Maxillofac Oral Surg, 2012, 11: 284–290. DOI:10.1007/s12663-012-0340-3 |
| [13] | Chen JY, Zhang ZG, Chen XH, et al. Design and manufacture of customized dental implants by using reverse engineering and selective laser melting technology[J]. J Prosthet Dent, 2014, 112(5): 1088–1095. DOI:10.1016/j.prosdent.2014.04.026 |
| [14] | GB-T.3620.1-2007.钛及钛合金牌号和化学成分[S].北京:中国标准出版社, 2007. |
| [15] | 陈治清. 口腔材料学[M]. 2版. 北京: 人民卫生出版社,2001: 19-69, 153. |
| [16] | Shah FA, Snis A, Matic A, et al. 3D printed Ti6Al4V implant surface promotes bone maturation and retains a higher density of less aged psteocytes at the bone-implant interface[J]. Acta Biomater, 2016, 30: 357–367. DOI:10.1016/j.actbio.2015.11.013 |
 2017, Vol. 43
2017, Vol. 43


